敲除背根神經(jīng)節(jié)Fcgr1減弱類風濕關(guān)節(jié)炎模型大鼠NF-κB/NLRP3通路活化
劉 帆,蘇 思,王 濤,袁 勃,馬 超
(中國醫(yī)學科學院基礎醫(yī)學研究所 北京協(xié)和醫(yī)學院基礎學院 人體解剖與組織胚胎學系,北京 100005)
類風濕關(guān)節(jié)炎(rheumatoid arthritis,RA)疼痛嚴重影響患者生活質(zhì)量,其病因尚不明確,缺乏有效的藥物和治療措施,是世界性的難題[1]。RA的常見特征是血清或受累組織中自身抗原特異性免疫球蛋白IgG,及免疫復合物(immunoglobulin G-immune complex,IgG-IC)異常升高[2-3]。
高親和力(high affinity)免疫球蛋白G(immunoglobulin, IgG)是IgG Fc段的受體[constant fragment(Fc)-gamma receptor Ⅰ,FcγRⅠ],主要表達于免疫細胞,能夠被IgG-IC激活[3]。近年來發(fā)現(xiàn),F(xiàn)cγRⅠ在小鼠和大鼠外周感覺神經(jīng)元上表達,并與部分痛覺神經(jīng)元標志物如P物質(zhì)和降鈣素基因相關(guān)肽等共表達[4-7]。IgG-IC可直接激活離體培養(yǎng)的外周神經(jīng)元,還可在體引起大鼠痛覺過敏[7]。盡管IgG-IC可通過FcγRⅠ激活巨噬細胞等免疫細胞,釋放炎性因子,引起疼痛[1-2, 8]。但外周感覺神經(jīng)元FcγRⅠ如何直接參與RA疼痛的機制,仍未完全闡明。本研究揭示了一個外周感覺神經(jīng)元通過FcγRⅠ直接參與RA疼痛發(fā)生的新機制,將為治療RA疼痛提供新的策略和實驗依據(jù)。
1 材料與方法
1.1 材料
1.1.1 動物:SPF級野生型雌性SD大鼠14只,體質(zhì)重180~200 g(北京華阜康生物科技股份有限公司,許可證編號SCXK〈京〉2009-0017),7只體質(zhì)重180~200 g的SPF級雌性外周感覺神經(jīng)元條件敲除Fcgr1大鼠(SD大鼠遺傳背景引自中國醫(yī)學科學院醫(yī)學實驗動物研究所張連峰實驗室)。條件敲除(conditional knockout, CKO)Fcgr1大鼠的打靶方案和鑒定見參考文獻[9]。該研究項目通過中國醫(yī)學科學院基礎醫(yī)學研究所倫理審查委員會審查(項目編號011-2014)。本研究所有動物的使用和實驗操作嚴格遵循中華人民共和國國家科學技術(shù)委員會發(fā)布的《實驗動物管理條例》,并給予實驗動物福利關(guān)照。
1.1.2 試劑:雞卵清蛋白(Sigma-Aldrich公司);小鼠抗pNF-κB (p65)和GFAP一抗(Cell Signaling Technology公司);豚鼠抗PGP9.5、兔抗IL-1β和兔抗Iba1一抗(Abcam公司);兔抗NLRP3一抗(Proteintech公司);兔抗IL-18一抗(Abnova公司);Donkey anti-rabbit IgG H&L(Alexa Fluor?594)、Donkey anti-rabbit IgG H&L(Alexa Fluor?488)、Donkey anti-mouse IgG H&L(Alexa Fluor?594)、Donkey anti-mouse IgG H&L(Alexa Fluor?488)和Donkey anti-guinea pig IgG H&L(Alexa Fluor?488)熒光標記二抗(Jackson ImmunoResearch公司)。
1.2 方法
1.2.1 實驗動物的分組及處理:野生型大鼠隨機分為對照組(control組)和類風濕關(guān)節(jié)炎(RA)組,每組7只;條件敲除Fcgr1大鼠7只建立類風濕關(guān)節(jié)炎(CKO+RA)組。根據(jù)參考文獻[9],將2.5 mg 雞卵清蛋白(ovalbumin, OVA)溶于250 μL 0.9%氯化鈉溶液,與等體積弗氏完全佐劑混合成乳劑。第0天和第7天在大鼠背部皮下注射500 μL乳劑(100 μL/點,注射5個點)。Control組為背部僅注射弗氏完全佐劑大鼠。第2次注射14 d后,大鼠右側(cè)踝關(guān)節(jié)腔內(nèi)注射50 μL OVA溶液(5 mg OVA溶于50 μL 0.9%氯化鈉溶液)激發(fā),從而建立類風濕關(guān)節(jié)炎大鼠模型。踝關(guān)節(jié)注射OVA后出現(xiàn)關(guān)節(jié)疼痛為RA模型成功的標志。
1.2.2 大鼠疼痛行為學的檢測:根據(jù)參考文獻[9-11],使用BME-410C型熱痛刺激儀檢測各組大鼠熱痛閾值變化,使用IITC2390型電子von-Frey檢測大鼠機械痛閾值變化。疼痛行為測量分別在RA模型建立前第3和1天,及RA模型建立后第3、5、7和9天進行。
1.2.3 免疫熒光染色檢測蛋白表達:實驗大鼠在RA模型建立第9天后,腹腔注射1%戊巴比妥鈉(50 mg/kg)麻醉。4%多聚甲醛灌流,收集背根神經(jīng)節(jié)(dorsal root ganglion,DRG)和脊髓背角(spinal dorsal horn,SDH),進行4%多聚甲醛固定和30%蔗糖溶液脫水后,冰凍切片(片厚12 μm)。正常馬血清室溫封閉1 h后,加入一抗4 ℃孵育過夜:pNF-κB (p65)(1∶200)、PGP9.5(1∶100)、NLRP3(1∶200)、IL-1β(1∶150)、IL-18(1∶200)、GFAP(1∶300)、Iba1(1∶300);漂洗后分別加入熒光二抗(1∶1 000),室溫孵育1 h,封片后熒光顯微鏡觀察。根據(jù)已發(fā)表文獻[10],使用ImageJ軟件對DRG和SDH表達的pNF-κB (p65)、NLRP3、IL-1β、IL-18、GFAP和Iba1的熒光強度進行測定。
1.2.4 熒光原位雜交實驗: 根據(jù)參考文獻[9]進行確定Fcgr1條件敲除大鼠DRG中是否表達Fcgr1mRNA。
1.3 統(tǒng)計學分析
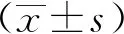
2 結(jié)果
2.1 FcγRⅠ對背根神經(jīng)節(jié)神經(jīng)元NF-κB/NLRP3通路活化的影響
建模前各組大鼠機械痛和熱痛閾值無明顯差異;模型建立后,RA組大鼠機械痛和熱痛閾值與對照組大鼠相比顯著下降(P<0.05);與RA組比較,模型建立后的(RA+CKO)組大鼠機械痛和熱痛閾值提高(P<0.05)(圖1A,B)。
與對照組比較,RA組DRG中pNF-κB(p65)和NLRP3表達明顯上調(diào),而RA+CKO組DRG中pNF-κB(p65)和NLRP3表達較RA組下降(P<0.05)(圖1C,E)。免疫熒光實驗進一步顯示DRG中pNF-κB(p65)與神經(jīng)元標志物PGP9.5共表達(圖1F),NLRP3與pNF-κB(p65)共表達(圖1G)。熒光原位雜交實驗顯示在野生型大鼠DRG神經(jīng)元中表達Fcgr1mRNA,條件敲除大鼠DRG神經(jīng)元中不表達Fcgr1mRNA(圖1H,I)。

A, B.compared with control group, the mechanical and thermal pain threshold in the RA group decreased, *P<0.05 compared with control group(n=7); mechanical and thermal pain threshold of (RA+CKO) group were significantly higher than RA group,#P<0.05 compared with RA group(n=7); g.gram, s.second; C.expression of pNF-κB (p65) in the DRG of rats in each group; D.expression of NLRP3 in the DRG of rats of each group; E.fluorescent intensity analysis of pNF-κB(p65) and NLRP3 expression in the DRG of rats in each group,*P<0.05 compared with control group; #P<0.05 compared with RA group(n=7); F.co-expression of pNF-κB(p65) and neuron marker PGP9.5 in the DRG; G.NLRP3 and pNF-κB(p65) were co-expressed in the DRG; H, I.FcγR Ⅰ mRNA was detected by fluorescence in situ hybridization at DRG slices; scale bar=25 μm in C, D, F, G, H and I
2.2 FcγRⅠ對背根神經(jīng)節(jié)神經(jīng)元炎性細胞因子IL-1β和IL-18表達的影響
與對照組比較,炎性因子IL-1β和IL-18在RA組DRG表達升高,(RA+CKO)組中IL-1β和IL-18較RA組表達下降(P<0.05)(圖2A~C)。免疫熒光染色進一步顯示在DRG中IL-1β和IL-18分別與pNF-κB (p65)共表達(圖2B,D)。

A.expression of IL-1β in the DRG of rats in each group; B.expression of IL-18 in the DRG of rats in each group; C.fluorescent intensity analysis of IL-1β and IL-18 in the DRG of rats in each group;*P<0.05 compared with control group; #P<0.05 compared with RA group(n=7); D.IL-1β and pNF-κB(p65) were co-expressed in the DRG; E.co-expression of IL-18 and pNF-κB(p65) in the DRG; scale bar=25 μm in A, B, D and E
2.3 神經(jīng)元FcγRⅠ對類風濕關(guān)節(jié)大鼠脊髓背角膠質(zhì)細胞活化的影響
與對照組比較,星形膠質(zhì)細胞標志物神經(jīng)膠質(zhì)纖維酸性蛋白(glial fibrillary acidic protein,GFAP)和小膠質(zhì)細胞標志物Iba1在RA組大鼠SDH的表達水平均增加,而(RA+CKO)組大鼠SDH中GFAP和Iba1表達較RA組降低(P<0.05)(圖3A~C)。
3 討論
近年研究發(fā)現(xiàn)FcγRⅠ在神經(jīng)系統(tǒng)的神經(jīng)元上表達,并可以被IgG-IC激活[7,12]。關(guān)節(jié)炎疼痛大鼠FcγRⅠ主要在DRG中與傷害性感受如疼痛發(fā)生相關(guān)的小神經(jīng)元(直徑一般小于30 μm)上表達上調(diào)[7]。IgG-IC通過直接激活大鼠皮膚內(nèi)痛覺神經(jīng)纖維末梢上的FcγRⅠ從而產(chǎn)生疼痛[7]。痛覺神經(jīng)元持續(xù)活化可釋放神經(jīng)遞質(zhì)如谷氨酸和炎性因子如IL-1β、IL-18和TNF-α等引起中樞敏化,導致慢性疼痛的發(fā)展和維持[13]。
有研究顯示大鼠踝關(guān)節(jié)注射IgG-IC引起的關(guān)節(jié)疼痛,在神經(jīng)元Fcgr1敲除后明顯減弱[9]。IgG-IC結(jié)合神經(jīng)元FcγRⅠ,能夠激活神經(jīng)元內(nèi)Syk信號通路,并導致細胞內(nèi)鈣增加[12]。Syk信號激活可引起細胞內(nèi)MAPKs和NF-κB(p65)信號的活化增加,促進轉(zhuǎn)錄[9]。NF-κB(p65)磷酸化升高可引起IL-1β和IL-18表達增加[14]。NLRP3是炎性小體的核心成分,其高表達能夠誘導IL-1β和IL-18前體成熟和分泌。NF-κB/NLRP3信號的活化與疼痛發(fā)生和慢性疼痛的維持密切相關(guān)[15]。本研究表明建立RA疼痛模型后,大鼠DRG神經(jīng)元NF-κB磷酸化增加,并伴隨NLRP3和炎性因子表達上調(diào)。DRG神經(jīng)元能夠合成,并分泌炎性因子到中樞端的SDH,引起小膠質(zhì)細胞和星形膠質(zhì)細胞活化,產(chǎn)生中樞敏化(圖3D)[13]。綜上所述,DRG神經(jīng)元FcγRⅠ可能通過激活細胞內(nèi)NF-κB/NLRP3信號參與類風濕關(guān)節(jié)炎疼痛的發(fā)生和維持。

A.expression changes of GFAP in the SDH of rats in each group; B.expression changes of Iba1 in the SDH of rats in each group; scale bar=50 μm in A, B; C.average fluorescence intensity analysis of GFAP and Iba1 in the SDH of rats in each group; *P<0.05 compared with control group; #P<0.05 compared with RA group(n=7); D.pattern diagram of the DRG FcγRⅠ regulating neuroinflammation in RA

