血府逐瘀湯聯合亞低溫對急性腦梗死動脈溶栓術后缺血再灌注損傷的保護作用研究
孫 瑤,李柏霖,胡 楠
0 引言
急性腦梗死(Acute cerebral infarct,ACI)起病較急,致殘率和致死率較高,研究表明,約60%的患者會有后遺癥,嚴重影響生活質量[1-2]。動脈介入溶栓治療雖然療效顯著,但極易引起缺血-再灌注損傷(Cerebral ischemia reperfusion,CIR),對患者心血管、消化、呼吸等系統造成極大影響,嚴重者可造成器官功能障礙,甚至形成不可逆的功能喪失[3]。如何減輕ACI溶栓后CIR是優化治療結局的關鍵所在。血府逐瘀湯是腦病科常用方劑之一,近年來研究已證實,其對中樞神經系統、心血管系統等有著廣泛的藥理作用,能擴張腦血管、增加腦血流量、提高腦細胞的抗缺氧及損傷能力[4]。研究表明,亞低溫具有神經組織的保護作用,可以防止和減輕腦損傷[5-6]。基于以上理論,本研究探討血府逐瘀湯聯合亞低溫對ACI動脈溶栓后CIR的保護作用。
1 資料和方法
1.1 臨床資料 選擇2017年6月至2019年6月在我院行動脈介入溶栓術的60例ACI患者作為研究對象,按照住院號進行編號,根據隨機數字表法分為對照組和試驗組,每組30例。對照組男21例,女9例。年齡50~76歲,平均(62.18±7.54)歲。發病時間2~6 h,平均(3.46±0.44)h。既往史:高血壓20例,糖尿病15例,高血脂6例;試驗組男20例,女10例。年齡50~78歲,平均(62.44±7.60)歲。發病時間2~6 h,平均(3.63±0.45)h。既往史:高血壓24例,糖尿病12例,高血脂10例。兩組患者臨床基線資料比較差異無統計學意義(P>0.05),具有可比性。
1.2 納入、排除標準
1.2.1 納入標準 (1)符合《中國急性缺血性腦卒中診治指南2014》中ACI診斷標準[7];(2)首次發病,發病至溶栓時間<6 h;(3)有可評估的神經功能缺損;(4)神志清楚,能配合治療和檢測;(5)經醫院醫學倫理委員會討論批準,患者或家屬知曉且簽署知情同意書。
1.2.2 排除標準 (1)難以控制的高血壓,收縮壓≥180 mmHg和(或)舒張壓≥110 mmHg,或高血糖(>22.2 mmol/L);(2)頭CT或MRI顯示存在出血灶;(3)發病早期伴有癲癇發作;(4)嚴重的心、肺、肝、腎等臟器功能不全,或顱內動脈瘤、動靜脈畸形、既往出血性疾病;(5)近期急慢性感染;(6)不宜血府逐瘀湯和(或)亞低溫治療。
1.3 治療方法 參考2014年中國急性缺血性腦卒中診治指南,根據病情予動脈溶栓治療及常規治療:(1) 動脈溶栓:經右側股動脈做Seldinger法穿刺,根據腦DSA對相應阻塞血管選擇性接近并將微導管置于開口處,當發現阻塞血管時,在其相應的供血動脈處,予尿激酶(麗珠集團麗珠制藥廠,國藥準字H44020671)50 U+60 ml 0.9%氯化鈉注射液,40 min內滴注完畢,同時間隔10 min觀察是否再通,觀察到血管再通后立即停止治療;(2)脫水降顱壓;(3)抗心律失常;(4)保護腦;(5)嚴格監測和控制血壓、血糖、血脂,防止感染,維持水電解質平衡等。對照組予亞低溫治療:應用HGT-200Ⅳ型亞低溫治療儀,冰帽溫度設置為-2~4 ℃,腦溫維持在33~35 ℃,干預5~7 d。腦溫檢測:應用紅外線耳溫計測量鼓膜溫,使鼓膜溫度保持在33~35 ℃。試驗組在亞低溫治療基礎上予血府逐瘀湯治療,組方:當歸、生地各9 g,桃仁12 g,紅花9 g,枳殼、赤芍各6 g,柴胡3 g,甘草3 g,桔梗4.5 g,川芎4.5 g,牛膝10 g,煎煮400 ml,2次/d,治療7 d。
1.4 觀察指標 (1)炎癥因子:采集治療前及治療3、7 d外周靜脈血3 ml,3 500 r/min離心10 min,收集上層血清置-80 ℃保存。應用流式細胞微球芯片捕獲技術(CBA技術)檢測血清白介素-1β(IL-1β)、白介素-10(IL-10)水平,應用免疫比濁法檢測血清超敏C反應蛋白(hs-CRP)水平。(2)氧化應激因子:應用酶聯免疫吸附試驗(ELISA)檢測超氧化物歧化酶(SOD),應用硫代巴比妥酸法檢測丙二醛(MDA),試劑盒均購自南京森貝伽生物科技有限公司。(3)神經功能及顱內壓:檢測治療前及治療3、7 d顱內壓(ICP),應用閃光視覺誘發電位無創檢測ICP,由相應程序自動推算無創ICP值。應用美國國立衛生院神經功能缺損量表(NIHSS)評估神經功能。
1.5 療效評價標準 參考2015年國際腦卒中NIHSS評分評估臨床療效[8]。基本痊愈:NIHSS評分降低>90%;顯效:NIHSS評分降低46%~90%;有效:NIHSS評分降低18%~45%;無效:NIHSS評分降低<18%。總有效率=(基本痊愈例數+顯效例數+有效例數)/總例數×100%。
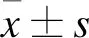
2 結果
2.1 炎癥因子 治療前,兩組血清炎癥因子水平比較差異無統計學意義(P>0.05);與治療前比較,治療3、7 d后,兩組血清IL-1β降低(P<0.05),IL-10、hs-CRP升高(P<0.05);與同時間對照組比較,治療3、7 d后試驗組血清IL-1β、hs-CRP降低明顯(P<0.05),IL-10高于對照組(P<0.05),見表1。

表1 兩組患者血清炎癥因子水平比較
2.2 氧化應激因子 治療前,兩組血清氧化應激因子水平比較差異無統計學意義(P>0.05);與治療前比較,治療3、7 d后,兩組血清SOD升高(P<0.05),MDA降低(P<0.05);與同時間對照組比較,治療3、7 d后,試驗組血清SOD升高明顯(P<0.05),MDA低于對照組(P<0.05),見表2。

表2 兩組患者血清氧化應激因子水平比較
2.3 神經功能及顱內壓 治療前,兩組NIHSS和ICP比較差異無統計學意義(P>0.05);與治療前比較,治療3、7 d后,兩組NIHSS、ICP降低,差異有統計學意義(P<0.05);與同時間對照組比較,治療3、7 d后試驗組NIHSS、ICP明顯降低,差異有統計學意義(P<0.05),見表3。

表3 兩組患者神經功能及顱內壓比較
2.4 臨床療效 試驗組總有效率高于對照組 (Z=-2.049,P=0.040),見表4。

表4 兩組患者臨床療效比較[例(%)]
3 討論
ACI是目前臨床上常見的急重危病,早期及時處理與其預后效果密切相關[9-12]。ACI治療的主要目的是使閉塞血管盡早再通,盡快恢復血供及相應的神經功能[13]。動脈溶栓作為治療ACI的主要方法之一,也是目前對于ACI最先進、最有效的治療手段。然而,越來越多的案例出現溶栓后神經功能障礙加重,這與梗死區域CIR相關。CIR是腦缺血、缺氧后恢復血流灌注,因產生過多的自由基、脂質過氧化物等,加重腦組織損害的一種現象[14],在心肌梗死、腦梗死中均較為常見。如何有效防止或減輕ACI動脈溶栓后CIR已成為神經內科醫師關注的焦點。
中醫學認為急性腦梗死與“中風”相符合,動脈血栓屬于“血瘀證”,“氣行則血行,氣滯則血瘀”,心病日久則氣虛,氣虛則血行乏力或血行乏源,血瘀、痰濁停留,脈絡阻滯,故多采用活血化瘀方藥來治療,祖國醫學對瘀血證及治法的理論和經驗由來已久[15],血府逐瘀湯是治療血瘀證的經典方劑,源于清·王清任所著《醫林改錯》,方中桃仁破血行滯,紅花活血祛瘀、止痛,為君;赤芍、川芎活血祛瘀,牛膝活血通經,祛瘀止痛,引血下行,為臣。生地、當歸養血益陰,桔梗、枳殼寬胸行氣,柴胡疏肝解郁,理氣行滯,為佐;甘草調和諸藥。現代藥理學證實,血府逐瘀湯具有改善血液流變性、微循環及血液凝固性,保護心肌細胞,增加毛細血管開放數量等藥理作用[16-18]。治療性亞低溫被認為是目前CIR唯一有效的治療手段,循證醫學表明,美國心臟病協會、歐洲復蘇協會已將亞低溫療法寫入心肺復蘇的國際指南中。在腦缺血損傷情況下,由于CIR病理生理條件存在,亞低溫的核心作用在于抑制再灌注后的血管自主調節功能障礙,即減少快速充血以及繼發的血流降低[19]。近年來,諸多研究表明,亞低溫療法對ACI及CIR的治療確切有效,并獲得廣泛的肯定[20-21]。
本研究發現,與同時間對照組比較,治療后試驗組血清IL-1β、hs-CRP較低,IL-10較高,表明血府逐瘀湯聯合亞低溫可以有效抑制炎癥因子的釋放。腦缺血再灌注時,再缺血灶局部存在大量炎癥因子,且炎癥細胞激活、浸潤及黏附分子的合成分泌呈一種相互增強相互促進的級聯反應[22],通過一定的炎癥信號通路使腦組織由缺血性損傷轉向炎癥性損傷[23]。IL-1β是一種很強的致炎因子,在腦缺血時,其能夠促進內皮細胞增殖,使得內皮細胞產生黏附分子,從而誘導白細胞受體產生,促進白細胞附壁、浸潤。此外,還能間接降低腦血流,加重梗死癥狀。hs-CRP是一種急性實相蛋白,也是一種非常重要的炎癥細胞因子,可以增強巨噬細胞的吞噬細胞,促進單核細胞表達受體以及其他功能。IL-10在腦缺血損傷過程中具有抗炎、抗自由基、抗凋亡等多重腦保護作用。在ACI后IL-10主要通過減少IFN-γ、TNF-α等炎癥因子的合成來抑制炎癥反應,從而減輕腦損傷[24]。
本研究同時發現,治療3、7 d后試驗組血清SOD較高,MDA較低,說明血府逐瘀湯聯合亞低溫能夠抑制脂質過氧化反應,從而抑制MDA產生,減輕其對腦組織的侵害。SOD是機體重要的抗氧化物質,能夠有效滅活細胞內有害的游離單線態氧、氧化自由基等,從而保護細胞和組織免受損傷[25]。MDA是機體活性氧作用脂質發生過氧化反應的氧化終產物,且大量產生會加劇細胞膜損傷,引起DNA、RNA以及蛋白質斷裂或變性,產生嚴重的細胞毒作用,引起細胞凋亡[26-27]。
綜上,本研究發現,血府逐瘀湯聯合亞低溫對急性腦梗死動脈溶栓后缺血再灌注損傷具有良好的保護作用,其作用機制可能與抑制炎癥反應、減輕氧化應激反應有關。

