人參皂苷Rb1對系統性紅斑狼瘡患者外周血T淋巴細胞體外活化的影響
楊 帆,沈俊逸,蔡 輝
0 引言
系統性紅斑狼瘡(Systemic lupus erythematosus,SLE)是一種以自身抗體病理性增多和非特異性系統器官損傷為特征的慢性免疫性疾病[1],此外,其與基因、環境、內分泌紊亂、表觀遺傳等因素也密切相關[2]。雖然病因復雜,但是眾多研究證實,免疫耐受缺失及免疫穩態失衡是SLE最重要的發病基礎,包括T細胞增殖和分化功能缺陷、病理性T細胞大量聚集、T細胞自身凋亡增加等[3],因此,深入探索SLE患者T細胞異常活化的分子免疫機制,對于臨床療效的判斷和靶向生物制劑的開發都具有重要的研究價值。中藥復方或單體成分在免疫性疾病領域的作用越來越受到醫學界的普遍關注[4]。人參皂苷因具有甾環樣結構、類糖皮質激素樣作用、免疫調節功能等,是眾多治療SLE中藥組方中的重要成分之一[5]。人參皂苷Rb1是臨床上常用的免疫佐劑[6-7],但是否能用于SLE的治療尚不明確。本研究擬通過體外實驗,探討人參皂苷Rb1對SLE患者外周血T淋巴細胞體外活化、增殖、凋亡的影響。
1 材料與方法
1.1 對象選擇 選擇2019年1-12月在東部戰區總醫院首次確診的SLE門診或住院患者30例,所有患者均為女性,年齡27~65歲,平均年齡(48.10±10.90)歲;病程3~53個月,中位病程21.0個月。本研究血液標本的采集符合倫理學要求,并獲得受試者的知情同意。納入標準:符合美國風濕病協會1997年推薦的SLE診斷標準[8];SLE疾病活動指數(Systemic lupus erythematosus disease activity index,SLEDAI)<10分者[9]。排除標準:合并其他自身免疫系統疾病、結締組織疾病或嚴重感染性疾病者。另外,收集同時期30例健康女性志愿者捐獻的外周血樣本,年齡25~60歲,平均年齡(45.63±12.12)歲。SLE患者和健康志愿者年齡比較,差異無統計學意義(P>0.05)。
1.2 主要試劑和儀器 人參皂苷Rb1(純度>98% HPLC,規格:20 mg,天津馬克生物有限公司),用DMSO制備成1 mg/ml儲備液,分裝凍存于-20 ℃,用前6 h稀釋至所需濃度(DMSP最終濃度<1%)。人外周血淋巴細胞分離液(Ficoll-Hypaque Solution),美國Sigma-Aldrich公司;RPMI1640培養基和胎牛血清,美國Hyclone公司。刀豆球蛋白A(ConcanavalinA,ConA),美國Sigma公司;3H標記胸腺嘧啶核苷(3H-TdR,比活性:2~10 mCi/mg,美國Molecular Probes公司),將1 mCi/ml溶液以生理鹽水稀釋成100 μCi/ml,于4 ℃保存備用。臨用前用培養液稀釋至所需濃度。鼠抗人CD3-FITC、鼠抗人CD4-PerCP-Cyanine5.5、鼠抗人CD8-PE、鼠抗人FITC-CD69、鼠抗人CD25-FITC、鼠抗人PE-Foxp3,美國BD公司;白細胞介素4(Interleukin4,IL-4)ELISA試劑盒和干擾素-γ(Interferon-γ,IFN-γ)ELISA試劑盒,武漢艾美捷科技有限公司。DPM-7001型液體閃爍計數器,法國SDEC公司;流式細胞儀(FACS Calibur),美國Becton-Dickinson公司。
1.3 實驗方法
1.3.1 外周血T淋巴細胞的分離 采集入組受試者外周靜脈血15 ml,置于肝素抗凝管中,加入等體積PBS稀釋,采用FICOLL密度梯度離心法分離人外周血單個核細胞(Peripheral blood mononuclear cells,PBMCs)。2 000 r/min離心30 min,用毛細血管輕輕吸取中間層白色絮狀物(PBMCs比重約為1.075~1.090),置于另一離心管中,用PBS洗滌2次,磁珠分選緩沖液重懸,得到PBMCs(>95%)。
1.3.2 CD3+T淋巴細胞的分選 取上述PBMCs懸液,采用免疫磁珠法分選CD3+T淋巴細胞。用含有10%胎牛血清的RPMI1640完全培養液(2 mmol/L谷氨酰胺+10 mg/L非必需氨基酸+1 mmol/L丙酮酸鹽+100 U/ml青霉素和100 μg/ml鏈霉素+5 μg/ml植物血凝素)重懸,得到CD3+T淋巴細胞懸液(>95%)。
1.3.3 實驗分組 根據體細胞來源分為2組:健康對照(control)組和SLE組,每組進一步分為空白組、ConA組,ConA+Rb1組。空白組:將T淋巴細胞按1×105/孔接種至96孔板中后,未經任何藥物處理;ConA組:將T淋巴細胞按1×105/孔接種至96孔板中后,加入10 μg/ml ConA刺激72 h;ConA+Rb1組:將T淋巴細胞按1×105/孔接種至96孔板中后,加入10 μg/ml ConA刺激72 h,同時加入Rb1干預。
1.3.43H-TdR滲入法檢測T淋巴細胞增殖活性 取上述純化的T淋巴細胞,設為空白組、ConA組,ConA+各濃度人參皂苷Rb1(2.5、5、10、20 μmol/L)組。加入不同藥物干預72 h后,每孔加入0.5 μCi3H-TdR,繼續培養12 h。收集細胞至玻璃纖維濾紙上,烘干后用液體閃爍計數器進行檢測。細胞增殖率(%)=(ConA組-空白組)/空白組×100%;細胞增殖抑制率(%)=(ConA組-ConA+Rb1組)/ConA組×100%。
1.3.5 流式細胞術檢測T淋巴細胞早期活化抗原CD69表達水平 T淋巴細胞分組和處理方式同“1.3.3”,人參皂苷Rb1作用濃度為10 μmol/L,收集細胞約1×107個。PBS離心(1 000 r/min,4 ℃,5 min)洗滌,加入CD4-PerCP-Cyanine5.5、CD8-PE、FITC-CD69,混勻后室溫避光染色30 min,上機檢測。
1.3.6 流式細胞術檢測T淋巴細胞分化水平 T淋巴細胞分組和處理方式同“1.3.3”,人參皂苷Rb1作用濃度為10 μmol/L,收集細胞約1×107個,處理方式同“1.3.5”。加入CD4-PerCP-Cyanine 5.5、CD25-FITC,4 ℃孵育30 min,4%甲醛固定20 min,破膜處理,加入PE-Foxp3,混勻后室溫避光染色30 min,上機檢測。
1.3.7 ELISA法檢測細胞培養上清中IL-4和IFN-γ水平 取上述純化的T淋巴細胞,設為空白對照組(未加藥物處理)、各濃度人參皂苷Rb1(2.5、5、10、20 μmol/L)組,培養48 h。采用ELISA法檢測細胞培養上清中IL-4和IFN-γ水平。
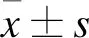
2 結果
2.1 人外周血CD3+T淋巴細胞分選鑒定 經流式細胞術檢測,磁珠分選得到的CD3+T淋巴細胞懸液中CD3+T淋巴細胞比例為98.95%,細胞形態均一,經臺盼藍染色,活細胞>95%。見圖1。

圖1 經免疫磁珠分選后,CD3+T淋巴細胞含量
2.23H-TdR滲入法檢測人參皂苷Rb1對人外周血T淋巴細胞增殖活性的影響 SLE人群空白組外周血T淋巴細胞增殖活性明顯高于健康對照人群,差異有統計學意義(P<0.05);ConA可明顯刺激SLE人群和健康對照人群外周血T淋巴細胞的增殖活性(增殖率:410.71%±128.59%vs.321.30%±96.54%),差異無統計學意義(P>0.05)。另外,加入Rb1后,對ConA誘導的T淋巴細胞增殖有顯著的抑制作用,而且當Rb1濃度為10 μmol/L和20 μmol/L時,抑制作用最為明顯,當Rb1濃度為10 μmol/L時,抑制率分別為40.87%±9.82%和53.94%±9.12%,Rb1對SLE人群外周血T淋巴細胞增殖的抑制作用高于健康對照人群,差異有統計學意義(P<0.05)。見圖2。

圖2 人參皂苷Rb1對人外周血T淋巴細胞增殖活性的影響
2.3 流式細胞術檢測人參皂苷Rb1對人外周血T淋巴細胞CD69+表達的影響 采用雙抗體染色法,ConA可明顯刺激SLE人群和健康對照人群外周血T淋巴細胞早期活化(CD3+CD69+T/CD3+T細胞比例:48.53%±7.26%vs.53.73%±8.45%),差異無統計學意義(P>0.05)。另外,加入10 μmol/L Rb1對ConA誘導的T淋巴細胞早期活化有顯著的抑制作用,CD3+CD69+T/CD3+T細胞比例分別為31.28%±5.32%vs.33.64%±5.79%,Rb1對SLE人群和健康對照人群外周血T淋巴細胞早期活化的抑制比較,差異無統計學意義(P>0.05)。見圖3。

圖3 人參皂苷Rb1對人外周血T淋巴細胞早期活化標志物CD69+表達的影響
2.4 流式細胞術檢測人參皂苷Rb1對人外周血T淋巴細胞分化的影響 經10 μmol/L Rb1后,健康對照組和SLE組外周血T淋巴細胞CD4+CD25+T細胞百分比(24.38%±5.45%、16.29%±3.18%)和CD4+CD25+FoxP3+T細胞百分比(32.76%±7.43%、26.35%±5.14%)顯著增加,與ConA組比較,差異有統計學意義(P<0.05)。見圖4。

圖4 人參皂苷Rb1對人外周血T淋巴細胞分化的影響
2.5 人參皂苷Rb1對人外周血T淋巴細胞分泌細胞因子的影響 經10 μmol/L Rb1后,健康對照組和SLE組外周血T淋巴細胞培養上清中IFN-γ水平顯著增加,而IL-4水平顯著降低,與ConA組比較,差異有統計學意義(P<0.05)。見圖5。

圖5 人參皂苷Rb1對人外周血T淋巴細胞分泌細胞因子的影響
3 討論
SLE目前臨床治療以糖皮質激素、免疫抑制劑等作為一線基礎用藥,常用的免疫抑制劑包括糖皮質激素、環磷酰胺、甲氨蝶呤等傳統免疫抑制劑或單克隆抗體、環孢素A、他克莫司等新型免疫抑制劑以抑制T細胞增殖和抗體生成,但是均存在選擇性差、毒副作用嚴重等不足[10],而且單一靶點的治療藥物難以取得全面持久的作用效果。而中醫在SLE治療中具有一定的特色和優勢,大大改善了眾多SLE患者預后。
2013年,趙偉剛等[11]研究表明,人參皂苷膠囊聯合潑尼松治療SLE療效顯著,SLE疾病活動指數降低值優于單獨使用潑尼松組。人參是我國傳統的扶正固本、益氣生津的名貴中藥材,現代藥理學機制分析,其皂苷類活性成分具有重要的免疫調節作用。呂夢婕等[12]發現,人參皂苷Rb1可抑制小鼠T淋巴細胞的體外活化及增殖活性,是一種潛在的免疫抑制劑,其作用機制可能與降低細胞內Ca2+水平有關。T淋巴細胞既是體液免疫的核心分子,又是機體自身免疫的上游靶點,其活化-凋亡失衡是介導SLE發病機制的關鍵環節[13]。因此,針對T淋巴細胞異常研發相關的藥物,有望為SLE患者帶來治愈希望。
在本研究中,雖然納入的SLE人群均處于疾病非活動期,并服用不同劑量免疫抑制劑或糖皮質激素治療,T淋巴細胞的活性受到了一定程度的抑制,但是其外周血T淋巴細胞增殖活性仍然高于健康對照人群。ConA是基礎研究中最常使用的一類植物凝集素,通過作用于T淋巴細胞表面TCR/CD3復合體進而刺激T淋巴細胞增殖,而人參皂苷Rb1不僅可抑制ConA刺激的健康對照人群外周血T淋巴細胞增殖活性,同樣也可抑制SLE人群外周血T淋巴細胞的增殖活性,而且當Rb1濃度為10 μmol/L時,抑制作用已經十分明顯。CD69是T淋巴細胞早期活化標志物,人參皂苷Rb1可抑制健康對照人群和SLE人群CD69表達,說明其可以抑制T淋巴細胞體外活化,干擾T淋巴細胞由靜息期向淋巴母細胞的轉化,從而抑制其增殖作用以及相關免疫功能。此外,人參皂苷Rb1對SLE人群外周血T淋巴細胞增殖活性的抑制作用略高于健康對照人群,推測可能的原因與SLE患者外周血T淋巴細胞過度活化,包括T細胞膜信號中的免疫突觸異常、細胞內鈣能增強等因素有關。
此外,調節性T細胞在SLE發病過程中也發揮著重要作用。臨床研究證實,SLE患者普遍存在CD4+CD25+T細胞數量減少及功能下降[14-15]。CD4+CD25+T細胞缺失易導致T細胞對自身抗原過度免疫應答,進而對自身組織造成損傷;此外,還可以促進細胞炎癥因子INF-γ、TNF-α等大量分泌,進一步加重機體組織損傷。而FoxP3是CD4+CD25+T細胞活化的重要標志分子之一。在本研究中,人參皂苷Rb1可顯著促進外周血T淋巴細胞中CD4+CD25+T細胞數量和CD4+CD25+FoxP3+T細胞數量,這可能也是人參皂苷Rb1發揮免疫調節作用,治療SLE的重要機制之一。由于SLE屬于異質性疾病,不同患者存在不同的免疫狀態,Talaat等[16]認為,SLE病情活動初期多呈現Th1型活化優勢,INF-γ等細胞因子水平顯著增加,從而增加自身抗原遞呈;但隨著疾病進展,SLE患者逐漸偏向Th2型優勢,IL-4等細胞因子分泌量逐漸增加。而Dolff等[17]發現,在SLE患者體內,細胞因子的平衡偏向Th1型,尤其在Ⅳ型狼瘡腎炎患者中呈現明顯Th1優勢。Th1/Th2免疫失衡是導致SLE發生、進展的關鍵機制。在本研究中,納入的SLE患者已出現典型的臨床癥狀,因此,以Th2型優勢為主,但是仍表現為Th1/Th2失衡。本研究結果發現,人參皂苷Rb1可促進INF-γ產生,抑制IL-4的分泌,故而調節Th1/Th2平衡可能也是人參皂苷Rb1發揮免疫調節功能的重要作用機制之一。
綜上所述,本研究首次證實了人參皂苷Rb1可抑制ConA刺激的SLE患者外周血T淋巴細胞增殖活性,同時增加CD4+CD25+T細胞比例,維持Th1/Th2免疫平衡,為其用于自身免疫性疾病的治療提供了有利的實驗證據支持。

