缺氧應激下血管內皮細胞調控小膠質細胞表型及其機制
吳衛江,陸華,徐杰,朱愛華,房文峰,馬思原,陳東棟,惠國楨
在氧化應激條件下血-腦屏障(blood-brain barrier,BBB)的結構和功能將遭到破壞。有研究顯示血-腦屏障的開放過程是雙時相的,即在首次開放后存在數小時乃至數天的間隔期后出現第二次開放;其機制不明[1]。在血-腦屏障這一血管神經單元中,唯一具有免疫及吞噬活性的是小膠質細胞(microglia,MI),推測其在開放初期將呈現抗炎修復表型,扮演清道夫的角色,阻滯了微血管內膜損傷后的炎性因子分泌。以往的研究證明,MI有著多種活化類型,而且相互之間可以通過信號分子的傳遞進行切換[2]。在缺氧應激條件下,MI主要呈現M1樣(促炎型),其產生的氧自由基、氧化亞簇以及金屬蛋白酶等加重血-腦屏障的損害[3-4]。然而MI的活性將通過其表面表達的一些負性分子接受神經元、內皮細胞等的調控;其中比較經典的信號分子是CD200及其受體CD200R,在血-腦屏障遭到破壞的同時,活化后的內皮細胞有可能啟動負反饋機制,通過自身表達CD200,結合趨化因子的釋放來調控MI活性和遷移,使其向M2樣(抗炎型)表型轉換[5]。文獻報道在腦組織損傷模型中損傷部位的MI為M1樣和M2樣表型的混合,其中M2樣表型的反應是短暫的,具有抑制免疫炎癥反應和促進組織修復的作用[6];部分M2樣細胞表現出吞噬活性,同時表達吞噬細胞標志物MFG-E8蛋白,不表達炎性因子[7]。隨著時間延長,M2表型向M1樣表型轉變,M1樣表型起主導作用[6]。
本研究使用鼠小膠質細胞系(BV2)和鼠血管瘤內皮細胞(EOMA)細胞株進行體外實驗,將缺氧培養內皮細胞同MI共育,觀察后者CD200R、趨化因子受體CX3CR1、吞噬標記MFG-E8的表達,檢測其趨化及吞噬活性;有可能模擬血-腦屏障遭受破壞的前提下,作為免疫監控細胞的MI短時間內聚集缺氧活化后的內皮細胞周圍,發揮吞噬及抑炎功能,起到修復和防護血-腦屏障的作用,從而部分解釋血-腦屏障受損后出現的雙時相現象。現報告如下。
1 材料與方法
1.1 材料 實驗細胞與試劑:EOMA(美國ATCC,CRL-2586);BV2(美國ATCC,HTX1876);鼠炎性因子ELISA試劑盒(美國Abbkine,KET7005);鼠CD200R單抗試劑盒(美國eBioscience,85-14-9201-80);全蛋白定量試劑盒(美國R&D,PCDH1 IL-2R);鼠CX3CR1ELISA試劑盒(美國R&D,WTA3603);鼠CX3CL1抗體試劑盒(美國R&D,EY-(K)-1079);鼠MFG-E8 IgG單抗(美國Santa Cruz,sc-271574);鼠β-actin單抗(美國Sigma,AB1001);Oregon Green的熒光微球(美國GIBCO,17154-10)。
實驗儀器:Series Ⅱ 3110 CO2培養箱 (Thermo,美國 );HX-80 三氣細胞培養箱(上海海向儀器設備廠,中國);Transwell細胞培養小室(Corning Costar,美國);流式細胞儀(BD LSRFortessa,美國);倒置相差顯微鏡(Olympus BX53,日本);生物熒光顯微鏡(Olympus BX2,日本);ibidiCO2孵育系統(ibidi,德國);7500RT-PCR 儀 (賽默飛,中國 );DK-8AXX 電熱恒溫水槽 (上海一恒科技,中國 )。
1.2 方法
1.2.1 內皮細胞缺氧損傷模型建立及表型鑒定 取體外培養至三代的EOMA培養板放入三氣培養箱(1% O2,5% CO2,94% N2,37 ℃)中培養,對照組細胞置于正常培養箱(5% CO2,95%空氣,37 ℃)中培養。6 h后分別移出各自的培養箱,觀察兩組細胞的形態變化,測定細胞存活率;用ELISA法檢測各組細胞的CD62E、CD200表達水平,同時取各自細胞上清液檢測炎性因子白介素1β(interleukin-1β,IL-1β)、白介素6(interleukin-6,IL-6)、腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)水平,檢測方法按試劑盒說明進行操作,每組實驗重復3次。
1.2.2 細胞分組及實驗過程 (1)BV2以普通培養基孵育的對照組;(2)正常EOMA培養上清孵育組;(3)缺氧EOMA培養上清孵育組;(4)與正常EOMA細胞共育組;(5)與缺氧EOMA共育組。以培養板和8 μm孔徑的transwell構建細胞的共育體系,下層培養BV2細胞,上層接種EOMA細胞。共育結束后移走transwell小室,對孔板培養皿中的BV2細胞進行檢測。分組實驗過程:將三氣培養箱中培養6 h后的EOMA細胞移出后置入正常培養箱中繼續培養6 h,正常培養的EOMA細胞則孵育12 h,作為分組實驗的時間點。分別收集細胞及上清液,將正常或缺氧組上清與新鮮培養液按1∶3的比例來培養BV2細胞;將每孔收集的正常或是缺氧EOMA細胞分成3等份分別與BV2細胞共育。24 h后觀察各組細胞形態,進行MTT細胞存活率測定,繼而應用ELISA法檢測各組細胞CD200R、CX3CR1的表達水平。同時采用免疫印跡法測定各組細胞的MFG-E8蛋白表達水平。用流式細胞術(flow cytometry,FCM)測定各組細胞吞噬活性。每樣檢測均重復3次。
1.2.3 CD200R表達檢測 采用免疫熒光法。各組細胞培養24 h后,重復3孔,每組至少重復3次,共育組移去transwell小室,去上清,漂洗后固定,加CD200R一抗4 ℃孵育過夜,熒光二抗處理后緩沖液再次漂洗,顯微鏡下觀察。
1.2.4 CX3CR1表達檢測 采用ELISA法。上述5組細胞培養24 h后去上清,漂洗后加入細胞裂解液,勻漿器勻漿,離心后取上清。依照全蛋白定量試劑盒操作說明配置蛋白標準液,繪制蛋白定量標準曲線。取5組待測樣品適量,加入考馬斯亮藍G250染液后混勻,測定595 nm處的OD值,然后在標準曲線上求總蛋白濃度。按鼠CX3CR1-ELISA試劑盒操作步驟,檢測待測蛋白樣品,結合總蛋白濃度,計算5組樣本的CX3CR1含量。
1.2.5 MI趨化實驗 應用有自動拍照對焦功能的相差顯微鏡,配備鏡載加熱孵育系統(37 ℃,5% CO2),應用ibidi 細胞趨化載玻片進行實驗。將體外培養第三代的BV2細胞調節濃度為1.0×106/mL,將細胞接種在中間通道,載玻片放入培養箱中30~35 min,細胞貼壁后分別在兩邊儲液池中加入60 μL普通培養基作為對照組;第2組在一邊加入60 μL正常EOMA培養上清,同樣數量的普通培養基加入另一邊儲液池;第3組兩邊分別加入60 μL缺氧EOMA培養上清和普通培養基;第4組在第3組加入缺氧EOMA培養上清的池內追加CX3CL1抗體,將通道加液孔塞緊后可以進行圖像采集,將載玻片置入鏡載加熱孵育系統中,調整好采集位點,進行18 h的觀測,每20 min采集一張圖片。應用ImageJ軟件中Manual Tracking功能進行圖像數據處理,得到細胞軌跡的坐標表格數據。
1.2.6 MFG-E8蛋白表達水平檢測 用Western Blot法提取各組細胞總蛋白。配制分離膠進行SDS-PAGE凝膠電泳,分離蛋白區帶電泳轉移到NC膜上,封閉液處理后將膜置于含MFG-E8 IgG(1∶250)單抗、β-actin單抗(1∶2 000)的胎牛血清封閉液中,孵育過夜,洗膜。再將NC膜置于HRP標記二抗中孵育,洗膜后將ECL化學發光試劑A液和B液等體積混合,NC膜正面朝上,顯色液覆蓋結合二抗的NC膜,室溫孵育后用化學發光儀檢測條帶的灰度值,計算目的蛋白與β-actin的灰度值比值,用ImageJ軟件中的Gel分析工具對各組蛋白進行定量測定比對。
1.2.7 MI吞噬功能檢測 各組細胞培養24 h后去上清,洗滌后加入新鮮DMEM培養基,同時在相應的板孔中按一定的比例(細胞∶微球=1∶50~100)加入直徑為0.2 μm的摻有Oregon Green的熒光微球,吞噬30 min后進行FCM檢測和分析(FL1通道)。
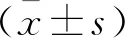
2 結 果
2.1 缺氧組與正常組細胞表面標記物及炎性因子表達水平比較 與正常組相比,缺氧組細胞的CD62E、CD200及IL-1β、TNF-α、IL-6表達水平均顯著升高,差異有統計學意義(均P<0.05)。見表1、2。

表1 缺氧組與正常組細胞CD62E、CD200的表達水平比較

表2 缺氧組與正常組細胞IL-1β、TNF-α、IL-6的表達水平比較
2.2 各組細胞的成活率比較 MTT法檢測結果顯示,正常EOMA培養上清孵育組及缺氧EOMA培養上清孵育組細胞的OD值(細胞存活率)均比對照組顯著降低(均P<0.05);正常EOMA細胞共育組及缺氧EOMA細胞共育組的OD值稍升高,差異無統計學意義(P>0.05)。
2.3 各組細胞CD200R免疫熒光染色結果 普通倒置顯微鏡下顯示,A、D、E組細胞均符合靜息狀態下MI形態特征;B、C組細胞多呈現不規則形態,突起變短或消失,細胞分布明顯較其他3組稀疏,細胞間彼此不連接;熒光染色后細胞均呈CD200R陽性(圖1)。

A、D、E:細胞均為長梭形; B、C:細胞呈不規則形態,突起變短或消失,分布稀疏;5組細胞均為CD200R陽性(×200,圖中標尺為100 μm)
2.4 各組細胞CX3CR1蛋白表達水平比較 缺氧內皮細胞培養上清孵育組及共育組細胞的CX3CR1蛋白表達水平明顯高于對照組,同時共育組的表達水平又高于孵育組,差異均有統計學意義(均P<0.01)。正常內皮細胞上清孵育組及共育組與對照組細胞的CX3CR1蛋白表達水平的差異均無統計學意義(均P>0.05)(圖2)。
2.5 MI趨化實驗結果 正常對照組細胞運動呈現出無序性,正常內皮細胞培養上清并沒表現出對MI的趨向性,而缺氧內皮細胞培養上清則表現出了明顯的趨化特征,當在缺氧內皮細胞培養上清中加入趨化因子抗體后則中和了這種趨向特征,細胞運動恢復了無序狀態(圖3)。
2.6 各組細胞MFG-E8蛋白表達水平比較 兩組共育組細胞的MFG-E8蛋白表達水平提高,特別是缺氧共育組表達量最高,與對照組相比差異均有統計學意義(均P<0.05)。正常上清孵育組與對照組相比,差異無統計學意義(P>0.05);而缺氧上清孵育組的表達水平最低,與對照組相比差異有統計學意義(P<0.05)(圖4、5)。

與A、B、D組相比*P<0.01;與C組相比#P<0.01

缺氧后的內皮細胞培養上清里含有趨化因子,對MI產生了趨化特性,這種趨向性能夠被趨化因子CX3CL1抗體所拮抗;正常內皮細胞及對照組細胞培養上清內均不存在特定的趨化因子,細胞運動呈現無序狀態

圖4 各組細胞MFG-E8蛋白免疫印跡檢測結果

圖5 各組細胞的MFG-E8蛋白表達水平
2.7 各組細胞吞噬功能比較 正常對照組MI在吞噬活性上表現出異質性,僅有部分細胞表現為低度的吞噬功能;在用正常內皮細胞培養上清時MI活性開始提高,但主要表現為低吞噬活性,與對照組相比差異有統計學意義(P<0.05);而在同正常內皮細胞共育后這種特性并沒有發生明顯改變(P>0.05)。缺氧內皮細胞上清孵育組的MI吞噬活性明顯下降(P<0.05);而缺氧內皮細胞共育組的MI吞噬活性明顯升高(P<0.01)(圖6、7)。
3 討 論
在腦組織缺氧應激條件下微血管內皮細胞是首先感受并活化的細胞,其活化后會表達并釋放多種炎性介質,加劇血-腦屏障的開放[8];緊接著作為CNS免疫監控細胞的MI在缺氧和各種炎性刺激因子作用下迅速被激活,并在整個神經炎性損傷過程中起著至關重要的作用。受周圍微環境的調控其作用存在明顯兩面性的特征,既有吞噬和抗炎活性,也可炎性活化產生大量炎癥和趨化因子,進一步加劇血-腦屏障的損傷形成惡性循環。活化后的內皮細胞在表達一系列炎性表型的同時,也會表達一些負反饋的免疫抑制信號來“關閉”和控制自身及鄰近免疫細胞的炎性通路;如CD200的表達能有效地抑制活化內皮細胞的NF-kB通路,同時與MI的CD200R通過細胞間的直接接觸從而控制后者的過度炎性活化[9]。這樣的免疫調控機制在血-腦屏障開放后抑制了內皮細胞和MI的炎性因子分泌,從而維持CNS環境相對穩定,避免了炎癥反應及損傷的擴大化。

A組:大部分MI無吞噬活性,部分為低吞噬活性,只有極少數為高吞噬活性; B組:吞噬活性的總比及高吞噬活性占比均有上升; C組:表現吞噬活性的比例明顯減少; D組:吞噬活性的總比及各構成比與對照組無明顯差異; E組:吞噬活性明顯升高,并且多為高吞噬活性。注:M0為非吞噬活性的MI百分比,M1區域為低吞噬活性MI百分比,M2為高吞噬活性MI百分比

圖7 各組細胞MI吞噬火星FCM結果比較
本實驗結果發現,以缺氧EOMA培養上清孵育的BV2細胞形態上表現為胞體變大、突起回縮、呈阿米巴樣,并且CD200R表達減少,提示處于炎性激活狀態;結合缺氧EOMA培養液的活化檢測結果表明,缺氧EOMA表達的一系列炎癥因子及趨化因子、粘附分子等導致了BV2細胞向M1型活化,作為炎性毒性表型表達更多炎性介質并同活化EOMA表達的炎性因子產生疊加效應。
BV2與缺氧EOMA共育組則產生了絕然不同的效果,BV2細胞形態上仍然保持靜息狀態下的梭型外觀,胞體較大、突起細長、相互交織成網、CD200R染色呈強陽性,結合缺氧應激下的EOMA細胞CD200表達水平的增加,該共育組很可能為活化后的EOMA通過CD200-CD200R信號通路抑制了MI的炎性激活,使其由促炎型M1型向抗炎型M2型轉化。
但是正常EOMA培養上清孵育組MI不僅出現了炎性活化表現,同時細胞存活率也出現了下降;推測正常培養狀態下的內皮細胞仍會不間斷產生抑制MI增殖同時促進細胞活化的因子,而在生理狀態下由于基底膜的阻隔這些由內皮細胞產生的因子并沒有對MI產生影響;其機制有待進一步深入研究。
實驗結果同樣可推斷受缺氧EOMA表達的趨化因子影響,其培養液孵育的MI高表達趨化因子受體,而BV2與缺氧EOMA共育組該受體的表達量升高更為明顯,提示內皮細胞損傷后即刻動員MI向血-腦屏障破壞區聚集,趨化實驗也證實了這一點。短時間大量的MI堆積將構建一道血-腦屏障外圍新的屏障,使血-腦屏障暫時得到了修復。
兩組共育組特別是BV2與缺氧EOMA共育組細胞的MFG-E8蛋白表達水平明顯提高,表明MI吞噬活力增強。有研究報道MI在一些具有趨化因子作用的分子誘導下能向損傷位置遷移,而MI聚集到神經損傷位置后,將發揮其吞噬功能[10-11]。根據本研究的結果推測,活化的MI突破損傷的血-腦屏障基底膜后有可能與受損的血管內皮細胞直接接觸,受活化內皮細胞的分子調控,由M1型細胞向M2型細胞轉化,并發揮其吞噬活性,同時減少炎性因子的分泌,客觀上起到了修復血-腦屏障的作用。而MI在缺氧EOMA培養上清孵育組的MFG-E8蛋白表達水平則明顯下調,表明炎性毒性表型下的MI吞噬活性下降(MI吞噬活性實驗也證實);各組細胞熒光微球吞噬實驗顯示,MI同缺氧內皮細胞共育后,前者表現出高度的吞噬活力。
既往的研究已經證明了MI的活性受神經元調控。本研究結果證實其與缺氧內皮細胞間同樣通過直接接觸和分子傳遞,在自身存活、活化等一系列生物學功能中發揮重要的作用。缺氧內皮細胞上清中包含炎性因子可能通過Toll樣受體促使MI向炎性毒性表型轉化[12-13];而其自身由于早期高表達負性調控分子CD200,并在趨化因子作用下同MI直接接觸,通過上調后者表面的CD200R使之形成M2a樣狀態;該極化狀態將激活其清道夫受體并增強吞噬活性,表現為血-腦屏障功能的短暫修復,炎性因子分泌減少。然而,無論缺氧內皮細胞抑或神經元,隨著缺氧時間的延長,最終CD200表達水平會迅速下降[13],導致無法控制MI炎性毒性的活化,進一步加劇血-腦屏障的破壞;或許這能部分解釋在腦損傷動物模型上觀察到的血-腦屏障開放雙時相現象。

