帕金森病丘腦底核腦深部電刺激術后的長期隨訪研究
郭松,任志偉,胡永生,張宇清,莊平,李建宇
腦深部電刺激(deep brain stimulation,DBS)術是治療中晚期帕金森病(Parkinson’s disease,PD)的有效方法。DBS術療效的短期和中期隨訪研究證實[1-3],術后患者的運動癥狀和生活質量可以得到明顯改善,多巴胺能藥物的使用劑量較術前減少。DBS術治療PD的長期療效如何,是否如同藥物治療一樣存在“蜜月期”,隨著病程的進展“開,關”現象和“異動”現象是否會出現,以及手術的安全性,是否有長期的不良反應;這些問題一直被業界所關注。首都醫科大學宣武醫院功能神經外科自1998年在國內率先開展DBS術治療PD,積累了大量PD患者DBS治療的經驗。本研究對2009年1月—12月進行STN-DBS術治療的PD患者進行了長期(10年)的隨訪觀察,以探討STN-DBS術治療PD的長期效果及安全性。現報告如下。
1 資料與方法
1.1 一般資料 共納入75例患者。納入標準:(1)臨床確診為PD;(2)病程5年以上;(3)年齡70歲以下;(4)術后DBS單極刺激;(5)保持12個月以上的穩定療效[4]。排除標準:(1)患有認知功能障礙和/或精神疾病;(2)通過實驗室或MRI檢查確診為其他神經系統疾病;(3)有手術禁忌證的患者[4]。所有患者的手術靶點均為丘腦底核,經影像學技術確認和微電極(alpha omega engineering,Nazareth,Israel)電生理信號確認手術靶點后,植入4個刺激觸點電極(Model 3389;Medtronic,Inc.,Minneapolis,MN USA)。本研究經過首都醫科大學宣武醫院倫理委員會批準,所有患者均簽署知情同意書。
1.2 方法 采用統一帕金森病評定量表(Unified Parkinson Disease Rating Scale,UPDRS)對患者進行綜合評估。包括:術前的“關”和“開”狀態;術后DBS開啟時的“關”和“開”狀態。術前“關”狀態為停用多巴胺藥物12 h以上,受體激動劑72 h以上;術前“開”狀態為每天早上第1次服用的抗PD藥物是換算的左旋多巴等效劑量(Levodopa equivalent dose,LED)的1.5倍[5]。術后評估使用相同左旋多巴等效劑量。分別在術后1年、3年、5年和10年對患者進行再次評估。患者的運動功能用UPDRS量表第3部分進行評估,日常生活活動能力(activities of daily living,ADL)和運動并發癥分別用UPDRS量表第2部分和第4部分進行評估。本研究為非盲臨床試驗,所有關于患者的術前、術后UPDRS量表評估均由同一臨床醫生完成。
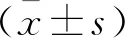
2 結 果
2.1 術后隨訪完成結果 本組75例PD患者中,最終有41例患者完成了術后10年的隨訪,34例患者沒有完成術后10年的隨訪。
2.1.1 完成隨訪患者的資料 完成隨訪的41例患者中男性27例,女性14例;起病時的平均年齡為(49.7±4.8)歲,手術時的平均年齡為(56.1±5.3)歲;至手術時平均病程為(6.7±2.1)年;手術前服用抗PD藥物劑量為LED(912±195)mg/d。
2.1.2 沒有完成隨訪患者的原因 沒有完成術后10年隨訪的34例患者中,有7例患者術后通過DBS雙極刺激才能有效緩解運動癥狀,為了保證隨訪數據的穩定準確,這7例患者在1年后被排除隨訪;2例患者因術后脈沖刺激發生器(implantable pulse generators,IPG)囊袋皮膚破潰,被排除隨訪(其中1例患者在術后6年、1例患者在術后7年原IPG電量耗竭,更換IPG后1~2年出現皮膚破潰,給患者行皮膚清創修補手術)。在10年隨訪期間,有4例患者死亡(其中1例患者死于心肌梗死,1例患者死于肺炎,1例患者死于感染引起的全身炎癥反應綜合征,1例患者死因不明,其在家中去世后未做尸檢);18例患者失訪,主要原因為居住地距離醫院過遠,患者病情穩定后拒絕按期回醫院進行評估檢查。3例患者因聯系方式改變,無法聯系造成失訪。
2.2 術后不同狀態的UPDRS評分與術前比較
2.2.1 術后藥物“關”及DBS“開”狀態的評分與術前比較 患者術后UPDRS-Ⅲ評分與術前比較顯示,與術前藥物“關”狀態基線數據相比,術后第1年藥物“關”狀態DBS開啟時神經調控狀態下,運動功能評分改善55%;術后第3年、第5年、第10年分別改善了52%、47%和36%。除了語言這一子項,其他UPDRS-Ⅲ子項評分在術后10年均較術前基線得到明顯改善。術后第1年語言子項評分與術前的差異無統計學意義(P=0.261);術后第10年語言子項評分較術前明顯惡化,差異有統計學意義(P=0.027)。對UPDRS-Ⅲ各子項評分分析顯示,DBS對震顫癥狀改善最顯著,術后第1年、3年、5年、10年的震顫改善率分別為75%、76%、79%、81%;僵直子項評分術后第1~10年的改善率分別為58%、56%、54%和48%;運動遲緩評分的改善有統計學意義,但不如震顫和僵直癥狀改善明顯,術后第1年、3年、5年、10年的改善率分別為47%、41%、36%和24%;軸線癥狀評分改善率分別為44%、39%、28%和0%,軸線癥狀和遲緩癥狀術后改善趨勢相似。
同樣與術前“關”狀態基線數據相比,UPDRS-Ⅱ評分在術后第1年改善了56%,第2年改善41%,第3年改善36%,第10年改善27%。見表1。
2.2.2 術后藥物及DBS“開”狀態的評分與術前比較 與術前藥物“開”狀態基線評分相比,術后藥物“開”狀態同時DBS刺激狀態下患者UPDRS-Ⅲ評分在術后第1年有明顯改善;術后第3年評分與基線的差異無統計學意義;術后第5年和第10年評分較術前明顯變差(均P<0.01)。震顫和僵直子項評分在術后第1、3和5年得到改善,在術后10年與術前的差異無統計學意義。遲緩癥狀子項評分術后第1至10年與術前相比,差異均無統計學意義;而語言、步態及姿勢穩定性的評分均比術前逐步變差(均P<0.01)。
UPDRS-Ⅱ評分與術前相比均沒有明顯改善。UPDRS-Ⅳ評分可見術后運動并發癥得到明顯改善。與術前評分相比,運動癥狀波動現象得到明顯改善,術后第1~10年的改善率分別為52%、49%、48%和48%。同樣,異動癥也得到了明顯改善,術后第1~10年的改善率分別為49%、54%、52%和65%。見表2。

表1 術后藥物“關”及DBS“開”狀態UPDRS評分與術前比較

表2 術后藥物及DBS“開”狀態UPDRS評分與術前比較
2.3 術后抗PD藥物用量變化及DBS調整 術后患者抗PD藥物的服用劑量整體減少,術后第10年換算后的LED較術前下降了24%。雖然抗PD藥物服用劑量減少,但沒有1例患者能夠完全停藥,術后仍需藥物與DBS聯合應用改善癥狀。DBS術后10年內,為了保證逐漸惡化的臨床癥狀得到改善,患者平均接受(5.3±1.4)次刺激參數的調整。主要調整的參數為刺激電壓,刺激的脈寬和頻率無明顯改變。平均(5.7±0.9)年更換脈沖刺激發生器,更換型號為Medtronic Activa PC,37601(非充電電池)或Activa RC,型號37612(可充電電池)。
2.4 術后并發癥 本組75例患者中無發生術中或術后出血者。其中2例患者IPG囊袋皮膚破潰,經再次手術清創修補治愈;有3例患者出現短暫的抑郁癥狀發作,通過抗抑郁藥物治療得到改善;5例患者術后出現DBS刺激引起的異動現象,通過調節刺激觸點位置和刺激方式,異動癥狀消失;有2例患者術后10年出現明顯的認知功能障礙。
3 討 論
通過對PD患者DBS術后10年的隨訪,可以觀察到在非藥物治療狀態下,患者的震顫和僵直癥狀得到持續的改善。DBS治療震顫癥狀和僵直癥狀的機制與藥物治療的機制不同[6-7]。在藥物“關”狀態下,雖然沒有多巴胺能藥物的補充,但DBS依然可以持續控制震顫和僵直癥狀;其主要原因是電刺激抑制了基底節環路上相關神經元同步化震蕩活動的傳導[6]。與其他中心的研究結果相似,通過對丘腦底核神經元的動作電位進行細胞外微電極記錄,本研究發現在沒有補充多巴胺能藥物的“關”狀態下,神經元的動作電位由“開”狀態下的緊張性放電,變為不規則放電[4,7-8]。通過傅里葉變換尋找不規則放電的神經元放電模式特點,本研究發現,神經元的放電存在周期性。進一步通過相關性分析顯示,4~6 Hz的神經元周期節律性電活動與肢體4~6 Hz的靜止性震顫相關;而β節律的神經元周期性電活動與肢體的僵直和遲緩癥狀相關[4,8]。通過DBS對靶點核團的高頻電刺激,可以抑制神經元病理性同步化電活動,從而改善PD患者的靜止性震顫和僵直遲緩癥狀[4,7]。
DBS術后PD患者的運動癥狀波動現象和異動現象可以得到明顯的持續性改善。由于DBS電刺激可以持續抑制患者的震顫癥狀和僵直遲緩癥狀,PD患者的“開,關”現象得到明顯控制。異動現象的改善與DBS抑制神經元的超低頻周期性電活動有關[9]。本研究發現,藥物引起的異動現象以及PD患者的“關”期異動現象與神經元放電頻率與放電模式改變有關。通過DBS神經調控,可以改善神經元的病理性電活動,從而抑制PD患者的異動現象[9-10]。
研究表明DBS長期治療對PD患者的語言功能改善效果不佳;雖然DBS可以改善聲音的震顫以及改善聲音的音量,但語言整體的清晰程度沒有得到改善,甚至有些患者因為DBS的刺激進一步加重原有的構音障礙[11]。DBS改善聲音顫動和音量可能與改善發音相關肌肉的震顫和肌肉的僵硬有關。約90%的PD患者在病程進展過程中會逐漸出現構音障礙,這種構音障礙的特點是運動性發音障礙,即運動功能減退性構音障礙(hypokinetic dysarthria,HD)[12]。HD的病理機制尚未明確。HD通過藥物治療和手術治療效果不佳,以及近期功能影像學研究的表明PD的語言障礙發生機制與PD的運動障礙發生機制不同[11-13]。關于聲學特征的改變與運動障礙改變(采用UPDRS-Ⅲ評估)二者之間沒有明顯的相關性。Skodda等[14]研究顯示,PD病程進展的同時會出現聲學參數的變化,但與UPDRS-Ⅲ評分不相關。聲學特征的改變與運動障礙改變的不一致可能是由于(部分)不同的病理生理機制所導致的[13-14];這些病理生理機制不同于PD運動癥狀產生的機制(如基底節環路模型假說),而更類似于產生軸線癥狀的機制,如HD或步態異常[15]。
丘腦底核DBS對步態改善效果不佳。對于藥物難治性步態障礙的PD患者丘腦底核或蒼白球內側部電刺激不但沒有改善癥狀的作用,往往術后還會加重步態障礙。而大腦腳間核(pedunculopontine nucleus,PPN)作為唯一可以改善藥物難治性PD步態障礙的靶點,已為多個中心所采用[15-16]。研究顯示,PPN作為治療PD的新興靶點,低頻刺激PD動物模型的PPN可以改善凍結步態、姿勢平衡障礙以及語言的HD[15-16]。本研究通過低頻電刺激PPN靶點,可以有效緩解PD患者的步態和平衡障礙[17]。目前DBS刺激參數的選擇,以及顱內電極靶點位置和所用觸點的選擇,是根據DBS對肢體的運動功能改善而選擇的,并不是通過對語言功能、步態障礙以及認知功能障礙的改善來選擇的。所以DBS對相關非運動癥狀改善效果不顯著。
本研究患者在藥物“開”狀態下,UPDRS-Ⅱ和UPDRS-Ⅲ評分在術后10年時均比術前明顯變差;姿勢穩定性、語言、運動遲緩和步態的評分均逐漸惡化。相關研究顯示,這些軸線癥狀的惡化,可能與多巴胺能神經元變性過程向非多巴胺能神經元的擴散有關[18-20]。對多巴胺能藥物治療的反應性降低被認為是晚期PD的一個明顯特征。多巴胺能神經元退行性改變的病理過程擴展到非多巴胺能神經元,可能是DBS在藥物治療狀態下效果下降的原因之一[19]。
DBS不能阻止PD本身病情的進展。雖然PD病情持續進展,但是DBS可以通過改善運動功能和持續減少多巴胺能藥物的劑量而產生有益的效果[2]。本研究發現,DBS刺激參數和藥物劑量在術后1年基本穩定,整個觀察期間無明顯變化。這些數據進一步表明,閾上劑量的多巴胺能藥物對DBS治療的患者并沒有額外的益處,PD病情的持續進展是治療效果差的主要原因[14,19]。
DBS治療長期安全有效,術后第10年的不良事件發生率與第5年相比沒有顯著差異[1-2]。本研究75例PD患者中,2例患者發生了由刺激裝置引起的感染;本組患者的DBS術后感染率低于以往報道,可能與本組患者的樣本量較小有關[2]。這2例感染患者胸部IPG囊袋破潰均發生在更換IPG后,可能原因有兩點:(1)隨著PD病情的進展,患者的營養狀態變差、皮下脂肪減少、皮膚變薄;(2)更換IPG型號為37601,與原IPG型號形狀不同,造成囊袋部分區域張力增大、局部血運變差,導致皮膚缺血壞死破潰。另外有2例患者出現了嚴重的認知功能障礙。DBS是否會引起或加重認知功能障礙一直存在爭議[21]。一些神經外科中心正在開展丘腦底核DBS治療癡呆的研究,其長期療效如何尚有待觀察。一項對7 053例PD患者的薈萃分析顯示,PD患者輕度認知功能障礙的患病率約為40%[22];約50%認知功能正常的PD患者在發病6年內會出現認知功能障礙[23];如果不施加干預,約70%~80%的PD患者會發展為癡呆。
綜上所述,本研究隨訪結果表明,STN-DBS對PD運動癥狀有顯著的療效,持續時間長達10年,同時可以減少患者多巴胺能藥物的使用劑量。但本研究尚存在一定的局限性和不足,包括缺乏對照組、未使用雙盲設計、樣本量相對較小,以及缺乏神經心理學檢測結果;DBS以單極模式刺激,但刺激過程較復雜,不能排除DBS使用的刺激方式和部位引起步態障礙、頭暈等癥狀的可能性。

