HIF-2α表達對低氧環境下胃癌細胞增殖、凋亡和細胞周期的影響
郭培玲,馬 銘,閆蘭芳,陳雙艷,趙富鋒,陳 蓉
四川省成都市雙流區第一人民醫院/四川大學華西空港醫院醫學檢驗科,四川成都 610200
胃癌是最常見的惡性腫瘤之一,每年約有100萬新發胃癌病例,病死率在惡性腫瘤中位居第二[1]。作為典型的實體腫瘤之一,胃癌能夠在短期內快速增長導致腫瘤組織內部存在缺血、缺氧區[2]。局部缺氧是胃癌發生發展的重要環節,腫瘤細胞在缺氧環境下形成一系列補償機制以適應低氧微環境,從而促進腫瘤增長[3-4]。在胃癌適應缺氧的補償機制中,缺氧誘導因子-α(HIF-α)起主導作用,其中作用最顯著的是HIF-1α和HIF-2α[5]。HIF-1α及HIF-2α的陽性表達均能夠通過誘導局部缺氧環境的形成,加劇癌細胞核DNA的轉錄速度,提高癌細胞的浸潤和黏附能力[6]。現有的研究主要報道了HIF-2α在如小細胞肺癌[7]、結腸癌[8]、肝癌[9]等癌癥中的作用。有關HIF-2α在胃癌中的研究相對較少。因此,本文旨在應用特異性HIF-2α小干擾RNA(siRNA)下調低氧誘導下胃癌細胞BGC823中HIF-2α的表達,探討HIF-2α對低氧環境下胃癌BGC823細胞增殖、凋亡和細胞周期的影響,為胃癌分子靶向治療提供試驗基礎。
1 材料與方法
1.1材料來源 人胃癌細胞株BGC823購自中國科學院上海生科院細胞資源中心;RPMI1640細胞培養基、胎牛血清及0.25%胰蛋白酶購自美國Gibco公司;HIF-2α siRNA由上海吉瑪股份有限公司設計并合成;Lipo 6000轉染試劑、Trizol RNA提取試劑盒、CCK-8分析試劑盒和Annexin Ⅴ-FITC/PI雙染試劑盒購自上海碧云天生物技術有限公司。
1.2方法
1.2.1細胞低氧培養 胃癌BGC823細胞置于含10%胎牛血清的RPMI1640培養液(37 ℃培養箱,5%的CO2)培養,胰酶消化傳代。低氧環境采用200 μmol/L 氯化鈷(CoCl2)誘導,細胞于低氧環境中培養24 h后收集用于檢測。
1.2.2細胞轉染與分組 細胞低氧誘導培養后,細胞融合度達到85%左右時,在Lipo 6000脂質體介導下轉染細胞。試驗分為3組,即BGC823常氧培養組,BGC823低氧誘導組與BGC823(HIF-2α-/-)低氧誘導組。
1.2.3RT-PCR檢測HIF-2α mRNA表達 收集轉染48 h后的各組細胞,按照 Trizol RNA提取試劑盒說明書步驟操作,逆轉錄成cDNA,RT-PCR方法檢測各組細胞中HIF-2α mRNA表達。試驗均重復檢測3次,計算Ct值,采用2-ΔΔCt法進行計算分析。
1.2.4CCK-8法檢測細胞增殖 取對數生長期的細胞消化后制備成細胞懸液,以2×104/mL密度接種于96孔板,每孔100 μL,貼壁過夜。每組各設6個復孔,在培養24、36、48、60、72 h后,每孔加入10 μL CCK-8溶液,孵育3 h,酶標儀測定450 nm處的吸光度值(A450 nm),繪制細胞生長曲線分析細胞增殖情況。
1.2.5PI單染檢測細胞周期 收集各組對數生長期細胞,用細胞篩過濾,磷酸緩沖鹽溶液(PBS)洗滌2次,計數1×105個細胞,加入75%預冷乙醇4 ℃固定過夜,加入5 μL PI染色液,輕搖10 min避光混勻后,上流式細胞儀進行周期變化檢測。
1.2.6Annexin Ⅴ-FITC/PI雙染檢測細胞凋亡情況 收集各組對數生長期細胞,用細胞篩過濾,PBS洗滌2次,計數2×105個細胞,加入0.3 mL Binding buffer重懸細胞,再加入5 μL Annexin Ⅴ-FITC和5 μL PI,避光溫育15 min,加入400 μL×Binding buffer,流式細胞儀檢測凋亡細胞的百分比。
1.2.7免疫印跡法(Western blot)檢測各組細胞中HIF-2α蛋白的表達情況 收集對數生長期細胞,裂解細胞提取總蛋白,二喹啉甲酸(BCA)法對蛋白進行定量,100 ℃下變性5 min。將樣本等量上樣至12%的SDS-PAGE凝膠,電泳分離蛋白后恒流轉至PVDF膜,5%脫脂乳粉封閉2 h,分別加入稀釋的一抗4 ℃振蕩孵育過夜,TBST漂洗后室溫振蕩孵育二抗60 min,ECL試劑盒顯色,凝膠成像分析儀掃描,計算灰度值,比對各組HIF-2α蛋白的表達情況。
2 結 果
2.1低氧誘導HIF-2α基因和蛋白的表達 RT-PCR結果顯示,BGC823常氧培養組中細胞在常氧環境下有少量HIF-2α mRNA和蛋白表達。BGC823低氧誘導組中細胞在CoCl2誘導的低氧環境下HIF-2α mRNA和蛋白表達顯著上調,與BGC823常氧培養組比較,差異有統計學意義(P<0.05)。BGC823(HIF-2α-/-)低氧誘導組中特異性轉染HIF-2α siRNA后細胞在低氧環境下HIF-2α mRNA和蛋白表達顯著下調,與BGC823低氧誘導組相比差異有統計學意義(P<0.05)。BGC823常氧培養組與BGC823(HIF-2α-/-)低氧誘導組比較,HIF-2α mRNA和蛋白表達差異無統計學意義(P>0.05)。見圖1。
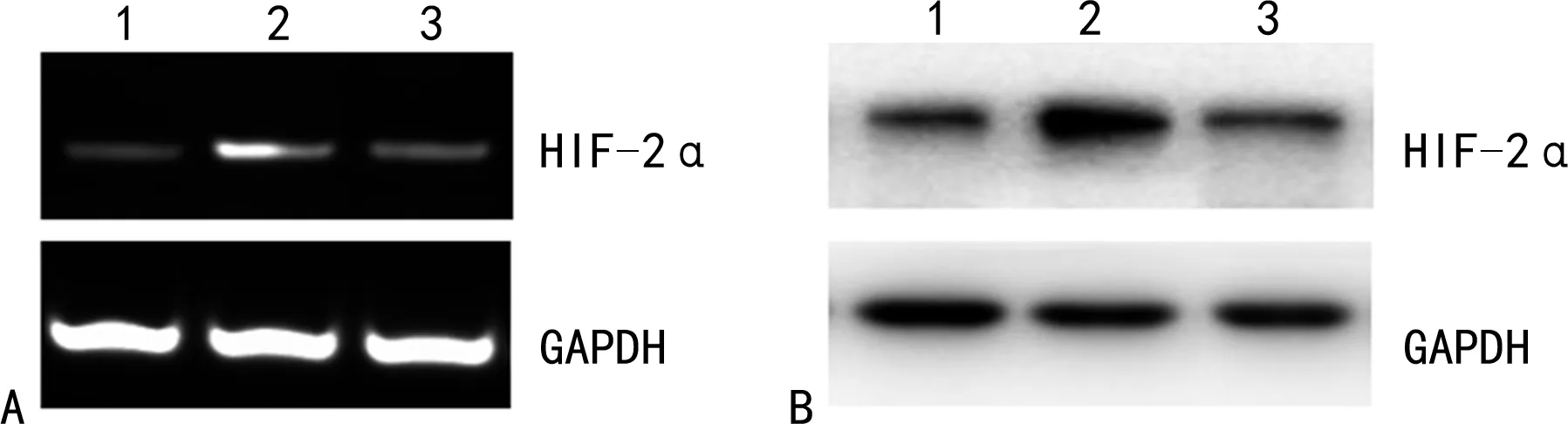
注:1為BGC823常氧培養組;2為BGC823低氧誘導組;3為BGC823(HIF-2α-/-)低氧誘導組。A為RT-PCR法檢測各組細胞中HIF-2α mRNA的表達情況;B為Western blot檢測各組細胞中HIF-2α蛋白的表達情況;GAPDH為甘油醛-3-磷酸脫氫酶。
2.2各組BGC823細胞的增殖情況 CCK-8法檢測結果顯示,與BGC823常氧培養組相比,BGC823低氧誘導組細胞在24、36、48、60、72 h時間點的A450 nm均顯著升高(P<0.01)。與BGC823低氧誘導組相比,BGC823(HIF-2α-/-)低氧誘導組對應時間點的A450 nm均顯著降低(P<0.05)。BGC823(HIF-2α-/-)低氧誘導組與BGC823常氧培養組相比,差異無統計學意義(P>0.05)。見圖2。

注:A為BGC823常氧培養組;B為BGC823低氧誘導組;C為BGC823(HIF-2α-/-)低氧誘導組;與BGC823常氧培養組比較,**P<0.01。
2.3各組BGC823細胞在細胞周期中G2期細胞所占比例 流式細胞儀檢測結果顯示,BGC823常氧培養組細胞周期中G2期細胞占比為23.73%,BGC823低氧誘導組細胞G2期細胞占比為20.25%,兩組差異有統計學意義(P<0.05)。BGC823(HIF-2α-/-)低氧誘導組細胞G2期細胞占25.52%,明顯高于BGC823低氧誘導組(P<0.05)。
2.4各組BGC823細胞的凋亡情況比較 流式細胞儀檢測結果顯示,與BGC823常氧培養組相比,BGC823低氧誘導組細胞凋亡比例顯著降低(P<0.05)。與BGC823低氧誘導組相比,BGC823(HIF-2α-/-)低氧誘導組細胞凋亡比例顯著升高(P<0.05)。BGC823(HIF-2α-/-)低氧誘導組與BGC823常氧培養組相比,差異無統計學意義(P>0.05)。見圖3。
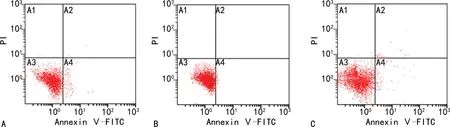
注:A為BGC823常氧培養組;B為BGC823低氧誘導組;C為BGC823(HIF-2α-/-)低氧誘導組。
3 討 論
胃癌是我國最常見的消化道惡性腫瘤之一,據統計胃癌居全球惡性腫瘤發病率的第5位,病死率居第3位,在亞洲胃癌病死率僅次于肺癌,給患者帶來巨大的衛生經濟負擔[10]。 由于胃癌起病比較隱匿、無明顯特異性癥狀,缺乏精準的早期診斷技術,在發現時常常已是中晚期,晚期胃癌患者5年生存率僅為5%~17%,嚴重影響了人類的生命健康[11]。目前,外科手術和放化療仍然是主要的治療手段,但是30%~40%的胃癌患者在初診時就失去了根治手術的機會,長期使用化療藥物又普遍出現耐藥現象,導致整體治療效果有限。因此,深入探索胃癌發生、發展的相關機制,有助于尋求新的診斷、預防及治療策略。
胃癌屬于實體瘤,在腫瘤細胞快速增殖與血管新生滯后等多重因素共同作用下,實體瘤內部普遍存在低氧區域。低氧環境可進一步誘導腫瘤細胞產生HIFs,HIFs可通過調控血管內皮生長因子(VEGF)的表達從而誘導腫瘤產生新生血管[12]。HIFs包括HIF-1、HIF-2和HIF-3,其中以HIF-1的研究居多,HIF-2次之。HIF-2是由相關學者克隆出的一種含有bHLH.PAS域的細胞因子,HIF-2α是HIF-2的功能性亞基和活性亞基,包括15個外顯子和14個內含子,基因長約120 kb,相對分子質量為96.5×103[13]。缺氧條件可激活HIF-2α的轉錄活性,參與腫瘤細胞的血管生成、侵襲轉移及放化療抵抗。MIZOKAMI等[14]在研究胃癌及正常胃黏膜上皮組織中HIF-2α mRNA及蛋白的表達時,發現HIF-2α在胃癌組織的表達明顯高于正常胃黏膜上皮組織,提示HIF-2α與胃癌關系密切。GRIFFITHS等[15]在研究HIF-2α與胃癌患者預后的關系時,發現HIF-2α在多變量分析中沒有獨立的預后意義,不能作為一種常規的預后指標。吳友亮等[16]研究發現在胃癌患者中HIF-2α的陽性表達率平均提高45%,且在合并遠處轉移的患者中,陽性表達率上升更為顯著。這些研究已充分證實HIF-2α與胃癌發生、發展關系密切,但是其具體調控機制尚未完全清楚。
在探索HIF-2α與胃癌的信號通路的研究中,WANG等[17]發現JNK抑制劑能夠阻斷HIF-1α和HIF-2α的表達,提示HIF-2α通過JNK信號通路參與抑制胃癌細胞的侵襲能力。在研究HIF-2α與腫瘤血管生成的關系中,WU等[18]指出在非小細胞肺癌中HIF-2α與VEGF共同主導腫瘤血管生成過程。但SONG等[19]指出缺氧環境下胃癌中VEGF和葡萄糖代謝相關基因表達的是HIF-1α和HIF-1β,而不是HIF-2α。但是,HIF-2α在腫瘤組織和血管內皮的表達比HIF-1α更強烈[20],因此以HIF-2α為靶點的抗癌研究仍然具有深遠的價值。
本研究通過模擬胃癌低氧環境,發現BGC823低氧誘導組細胞增殖速度與常氧培養組比較明顯升高,低氧環境可顯著促進BGC823細胞的HIF-2α蛋白的表達,這與相關研究報道相一致[21]。腫瘤的進展離不開腫瘤細胞的過度增殖和凋亡減弱,并與細胞周期的調控異常有密切關系。細胞周期遵循G1-S-G2-M的發展規律,細胞一旦從G1期跨入S期則不再依靠外來信息刺激而自動完成分裂過程[22]。本研究通過siRNA技術下調BGC823細胞中HIF-2α的表達后能夠促進細胞凋亡。與BGC823低氧誘導組相比,BGC823(HIF-2α-/-)低氧誘導組細胞的凋亡比例升高,其機制可能與低氧環境中HIF-2α低表達能夠阻滯腫瘤細胞在G2期有關。
綜上所述,本研究結果提示HIF-2α表達情況影響低氧環境下胃癌細胞增殖、凋亡和細胞周期。下調HIF-2α表達可通過抑制細胞增殖、促進細胞凋亡,來減緩胃癌的惡性發展。

