前蛋白轉化酶枯草溶菌素9對革蘭陰性菌膿毒癥預后的評估價值*
祝 青,郭 琪,吳 穎,賀軍宇,鄒國英△,吳 意
1.湖南中醫藥大學臨床醫學院檢驗教研室,湖南長沙 410208;2.湖南省腦科醫院檢驗科,湖南長沙 410007;3.湖南省人民醫院檢驗科,湖南長沙 410005
膿毒癥是病原體感染機體引起免疫反應失衡而導致危及生命的器官功能障礙,是重癥監護病房(ICU)患者主要的死亡原因,病死率可高達20%[1]。革蘭陰性菌(G-)膿毒癥病情發展迅速、危險急驟,若不及時治療,患者則容易在短時間內發展成為膿毒癥休克,甚至死亡[2]。目前臨床常用降鈣素原(PCT)、C反應蛋白(CRP)、白細胞介素(IL)-6、乳酸(LAC)、急性生理與慢性健康狀況評分(APACHEⅡ評分)早期診斷膿毒癥,但上述指標缺乏特異性、容易受藥物治療情況影響,目前有關評估G-膿毒癥疾病嚴重程度和預后的研究較少[3-4]。有研究提示,前蛋白轉化酶枯草溶菌素9(PCSK9)是治療膿毒癥的潛在靶點[5]。脂多糖(LPS)是觸發G-膿毒癥炎性反應的主要致病因素,通過調節低密度脂蛋白受體(LDLR)清除LPS,PCSK9可以通過下調LDLR數量而影響LPS的清除[6]。因此本文通過檢測患者血清中PCSK9水平,評估其在G-膿毒癥不同感染程度、病情嚴重程度、預后效能診斷中的價值,為指導臨床治療G-膿毒癥提供依據。
1 資料與方法
1.1一般資料 選取2019年9月至2020年9月入住湖南省腦科醫院(以下簡稱“本院”)ICU 48 h的90例G-膿毒癥患者為G-膿毒癥組,其中男49例、女41例,平均年齡(63.3±6.8)歲。另選擇38例革蘭陽性菌(G+)膿毒癥患者為G+膿毒癥組,其中男16例、女22例,平均年齡(60.8±8.6)歲。納入標準:臨床癥狀均有發熱(體溫≥38 ℃),有感染癥狀或血培養陽性,序貫器官衰竭評分(SOFA評分)≥2分的患者。選取同期臨床癥狀表現為發熱但血培養為陰性的40例患者為單純全身炎癥反應綜合征組(單純SIRS組),其中男22例、女18例,平均年齡(64.8±7.2)歲。選取同期本院體檢中心的40例健康者為健康對照組,其中男20例、女20例,平均年齡(63.8±8.4)歲。排除標準:(1)入住ICU時間<24 h;(2)患有急慢性傳染病、腫瘤及自身免疫性疾病者;(3)患有糖尿病、冠心病、高脂血癥患者。4組研究對象的性別、年齡比較,差異無統計學意義(P>0.05),具有可比性。根據文獻[7]對膿毒癥患者進行診斷:感染(血液、尿、腦脊液、傷口、呼吸道分泌物、其他體液等標本培養陽性),同時SOFA評分≥2分的患者[8]。SIRS診斷標準:符合下述2項或2項以上即可診斷SIRS。(1)體溫>38 ℃或<36 ℃。(2)心率>90次/分或低血壓(收縮壓<90 mm Hg,或較基線降低>40 mm Hg)。(3)呼吸急促(>20次/分)或通氣障礙(動脈血二氧化碳分壓<32 mm Hg)。(4)外周血白細胞計數>12.0×109/L或<4.0×109/L,或未成熟白細胞比例>10%,但排除可以引起上述急性異常改變的其他原因。根據APACHEⅡ評分[9]判斷G-膿毒癥患者的病情嚴重程度,分為輕度組(≤43分)、中度組(>43~53分)和重度組(>53分);根據G-膿毒癥患者出院時預后情況,將病情穩定、好轉、治愈的患者記為預后良好組,將患者出院時意識昏迷、昏睡、放棄治療、死亡的患者記為預后不良組。本研究獲醫院倫理會審核批準。
1.2儀器與試劑 Multiskan NK3酶標儀(默飛世爾儀器有限公司);Cobas E601電化學發光分析儀(Roche公司);CL-6000i全自動發光分析儀(邁瑞有限公司);PCSK9和載脂蛋白M(apoM)酶聯免疫吸附(ELISA)檢測試劑盒(長沙生物科技有限公司產品);IL-6和PCT電化學發光試劑盒,Roche配套產品(Roche公司);LAC測定試劑盒(湖南永和陽光生物科技股份有限公司);CRP試劑盒(九強生物技術股份有限公司)。
1.3方法
1.3.1標本采集與處理 采集研究對象空腹靜脈血,3 000 r/min離心10 min,吸取血清3 mL于EP管置-80 ℃凍存備用。
1.3.2各指標的檢測 血清PCSK9和apoM水平的測定采用ELISA法,嚴格按試劑盒操作:設標準品孔、空白孔和樣本孔,分別加入血清50 μL,再加入酶標記物100 μL,37 ℃孵育60 min,洗滌1 min,共洗滌5次,加底物A和B液各50 μL,于37 ℃溫育15 min顯色,終止反應后在450 nm波長處測定吸光度值(A450 nm),計算PCSK9和apoM水平。血清IL-6和PCT的檢測采用電化學發光法,按儀器與試劑盒操作說明在Cobas E601電化學發光分析儀上測定。血清CRP測定采用乳膠免疫比濁法,血清LAC測定采用乳酸氧化酶法,按照各自的試劑盒說明書進行操作,在CL-6000i全自動發光分析儀上分析結果。
2 結 果
2.1各組研究對象血清中PCT、IL-6和CRP水平的比較 與健康對照組比較,單純SIRS組、G+膿毒癥組、G-膿毒癥組血清PCT、IL-6、CRP水平明顯增高(P<0.05);與單純SIRS組比較,G-膿毒癥組血清CRP水平明顯升高(P<0.05);與G+膿毒癥組比較,G-膿毒癥組血清PCT、CRP水平明顯增高(P<0.05),見表1。

表1 各組研究對象血清中PCT、IL-6和CRP水平的比較[M(P25,P75)]
2.2各組研究對象血清中LAC、PCSK9和apoM水平的比較 與健康對照組比較,單純SIRS組、G+膿毒癥組、G-膿毒癥組血清LAC、PCSK9水平明顯升高,但apoM水平明顯降低(P<0.05);與單純SIRS組和G+膿毒癥組比較,G-膿毒癥組血清PCSK9、LAC水平明顯升高(P<0.05),apoM水平明顯降低(P<0.05);G-膿毒癥組血清apoM水平明顯低于單純SIRS組(P<0.05),見表2。

表2 各組研究對象血清中LAC、PCSK9和apoM水平比較[M(P25,P75)]
2.3G-膿毒癥不同病情嚴重程度患者血清中PCSK9和apoM的比較 隨著G-膿毒癥病情的加重,PCSK9水平在輕度組、中度組、重度組中呈增高趨勢,但apoM水平呈降低趨勢(P<0.05),見表3。
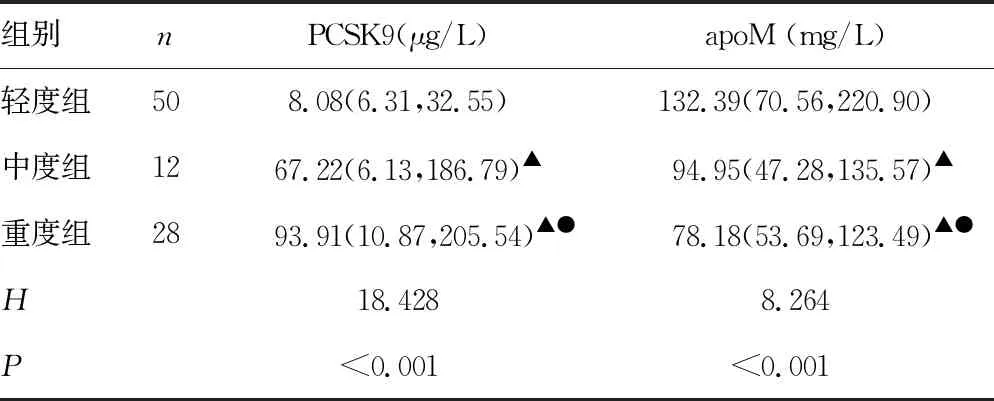
表3 G-膿毒癥不同嚴重程度患者血清中PCSK9和apoM水平的比較[M(P25,P75)]
2.4影響G-膿毒癥患者預后的單因素分析 對患者出院時預后情況進行分析,其中預后不良組26例,預后良好組64例。與預后良好組比較,預后不良組血清PSCK9、PCT、LAC、CRP及APOCHEⅡ評分明顯增高,但apoM水平明顯降低(P<0.05),見表4。

表4 影響G-膿毒癥患者預后的單因素分析[M(P25,P75)]

組別nPCSK9(μg/L)apoM(mg/L)APACHEⅡ評分(分)SOFA評分(分)預后良好組647.78(6.31,32.55)147.04(83.39,220.90)25.00(17.00,37.00)4.00(3.00,6.00)預后不良組2696.31(25.53,207.03)64.50(40.42,120.40)37.00(25.00,43.00)5.00(3.00,6.00)Z-5.3804.617-2.753-0.055P<0.001<0.0010.0060.957
2.5影響G-膿毒癥預后的多因素分析 多因素Logistic回歸分析結果顯示,PSCK9、apoM、APACHEⅡ評分是G-膿毒癥預后的獨立影響因素(P<0.05),見表5。
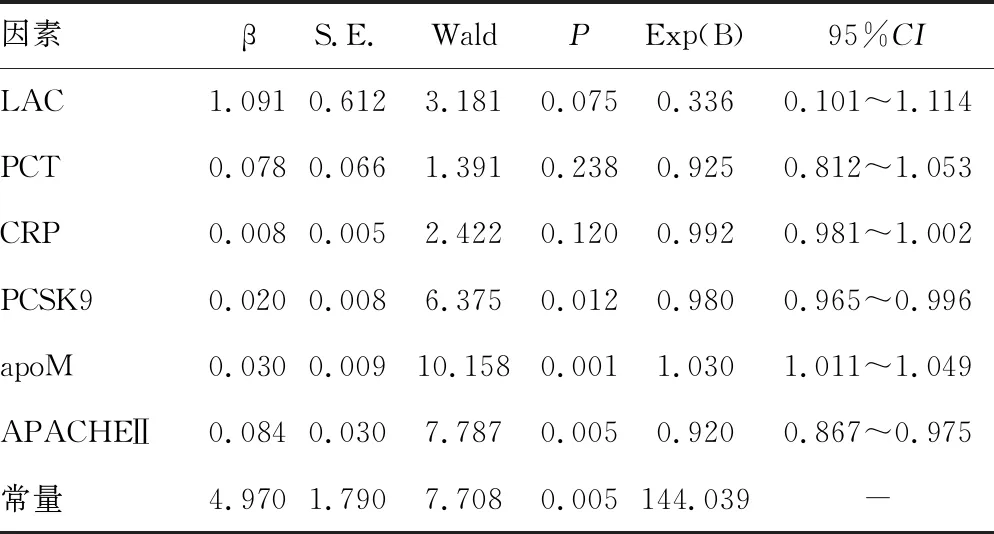
表5 影響G-膿毒癥預后的多因素Logistic回歸分析
2.6apoM及PCSK9預測G-膿毒癥的預后效能 apoM和PCSK9預測G-膿毒癥預后不良的曲線下面積(AUC)分別為0.817 8和0.794 0,低于APACHEⅡ評分的0.877 1。但PCSK9的特異度(94.44%)高于APACHEⅡ評分(90.74%),apoM的靈敏度(86.49%)高于APACHEⅡ評分(78.38%)。
3 討 論
膿毒癥是感染、休克、外傷等的常見并發癥,發病率及病死率仍居高不下,成為ICU患者主要的死因之一。診斷膿毒癥的金標準是血培養,但耗時過長。目前已有170余種不同的生物標志物可對膿毒癥進行診斷和評價,但是尚缺乏特異度和靈敏度均較高的生物標志物[10]。PCT、IL-6和CRP是目前臨床常用且參考意義較大的細菌感染標志物,但缺乏特異性,非感染性疾病患者PCT水平也會升高[11]。研究表明,ICU患者血清三酰甘油水平與膿毒癥病死率相關[12]。膿毒癥的致病因素多,涉及炎癥、免疫、凝血等多系統、多器官的病理生理過程,因此尋找能用于早診斷、病情判斷、評估預后的生物學標志物尤為重要。
G-膿毒癥是由G-感染所致的膿毒癥,其主要致病因素為G-的LPS。LPS通過Toll樣受體4(TLR4)信號通路觸發炎性反應,刺激炎癥細胞釋放相關炎癥因子,導致彌散性血管內凝血(DIC)、多器官功能障礙綜合征(MODS),若不及時治療,可出現膿毒癥休克,甚至死亡[13]。機體中的LPS通過LDLR途徑在肝臟發生反應,經膽管、腸道排出體外[14]。PCSK9由肝臟合成、分泌入血,通過調控膽固醇代謝途徑影響膿毒癥脂代謝紊亂特異性分子的代謝[15]。生理情況下,肝細胞膜表面上的受體LDLR與血液低密度脂蛋白膽固醇(LDL-C)結合形成復合物,通過胞吞進入細胞內,在低pH值時LDLR在內體小泡中與LDL-C分離,LDL-C被溶酶體降解,LDLR重新回到肝細胞表面被重復利用。研究表明,PCSK9是LDLR的關鍵性負調節因子,膿毒癥患者中PCSK9水平增加,PCSK9入血與LDLR結合形成復合物,復合物遷移至溶酶體中被降解,LDLR無法回到肝細胞表面被重復利用,從而影響脂蛋白對LPS的吸收,降低LPS的清除率[16]。PCSK9通過TLR4受體激活NF-KB信號通路激活炎癥,加重膿毒癥的病情。本研究結果顯示,G-膿毒癥組患者血清PCKS9、IL-6、CRP、PCT、LAC水平均明顯高于健康對照組,且G-膿毒癥患者血清PCSK9水平明顯高于單純SIRS組和G+膿毒癥組(P<0.05),進一步研究發現,PCSK9水平隨著病情進展呈明顯增高趨勢。因此,監測膿毒癥患者血清PCSK9水平對早期診斷G-膿毒癥、評估G-膿毒癥的病情有一定積極意義。apoM是LDL和高密度脂蛋白(HDL)的主要成分,與多功能生物活性脂質介質S1P結合,保護血管內皮屏障功能[17]。膿毒癥患者血漿S1P水平于發病后6~8 h下降,apoM 于發病后12~24 h降低,內皮屏障功能被破壞,血管滲漏增加,膿毒癥病情越嚴重,apoM水平越低,越易引發休克[18]。本研究發現,G-膿毒癥組血清apoM水平明顯低于健康對照組和單純SIRS組,G-膿毒癥患者血清apoM水平隨著病情進展呈明顯降低趨勢,且預后不良組血清apoM水平明顯低于預后良好組,表明血清apoM水平降低對G-膿毒癥的診斷、病情判斷有一定意義。
通過單因素及多因素Logistic回歸分析發現,APACHEⅡ評分、PCSK9、apoM是評估G-膿毒癥預后的獨立影響因素。ROC曲線分析提示,PCSK9、apoM和APACHEⅡ評分均能較好地預測G-膿毒癥的預后。
綜上所述,G-膿毒癥患者的血清PCSK9、apoM水平與健康對照者差異明顯,兩者水平與G-膿毒癥的病情相關,是G-膿毒癥預后的獨立影響因素。血清PCSK9、apoM水平與APACHEⅡ評分可用于評估G-膿毒癥的預后。在實際工作,可與APACHEⅡ評分聯合使用,判斷G-膿毒癥的病情與預后。但本研究病例數較少,研究結果可能存在偏倚,還需要大樣本研究進行驗證。

