伴有TCF3-PBX1重排的兒童急性淋巴細胞白血病的臨床特征和預后效果
楊振中 張 陽 陳 瑜 劉 衡*
(貴州省人民醫(yī)院兒內科,貴州 貴陽 550002)
融合基因是血液系統(tǒng)腫瘤主要的分子生物學標志之一,與疾病的診斷、預后評估及療效監(jiān)測息息相關。t(1;19)(q23;p13)是急性淋巴細胞白血病(acute lymphoblastic leukemia,ALL)的一種染色體結構性異常,該易位導致TCF3-PBX1融合基因的形成,其編碼蛋白導致PBX1靶基因表達失控,進而誘發(fā)白血病[1]。既往研究認為,伴有TCF3-PBX1重排的B系ALL對化療反應差,中樞神經(jīng)系統(tǒng)復發(fā)率高,預后不良[2-4]。近年來,有研究發(fā)現(xiàn),增加化療強度可提高此類患者的存活率,改善預后[5-6]。由于該疾病的發(fā)病率低,國內目前對此類患者的臨床與實驗室特點、療效與預后的報道較少。本研究旨在探討伴有TCF3-PBX1重排的兒童ALL的臨床特征和預后效果。
1 資料與方法
1.1 一般資料 選取2012年12月至2018年12月我院收治的242例0~14歲兒童ALL中12例為TCF3-PBX1陽性組,以同期B系ALL中危組中32例TCF3-PBX1陰性患兒作為對照組。所有患兒監(jiān)護人均簽署知情同意書。
1.2 方法 所有病例初診時均采用MICM(細胞形態(tài)學、免疫學、細胞遺傳學及分子生物學)分型診斷。采集骨髓標本進行涂片,常規(guī)瑞氏染色及髓過氧化物酶(POX)染色、糖原(PAS)染色,在低倍鏡下觀察骨髓有核細胞增生程度,在油鏡下計數(shù)分析100個有核細胞。取骨髓標本通過流式細胞儀檢測白血病細胞免疫表型;取骨髓標本經(jīng)24 h培養(yǎng)G顯帶進行染色體核型分析,部分病例通過熒光原位雜交(fluorescence in situ hybridization,F(xiàn)ISH)檢測TCF3-PBX1易位;所有病例均通過多重巢式逆轉錄聚合酶鏈反應(multiplex-nested RTPCR)篩查白血病常見融合基因。所有病例的危險度分組與治療均按照CCLG-ALL2008方案進行,其中危險度分層指標包括年齡、診斷時外周血白細胞計數(shù)、潑尼松誘導試驗反應、誘導治療第33天、鞏固治療第8天骨髓緩解狀態(tài)(BM)、細胞遺傳學或分子生物學異常[7]。
1.3 觀察指標
1.3.1 微小殘留病監(jiān)測(MRD) 分別于誘導緩解第33天、鞏固化療第8天采集骨髓標本,采用八色流式細胞術監(jiān)測MRD,MRD<10-4視為陰性。
1.3.2 CNS分級 根據(jù)腦脊液白細胞計數(shù)及細胞形態(tài)學、臨床表現(xiàn)和影像學檢查結果,將CNS分為3級,即CNS1級、CNS2級、CNS3級,具體參見文獻[8]。
1.3.3 完全緩解與復發(fā)標準 完全緩解(CR)標準為骨髓原幼淋巴細胞小于5.00%,且無髓外白血病浸潤表現(xiàn);復發(fā)標準為骨髓細胞形態(tài)學檢查原幼淋巴細胞大于25.00%或骨髓外任何部位發(fā)現(xiàn)白血病浸潤表現(xiàn)[9]。
1.4 統(tǒng)計學處理 采用SPSS22.0統(tǒng)計學軟件進行處理。計數(shù)資料采用[n(%)]表示,兩樣本率的比較采用χ2檢驗;組間均數(shù)比較采用t檢驗。采用Kaplan-Meier法評估無事件生存率(EFS)值及總生存期(OS)值;OS時間為從診斷之日起至任何原因死亡或隨訪終點的時間間隔;EFS時間從診斷之日起至白血病復發(fā)或任何原因死亡的時間間隔。P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 兩組患者一般情況及MICM診斷結果 2012年12月至2018年12月筆者所在醫(yī)院共收治242例兒童ALL(B-ALL 210例,T-ALL 32例),其中12例伴有TCF3-PBX1重排,占患者總數(shù)的4.96%。12例患兒白血病細胞免疫表型均為B淋巴系表型,其中8例為前B細胞型(pre-B),占66.67%,其余4例為普通B細胞型(common-B),占33.33%,無T-ALL、成熟B-ALL、pro-B等其他表型。12例患兒初診時G顯帶法染色體核型分析結果顯示:不平衡易位即der(19)t(1;19)(q23;p13)4例(33.33%),平衡易位即t(1;19)(q23;p13)3例(25.00%),具有正常染色體核型(即46,XY或XX)3例(25.00%)。另外2例(16.67%)未見可供分析的中期分裂相。12例患兒初診時取骨髓標本,采用多重巢式RT-PCR法對TCF3-PBX1基因進行檢測,12例患兒均檢測到TCF3-PBX1基因重排;鞏固強化治療及全程化療結束后,采集骨髓標本應用RT-PCR方法對TCF3-PBX1融合基因進行定性及定量檢測,12例患兒TCF3-PBX1融合基因均轉為陰性。
2.2 初診時TCF3-PBX1陽性ALL與對照組之間臨床特征比較 12例伴有TCF3-PBX1重排的ALL患者初診時乳酸脫氫酶(LDH)水平顯著高于對照組(P<0.05),而性別、年齡、白細胞計數(shù)及中樞神經(jīng)系統(tǒng)受累情況與對照組比較差異無統(tǒng)計學意義(P>0.05)。見表1。
2.3 TCF3-PBX1陽性組與對照組早期治療反應比較 兩組誘導緩解化療第33天骨髓細胞形態(tài)學均獲CR。TCF3-PBX1陽性組誘導緩解第33天骨髓MRD12例(100.00%)均小于10-4,對照組28例(87.50%)小于10-4(P>0.05)。鞏固治療第8天兩組骨髓MRD均<10-4。見表2。
2.4 TCF3-PBX1陽性組與對照組遠期預后效果比較 TCF3-PBX1陽性組的12例患兒隨訪均未發(fā)現(xiàn)中樞神經(jīng)系統(tǒng)復發(fā),對照組2例骨髓復發(fā),1例單純中樞神經(jīng)系統(tǒng)復發(fā)。TCF3-PBX1陽性組患者3年無事件生存率為(91.72±8.03)%,OS(91.72±8.03)%,對照組EFS(90.61±5.04)%,OS(93.81±4.33)%,兩組3年EFS或OS比較差異無統(tǒng)計學意義(P>0.05)。見表3。
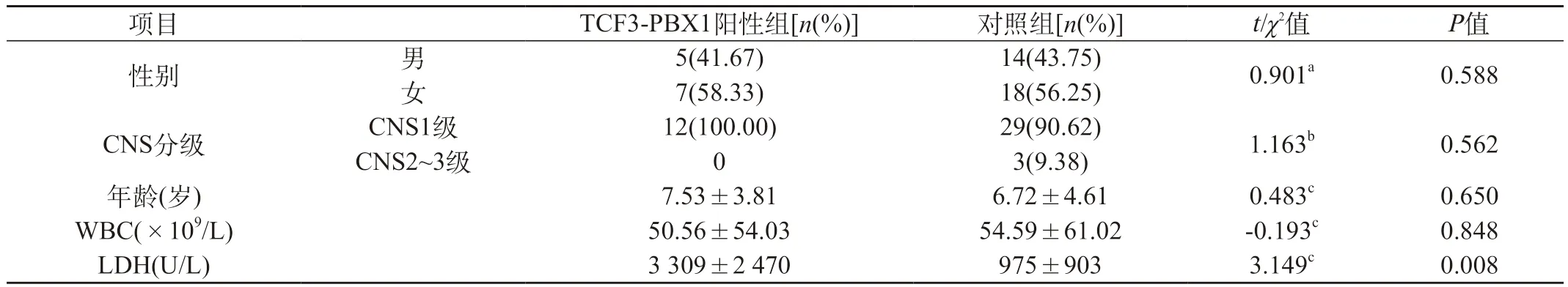
表1 初診時TCF3-PBX1陽性組與對照組之間臨床特征比較

表2 TCF3-PBX1陽性組與對照組早期治療反應比較

表3 TCF3-PBX1陽性組與對照組遠期預后效果比較
3 討 論
ALL是一組異質性很高的疾病,重現(xiàn)性遺傳學異常不僅可作為診斷依據(jù),還與預后效果關聯(lián)密切,是ALL分層治療的重要依據(jù)。TCF3-PBX1定義為前驅淋巴系腫瘤的一種獨立亞型[10]。E2A是調控B細胞發(fā)育的一種螺旋-環(huán)-螺旋轉錄因子,而PBX1是一種同源結構域蛋白,t(1;19)(q23;p13)易位導致E2A-PBX1融合基因形成。雖然有研究發(fā)現(xiàn)約0.6%的新生兒臍血標本中可檢測出TCF3-PBX1融合基因,但該融合基因的形成目前一般認為是出生后獲得性的[11]。該融合基因編碼的轉錄因子通過RUNX1依賴與非依賴的方式激活生長促進基因或與B細胞轉化相關的基因,導致白血病的發(fā)生[12-13]。TCF3-PBX1融合基因陽性在B淋巴母細胞淋巴瘤(B-LBL)中極為罕見,日本的一篇文獻報道記載,在14家核心醫(yī)院中的5家醫(yī)院中共檢出7例TCF3-PBX1陽性B-LBL[14],相對而言,TCF3-PBX1陽性在B系ALL中檢出率稍高。在北歐國家,TCF3-PBX1陽性兒童ALL占兒童B系淋巴細胞白血病的l.80%[15],美國白人為3.10%[16],英國的1篇研究報道為2.90%[17],普遍較亞洲國家低。日本有研究報道為7.20%[18]。國內來自北大人民醫(yī)院和河北燕達陸道培醫(yī)院的數(shù)據(jù)顯示,兒童ALL中TCF3-PBX1陽性率為5.38%[19],臺灣地區(qū)報道兒童ALL中TCF3-PBX1陽性率為5.70%[20],香港地區(qū)為4.80%[5]。本研究病例資料來自貴州多民族地區(qū),TCF3-PBX1陽性率為4.96%,與上述漢族聚居區(qū)的數(shù)據(jù)相似。
本研究選取32例TCF3-PBX1陰性的中危組兒童B系ALL為對照組,TCF3-PBX1陽性組兒童ALL的發(fā)病年齡、性別及診斷時白細胞數(shù)均與對照組比較差異無統(tǒng)計學意義(P>0.05)。TCF3-PBX1陽性組初診時LDH明顯增高,與對照組比較差異有統(tǒng)計學意義(P<0.05),提示血清LDH明顯增高是其特征性表現(xiàn)之一。既往較多研究報道,TCF3-PBX1陽性兒童ALL的免疫表型多數(shù)為pre-B型[21],本研究中TCF3-PBX1陽性兒童ALL均為B系淋巴細胞表型,以pre-B型為主,但普通B細胞型并不少見,與相關報道[22]相似。
既往研究認為,TCF3-PBX1陽性兒童ALL易出現(xiàn)中樞神經(jīng)系統(tǒng)復發(fā)。圣猶大兒童醫(yī)院41例TCF3-PBX1陽性的兒童ALL中有4例出現(xiàn)中樞神經(jīng)系統(tǒng)復發(fā)[4]。我國臺灣地區(qū)兒童腫瘤協(xié)作組報道TCF3-PBX1陽性ALL的CNS復發(fā)高達8.70%[20]。實驗動物模型顯示,TCF3-PBX1陽性小鼠易于并發(fā)CNS白血病,可能與PBX1、MER、IL-15、ZAP70等生存途徑因子或趨化因子CXCR4、CCR7的上調有關[23]。本研究12例TCF3-PBX1重排的ALL患兒診斷時均無CNS受累(CNS-1),隨訪均未出現(xiàn)CNS復發(fā),與相關報道[5]相似,可能與近年來采用更高強度的中樞神經(jīng)系統(tǒng)白血病預防方案有關。但本研究例數(shù)較少,且隨訪時間相對較短,有待進一步增加觀察病例數(shù)、延長隨訪時間得出更為確切的結論。
微小殘留病(MRD)反映腫瘤細胞對化療的敏感性,是評估療效、判斷預后的可靠因素。將MRD水平用于危險度分層、指導個體化治療已取得顯著的成果[24]。目前,MRD檢測方法有流式細胞法、融合基因定量RT-PCR、IgH/TCR重排定量PCR、新一代測序(指導NGS)4種方法[25],本研究采用流式細胞術分別在誘導緩解第33天及鞏固治療第8天采骨髓標本檢測骨髓MRD,結果顯示TCF3-PBX1陽性組誘導緩解第33天骨髓MRD均小于10-4,而對照組仍有4例未小于10-4,鞏固治療第8天兩組MRD均全部轉陰(10-4),不同時間點組間MRD水平比較差異無統(tǒng)計學意義(P>0.05)。本研究12例TCF3-PBX1陽性組患者,中位隨訪時間37個月(10.0~74.5個月),1例早期骨髓復發(fā),家屬放棄治療死亡;對照組隨訪時間與TCF3-PBX1陽性組差異無統(tǒng)計學意義,2例骨髓復發(fā),均死亡,1例中樞神經(jīng)系統(tǒng)早期復發(fā),按BFM-2002復發(fā)方案化療獲CR2,隨后給予放療及維持化療,目前仍在隨訪中。既往報道,低強度化療下TCF3-PBX1陽性ALL預后不良[2-3]。目前多數(shù)研究均把TCF3-PBX陽性ALL歸入中危組或高危組,給予高強度的化療,增加鞘注氨甲蝶呤次數(shù),明顯改善了患兒的預后效果[5,26-27]。在成人ALL中也得到類似的研究結果,既往成人TCF3-PBX1陽性ALL的5年OS在31%~51%,美國MD安德森癌癥中心對TCF3-PBX1陽性的成人ALL給予包含大劑量氨甲蝶呤與阿糖胞苷的高強度化療方案,加強CNSL預防,延長維持治療期,使該類患者5年OS達到82%,明顯優(yōu)于其他亞型的ALL[28]。本研究兩組患兒均按CCLG-ALL08中危組方案化療,相對標危組,中危組誘導緩解化療階段增加了兩劑柔紅霉素,早期強化階段多了一輪CAM方案,鞏固化療階段氨甲蝶呤為5 g/m2,延遲強化階段增加了一輪VDLD+CAM方案化療。TCF3-PBX1陽性組ALL患兒3年EFS為(91.72±8.03)%,OS率為(91.72±8.03)%,對照組3年EFS為(90.61±5.04)%,OS率為(93.81±4.33)%,組間3年EFS或OS比較差異均無統(tǒng)計學意義(P>0.05)。由此可見,按CCLG-ALL08中危組方案化療,TCF3-PBX1陽性ALL患兒可獲得與TCF3-PBX1陰性B系ALL同樣的療效。
總之,按CCLG-ALL08方案加強化療,TCF3-PBX1陽性ALL患兒可取得良好的療效,且未觀察到中樞神經(jīng)系統(tǒng)復發(fā)事件增加。但本研究存在樣本量少、隨訪時間較短等缺陷,有待進一步增加觀察病例、延長隨訪時間得出較為確切的結論。

