《中國(guó)藥典》在臨床用藥安全中發(fā)揮的保障作用
洪小栩
(國(guó)家藥典委員會(huì),北京 100061)
1 引言
2020年6月24日,國(guó)家藥品監(jiān)督管理局與國(guó)家衛(wèi)生健康委員會(huì)聯(lián)合頒布了2020年版《中華人民共和國(guó)藥典》(以下簡(jiǎn)稱《中國(guó)藥典》)[1],并于2020年12月30日起正式實(shí)施。2020年版《中國(guó)藥典》是新中國(guó)成立以來的第十一版藥典。其編制工作認(rèn)真貫徹“最嚴(yán)謹(jǐn)?shù)臉?biāo)準(zhǔn)”要求、緊跟國(guó)際藥品標(biāo)準(zhǔn)發(fā)展趨勢(shì),對(duì)標(biāo)國(guó)際先進(jìn)標(biāo)準(zhǔn),兼顧我國(guó)藥品生產(chǎn)實(shí)際。不斷完善藥品質(zhì)量控制理念,加強(qiáng)國(guó)家藥品標(biāo)準(zhǔn)體系建設(shè),對(duì)藥品全程質(zhì)量控制進(jìn)行了強(qiáng)化,從整體上提升了我國(guó)藥品的質(zhì)量。在保證《中國(guó)藥典》科學(xué)性、先進(jìn)性、實(shí)用性、規(guī)范性的同時(shí),通過藥典品種的收載、通用性技術(shù)要求的完善、先進(jìn)分析檢驗(yàn)技術(shù)的應(yīng)用、檢測(cè)項(xiàng)目和限量的設(shè)置、相關(guān)技術(shù)指導(dǎo)原則的制定,進(jìn)一步發(fā)揮藥典標(biāo)準(zhǔn)對(duì)藥品質(zhì)量控制的前瞻性和導(dǎo)向性作用。2020年版《中國(guó)藥典》的頒布實(shí)施對(duì)整體提升我國(guó)藥品標(biāo)準(zhǔn)、進(jìn)一步保證藥品質(zhì)量、保障公眾用藥安全、促進(jìn)我國(guó)醫(yī)藥產(chǎn)業(yè)健康發(fā)展,產(chǎn)生積極而深遠(yuǎn)的影響。
2 《中國(guó)藥典》的作用
國(guó)家藥品標(biāo)準(zhǔn),是國(guó)家為保證藥品質(zhì)量對(duì)藥品的質(zhì)量指標(biāo)、檢驗(yàn)方法等作出的強(qiáng)制性技術(shù)規(guī)定。新修訂的《中華人民共和國(guó)藥品管理法》[2]進(jìn)一步強(qiáng)化了國(guó)家藥品標(biāo)準(zhǔn)的法定性作用,指出“國(guó)務(wù)院藥品監(jiān)督管理部門頒布的《中華人民共和國(guó)藥典》和藥品標(biāo)準(zhǔn)為國(guó)家藥品標(biāo)準(zhǔn)”。2020年7月1日正式實(shí)施的《藥品注冊(cè)管理辦法》[3]中也明確規(guī)定“藥品注冊(cè)標(biāo)準(zhǔn)應(yīng)當(dāng)符合《中華人民共和國(guó)藥典》通用技術(shù)要求,不得低于《中華人民共和國(guó)藥典》的規(guī)定”。《中國(guó)藥典》是國(guó)家藥品標(biāo)準(zhǔn)的重要組成部分,是國(guó)家藥品標(biāo)準(zhǔn)體系的核心,是藥品生產(chǎn)經(jīng)營(yíng)者的基本遵循,是藥品監(jiān)督管理工作的準(zhǔn)繩。
藥典是藥品科學(xué)技術(shù)發(fā)展成果的結(jié)晶,是一個(gè)國(guó)家藥品產(chǎn)業(yè)發(fā)展水平的標(biāo)志。一個(gè)國(guó)家有沒有本國(guó)藥典、能不能獨(dú)立制定藥典,是衡量其藥品監(jiān)管機(jī)構(gòu)能力的體現(xiàn)。世界各國(guó)高度重視藥品標(biāo)準(zhǔn)的制定。目前,世界共有49個(gè)國(guó)際性、區(qū)域性及國(guó)家的藥典機(jī)構(gòu),遍布全球41個(gè)國(guó)家。世界衛(wèi)生組織(WHO)是唯一的國(guó)際性藥典機(jī)構(gòu)。
各國(guó)藥典標(biāo)準(zhǔn)制定機(jī)構(gòu)肩負(fù)著共同的責(zé)任,即科學(xué)地制定藥品質(zhì)量標(biāo)準(zhǔn)、保障藥品質(zhì)量的可控性,從而保障公眾用藥安全和可及性。2020年10月,WHO首次發(fā)布了《藥典標(biāo)準(zhǔn)對(duì)于獲得優(yōu)質(zhì)藥品的價(jià)值》(ValueofPharmacopoeialStandardsforAccesstoQualityMedicines,以下簡(jiǎn)稱《WHO白皮書》)[4],著重強(qiáng)調(diào)了藥典在保障藥品質(zhì)量以及為公眾提供優(yōu)質(zhì)價(jià)廉藥品所發(fā)揮的不可替代的作用。《WHO白皮書》中重申了藥典制定的核心目的是確保藥物及其成分安全有效和質(zhì)量可靠;在藥典內(nèi)容上,涵蓋了上市藥物在整個(gè)貨架期內(nèi)必須符合的技術(shù)規(guī)范;在藥典作用上,明確了藥典標(biāo)準(zhǔn)可作為質(zhì)量的基準(zhǔn),支持藥物的總體安全性,并對(duì)保護(hù)公共衛(wèi)生做出重要貢獻(xiàn)。WHO強(qiáng)調(diào)了藥典提供了對(duì)藥品及其成分質(zhì)量特性的業(yè)界共同理解,有助于簡(jiǎn)化制造商和監(jiān)管機(jī)構(gòu)之間的溝通,有利于各國(guó)藥品監(jiān)管機(jī)構(gòu)在標(biāo)準(zhǔn)合規(guī)方面達(dá)成一致看法,并促進(jìn)各國(guó)藥典之間的協(xié)調(diào)和趨同。藥典標(biāo)準(zhǔn)的制定秉承公開、公正、公平的原則,樹立了藥典標(biāo)準(zhǔn)的科學(xué)性和權(quán)威性,提升了公信度,被行業(yè)廣泛遵從。
隨著我國(guó)醫(yī)藥產(chǎn)業(yè)的飛速發(fā)展,我國(guó)藥品標(biāo)準(zhǔn)整體水平不斷提升,在國(guó)際上《中國(guó)藥典》日益受到廣泛關(guān)注,且國(guó)際影響力也日益增長(zhǎng),已步入世界先進(jìn)藥典行列(見圖1)。
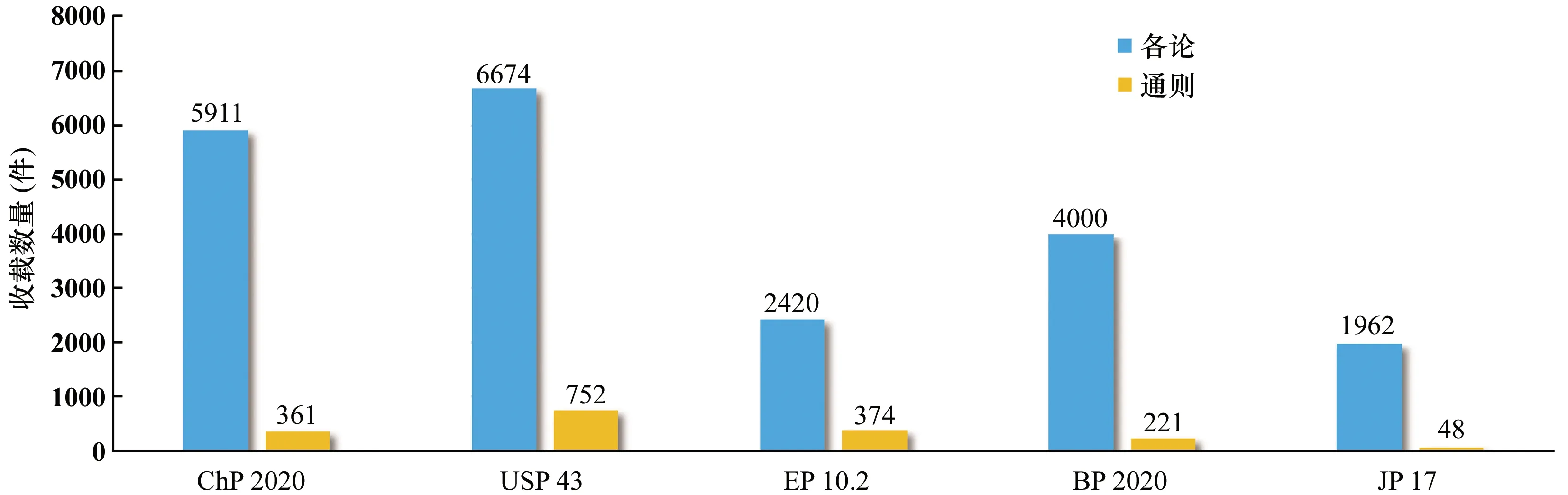
ChP:《中國(guó)藥典》;USP:《美國(guó)藥典》;EP:《歐洲藥典》;BP:《英國(guó)藥典》;JP:《日本藥局方》
3 《中國(guó)藥典》的特點(diǎn)
與《歐洲藥典》和《美國(guó)藥典》相比,《中國(guó)藥典》具有以下特點(diǎn):① 標(biāo)準(zhǔn)體系更為健全。《中國(guó)藥典》是國(guó)家藥品標(biāo)準(zhǔn)體系的核心,不但包涵了凡例、制劑通則、總論、檢驗(yàn)方法以及指導(dǎo)原則等通用性技術(shù)要求,收載標(biāo)準(zhǔn)涉及中藥、化學(xué)藥、生物制品、原料藥、藥用輔料、藥包材,是目前世界上收載藥品標(biāo)準(zhǔn)門類最齊全的藥典。② 中藥標(biāo)準(zhǔn)引領(lǐng)國(guó)際。中藥是我國(guó)傳統(tǒng)醫(yī)藥的瑰寶,《中國(guó)藥典》收載中藥標(biāo)準(zhǔn)涉及中藥材、中藥飲片、中藥提取物、中藥成方制劑等,品種齊全。在中藥質(zhì)量控制標(biāo)準(zhǔn)的長(zhǎng)期發(fā)展中,形成了較為完善的中藥質(zhì)量控制標(biāo)準(zhǔn)體系。無論是在中藥質(zhì)量控制理念、收載品種,還是在安全性、有效性控制研究和標(biāo)準(zhǔn)建立方面,《中國(guó)藥典》始終走在國(guó)際的前沿,并被WHO、歐盟及各國(guó)藥典所參考借鑒。③ 紙質(zhì)標(biāo)準(zhǔn)和數(shù)字標(biāo)準(zhǔn)相互依托。隨著先進(jìn)檢測(cè)技術(shù)在藥品質(zhì)量控制的推廣和應(yīng)用,《中國(guó)藥典》標(biāo)準(zhǔn)的形式也呈現(xiàn)多元化。除了傳統(tǒng)的紙質(zhì)標(biāo)準(zhǔn),作為標(biāo)準(zhǔn)的數(shù)字化表現(xiàn)形式,中藥的顯微鑒別、中藥薄層圖譜、中藥指紋圖譜、化學(xué)藥品鑒別紅外圖譜、核酸標(biāo)準(zhǔn)序列等數(shù)字化標(biāo)準(zhǔn)和數(shù)據(jù)庫(kù)也在不斷地建立和完善。藥品標(biāo)準(zhǔn)以數(shù)字化方式呈現(xiàn),與紙質(zhì)標(biāo)準(zhǔn)相互依托,成為《中國(guó)藥典》標(biāo)準(zhǔn)的重要組成部分。④ 完善的生物制品標(biāo)準(zhǔn)體系。由于生物制品管理模式的差異,《中國(guó)藥典》在生物制品標(biāo)準(zhǔn)體系建立和質(zhì)量控制標(biāo)準(zhǔn)制定比歐洲、美國(guó)、日本等國(guó)家藥典有著更大的優(yōu)勢(shì)。目前《中國(guó)藥典》收載的生物制品涵蓋了預(yù)防類產(chǎn)品(細(xì)菌性和病毒性疫苗)、治療類產(chǎn)品(人和動(dòng)物組織材料來源產(chǎn)品和重組生物技術(shù)產(chǎn)品)、單克隆抗體產(chǎn)品以及作為藥品管理的診斷試劑產(chǎn)品。《中國(guó)藥典》是目前世界上收載人用生物制品品種最齊全的藥典。針對(duì)不同種類生物制品,建立了相應(yīng)的通則、總論、通用檢測(cè)法和技術(shù)指南。隨著標(biāo)準(zhǔn)體系的日益健全,將不斷強(qiáng)化全過程、全生命周期的管理。
4 藥典標(biāo)準(zhǔn)體系建設(shè)
4.1 藥典標(biāo)準(zhǔn)體系建設(shè)的重要性
《中國(guó)藥典》之所以成為國(guó)家藥品標(biāo)準(zhǔn)體系的核心,是因?yàn)閲?guó)家藥品監(jiān)管機(jī)構(gòu)批準(zhǔn)的任何藥品標(biāo)準(zhǔn),都不能脫離《中國(guó)藥典》而獨(dú)立存在,都必須執(zhí)行并符合《中國(guó)藥典》相關(guān)通用性技術(shù)要求,包括凡例、通則(總論)以及檢驗(yàn)方法等(見圖2),是當(dāng)前我國(guó)已經(jīng)上市和研制申報(bào)藥品(不論國(guó)內(nèi)還是國(guó)外產(chǎn)品)都應(yīng)遵守的技術(shù)規(guī)范。
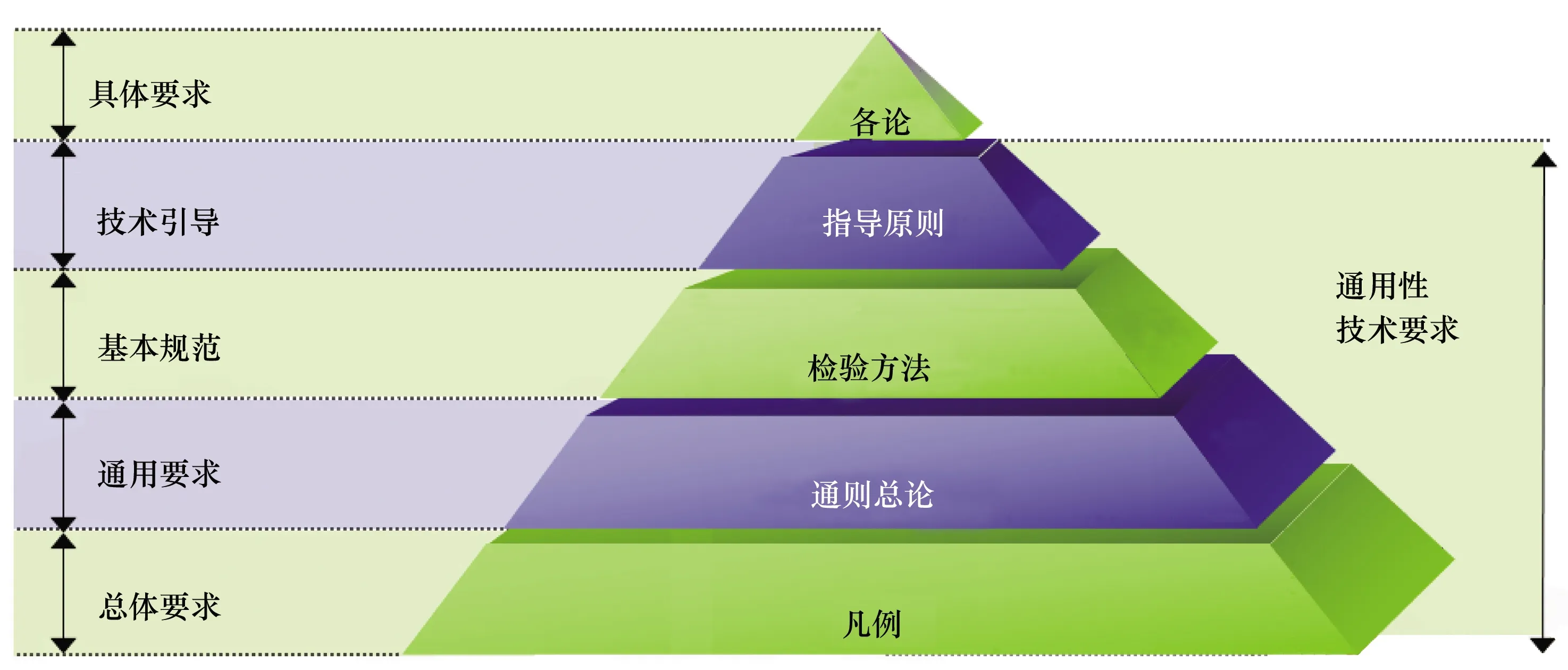
圖2 《中國(guó)藥典》結(jié)構(gòu)框架
4.2 藥典標(biāo)準(zhǔn)體系建設(shè)的要求
2020年版《中國(guó)藥典編制大綱》[5]的重點(diǎn)工作目標(biāo)是健全《中國(guó)藥典》標(biāo)準(zhǔn)體系,強(qiáng)化藥品質(zhì)量全程管理的理念。通過進(jìn)一步提高覆蓋中藥、化學(xué)藥、生物制品、原料藥、藥用輔料、藥包材以及標(biāo)準(zhǔn)物質(zhì)的質(zhì)量控制技術(shù)要求,進(jìn)一步完善藥典凡例、制劑通則、總論、檢驗(yàn)方法以及指導(dǎo)原則的制定和修訂。貫徹藥品質(zhì)量源于設(shè)計(jì),有賴于全過程控制保障的監(jiān)管理念,逐步完善涉及藥品研發(fā)、生產(chǎn)、檢驗(yàn)、流通和使用等環(huán)節(jié)的通用性技術(shù)要求的制定,全面推進(jìn)《中國(guó)藥典》標(biāo)準(zhǔn)體系建設(shè)。
4.3 貫徹生產(chǎn)全過程控制理念
① 建立生產(chǎn)全鏈條質(zhì)量控制體系。2020年版《中國(guó)藥典》通過對(duì)制劑通則(通則0100)的系統(tǒng)修訂,貫徹生產(chǎn)全過程控制理念。加強(qiáng)了對(duì)藥品生產(chǎn)原料藥、藥用輔料、藥包材、生產(chǎn)和制劑工藝、中間品和成品、包裝與使用、貯存與運(yùn)輸?shù)瓤刂埔螅诒WC終端產(chǎn)品質(zhì)量的同時(shí),將質(zhì)量控制由終端逐步向生產(chǎn)過程和源頭控制延伸,將風(fēng)險(xiǎn)控制點(diǎn)前移,進(jìn)一步降低生產(chǎn)過程可能引入的風(fēng)險(xiǎn),逐步形成以保障制劑質(zhì)量為目標(biāo)的原料藥、藥用輔料和藥包材標(biāo)準(zhǔn)體系,為實(shí)施原料藥、藥用輔料和藥包材關(guān)聯(lián)審評(píng)審批制度提供技術(shù)支撐。
② 基于風(fēng)險(xiǎn)分級(jí)控制。通過完善制劑質(zhì)量控制要求,建立基于風(fēng)險(xiǎn)防控的生產(chǎn)全過程控制要求,特別是對(duì)高風(fēng)險(xiǎn)制劑(如吸入制劑、注射劑及眼用制劑)。基于風(fēng)險(xiǎn)評(píng)估,制定原料藥、藥用輔料、藥包材相應(yīng)的安全控制項(xiàng)目和限度標(biāo)準(zhǔn),進(jìn)一步提升高風(fēng)險(xiǎn)藥品的安全性。
③ 保障產(chǎn)品質(zhì)量穩(wěn)定性。建立相應(yīng)的生產(chǎn)過程控制要求,完善質(zhì)量評(píng)價(jià)體系,制定合理的檢測(cè)限度,加強(qiáng)藥品批間一致性、穩(wěn)定性,減小批間差異,提高藥品質(zhì)量可控性。
4.4 藥典標(biāo)準(zhǔn)安全體系建設(shè)
4.4.1探索形成中藥安全標(biāo)準(zhǔn)控制體系
中藥安全性控制是中藥質(zhì)量控制的重點(diǎn),隨著對(duì)中藥質(zhì)量標(biāo)準(zhǔn)研究的不斷深入,結(jié)合臨床實(shí)際應(yīng)用,《中國(guó)藥典》中藥安全性控制體系正逐步地形成(見圖3)。
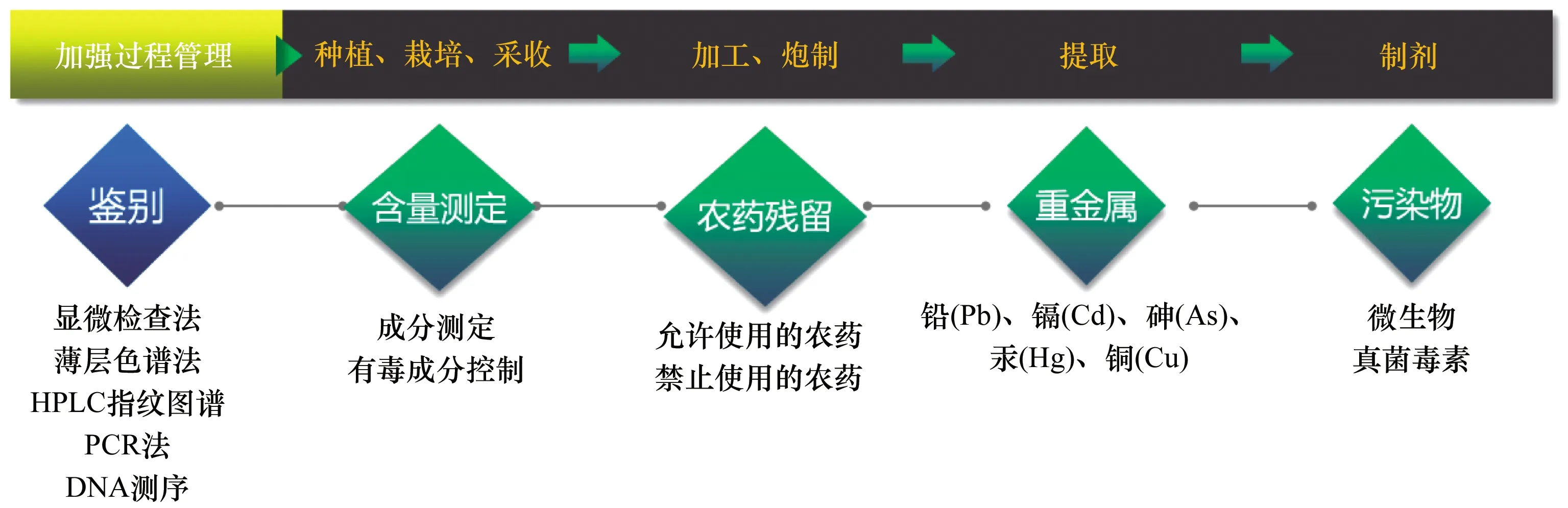
HPLC:高效液相色譜;PCR:聚合酶鏈反應(yīng)
① 完善中藥材與飲片鑒別檢查。2020年版《中國(guó)藥典》不斷加強(qiáng)中藥材與飲片鑒別的控制,既保證了中藥的有效性,也保障了其安全性。《中國(guó)藥典》在保留傳統(tǒng)的形態(tài)學(xué)和顯微檢查法的同時(shí),不斷將現(xiàn)代檢測(cè)技術(shù)應(yīng)用到中藥材與飲片的鑒別中,形成以形態(tài)學(xué)檢查、顯微檢查法、薄層色譜法、HPLC指紋圖譜、PCR法、DNA測(cè)序等中藥材與飲片多維度的鑒別檢查方法,以應(yīng)對(duì)當(dāng)前中藥材與飲片形式多樣化所面臨的摻偽、摻假等諸多問題。
② 有害污染物控制。中藥材與飲片的安全性面臨的最大挑戰(zhàn),是內(nèi)源性有毒成分和外源性有毒有害物質(zhì)的污染。內(nèi)源性安全考慮主要針對(duì)中藥自身含有的毒性成分(如生物堿類、苷類、萜類、金屬元素類等);外源性污染主要涉及重金屬及有毒有害元素、農(nóng)藥殘留,特別是有機(jī)氯類農(nóng)藥,此類物質(zhì)可在人體內(nèi)累積,對(duì)人體的正常功能造成傷害。中藥材與飲片微生物污染問題也不容忽視,其可能存在大量致病菌和某些真菌毒素,給臨床使用帶來安全性問題。近年來,隨著對(duì)中藥安全控制的重視程度越來越高,對(duì)有毒藥材有毒成分控制,中藥材與飲片農(nóng)藥殘留、植物生長(zhǎng)激素、重金屬及有害元素的控制,以及易霉變中藥材與飲片真菌毒素的控制等,已成為中藥安全控制的重中之重。
③ 加強(qiáng)生產(chǎn)全過程管理。由于中藥制備材料來源多樣、制備工藝各異、成分復(fù)雜多變,給中藥安全性控制帶來了極大挑戰(zhàn)。終端產(chǎn)品控制遠(yuǎn)不能保證中藥安全控制的需要,只有逐步實(shí)施生產(chǎn)全過程控制,加強(qiáng)中藥材種植、栽培和采收管理,規(guī)范中藥飲片炮制規(guī)范,才能最大程度地降低中藥安全性風(fēng)險(xiǎn)。因此,將過程管理納入中藥安全控制體系,是中藥安全性的重要保障,這也將成為中藥標(biāo)準(zhǔn)的重要組成部分。
4.4.2不斷完善化學(xué)藥品安全控制體系
化學(xué)藥品安全控制體系主要涉及化學(xué)活性成分的鑒別檢查,有關(guān)物質(zhì)(聚合體、降解產(chǎn)物等)、殘留溶劑、元素雜質(zhì)、基因毒性雜質(zhì)控制、無菌制劑的無菌檢查和非無菌產(chǎn)品的微生物限度控制要求等。對(duì)于高風(fēng)險(xiǎn)制劑中,注射劑及眼用制劑的抑菌劑、抗氧劑,注射劑中非水溶劑,靜脈輸液及滴眼液的滲透壓控制等,也是保證制劑安全設(shè)定的控制項(xiàng)目(見圖4)。
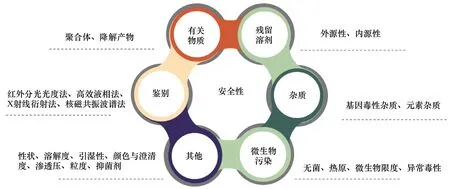
圖4 化學(xué)藥品安全控制標(biāo)準(zhǔn)體系
4.4.3不斷強(qiáng)化生物制品安全控制標(biāo)準(zhǔn)體系
生物制品安全控制貫穿生產(chǎn)全過程,對(duì)生物制品生產(chǎn)用起始材料,如菌毒種、生產(chǎn)用細(xì)胞基質(zhì)、人或動(dòng)物來源組織材料的使用、重組制品生產(chǎn)用工程細(xì)胞的控制等方面,都建立了嚴(yán)格的控制措施。不斷強(qiáng)化生產(chǎn)過程的控制和風(fēng)險(xiǎn)防控,強(qiáng)化病毒安全控制要求,加強(qiáng)對(duì)動(dòng)物來源材料的安全控制,嚴(yán)格對(duì)內(nèi)源性和外源性污染因子的控制,規(guī)范病毒滅活/去除工藝的驗(yàn)證,以保證病毒滅活工藝的可靠性和穩(wěn)定性。同時(shí),加強(qiáng)對(duì)生產(chǎn)中引入的殘留溶劑和制品中雜質(zhì)的控制方法的建立,以及限度標(biāo)準(zhǔn)的制定如宿主細(xì)胞蛋白(HCP)、宿主細(xì)胞DNA殘留檢測(cè)等,以進(jìn)一步提高產(chǎn)品臨床使用的安全性。
4.4.4逐步彌補(bǔ)藥用輔料標(biāo)準(zhǔn)體系的空白
隨著《總局關(guān)于調(diào)整原料藥、藥用輔料和藥包材審評(píng)審批事項(xiàng)的公告》(2017年第146號(hào))[6]的實(shí)施,加強(qiáng)了《中國(guó)藥典》中藥用輔料標(biāo)準(zhǔn)的制修訂,逐步形成了藥用輔料標(biāo)準(zhǔn)體系(見圖5)。
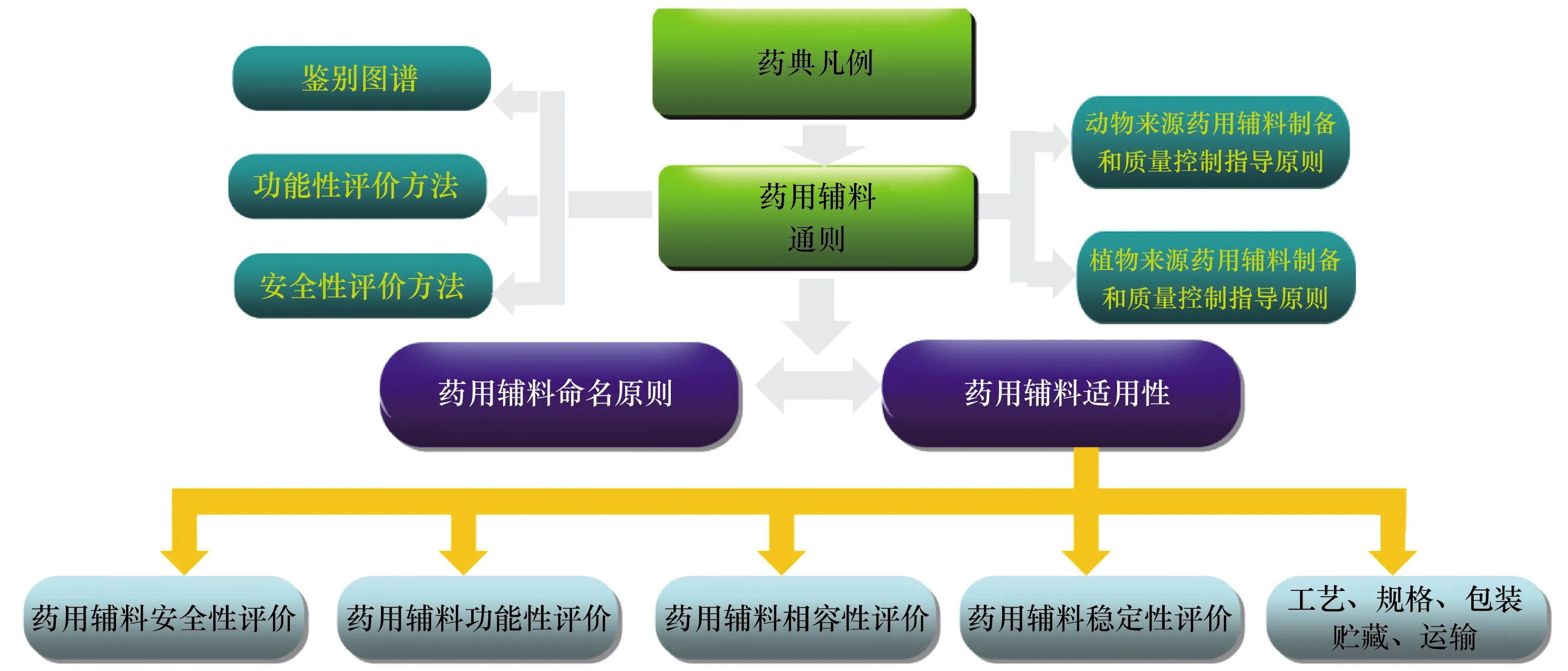
圖5 藥用輔料標(biāo)準(zhǔn)體系
藥用輔料安全性體現(xiàn)在輔料本身的安全性,以及與原料藥、輔料、藥包材之間的相容性評(píng)價(jià)。藥用輔料標(biāo)準(zhǔn)體系建設(shè)的重點(diǎn)是:① 基于給藥途徑,對(duì)藥用輔料實(shí)施分級(jí)管理,對(duì)高風(fēng)險(xiǎn)制劑(注射劑、吸入制劑、眼用制劑等)藥用輔料實(shí)施更為嚴(yán)格的控制要求。② 加強(qiáng)藥用輔料安全性評(píng)價(jià),特別是對(duì)新輔料、新用途輔料(如由低風(fēng)險(xiǎn)改為高風(fēng)險(xiǎn)給藥途徑等情況)進(jìn)行安全性評(píng)估,保證輔料的使用安全;對(duì)于動(dòng)物來源藥用輔料,加強(qiáng)生物安全控制,避免外源因子的引入,同時(shí)嚴(yán)格藥用輔料中存在安全風(fēng)險(xiǎn)雜質(zhì)的控制。③ 完善藥用輔料功能性評(píng)價(jià),根據(jù)輔料的功能性不同進(jìn)行規(guī)格細(xì)分,指導(dǎo)藥品研發(fā)機(jī)構(gòu)開展藥用輔料適用性研究,規(guī)范制劑生產(chǎn)藥用輔料的選擇(見表1)。

表1 《中國(guó)藥典》藥用輔料功能性評(píng)價(jià)指標(biāo)
4.5 搭建藥包材標(biāo)準(zhǔn)體系框架
基于應(yīng)用制劑風(fēng)險(xiǎn)的等級(jí),對(duì)藥包材實(shí)施分級(jí)管理,尤其加強(qiáng)對(duì)應(yīng)用于高風(fēng)險(xiǎn)制劑的藥包材的管控。根據(jù)藥包材的材質(zhì),制定玻璃、彈性體、塑料類材料的通用性技術(shù)要求;根據(jù)包裝類型,制定相關(guān)類型的包裝容器通則,包括玻璃瓶、輸液瓶、輸液袋、藥用瓶、預(yù)灌封注射器等。初步搭建起藥包材質(zhì)量控制體系(見圖6)。
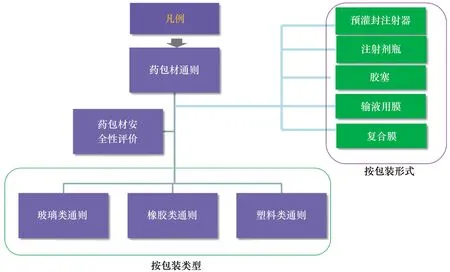
圖6 藥包材標(biāo)準(zhǔn)體系
5 整體提升藥品安全性
2020年版《中國(guó)藥典》對(duì)藥品安全控制的要求明顯加強(qiáng),通過整體提升藥品安全性控制、推動(dòng)藥品生產(chǎn)工藝升級(jí)改造、淘汰落后產(chǎn)品、加快產(chǎn)品更新?lián)Q代,進(jìn)一步保障了藥品臨床使用安全。近幾版《中國(guó)藥典》提升了藥品安全性控制要求(見表2)。
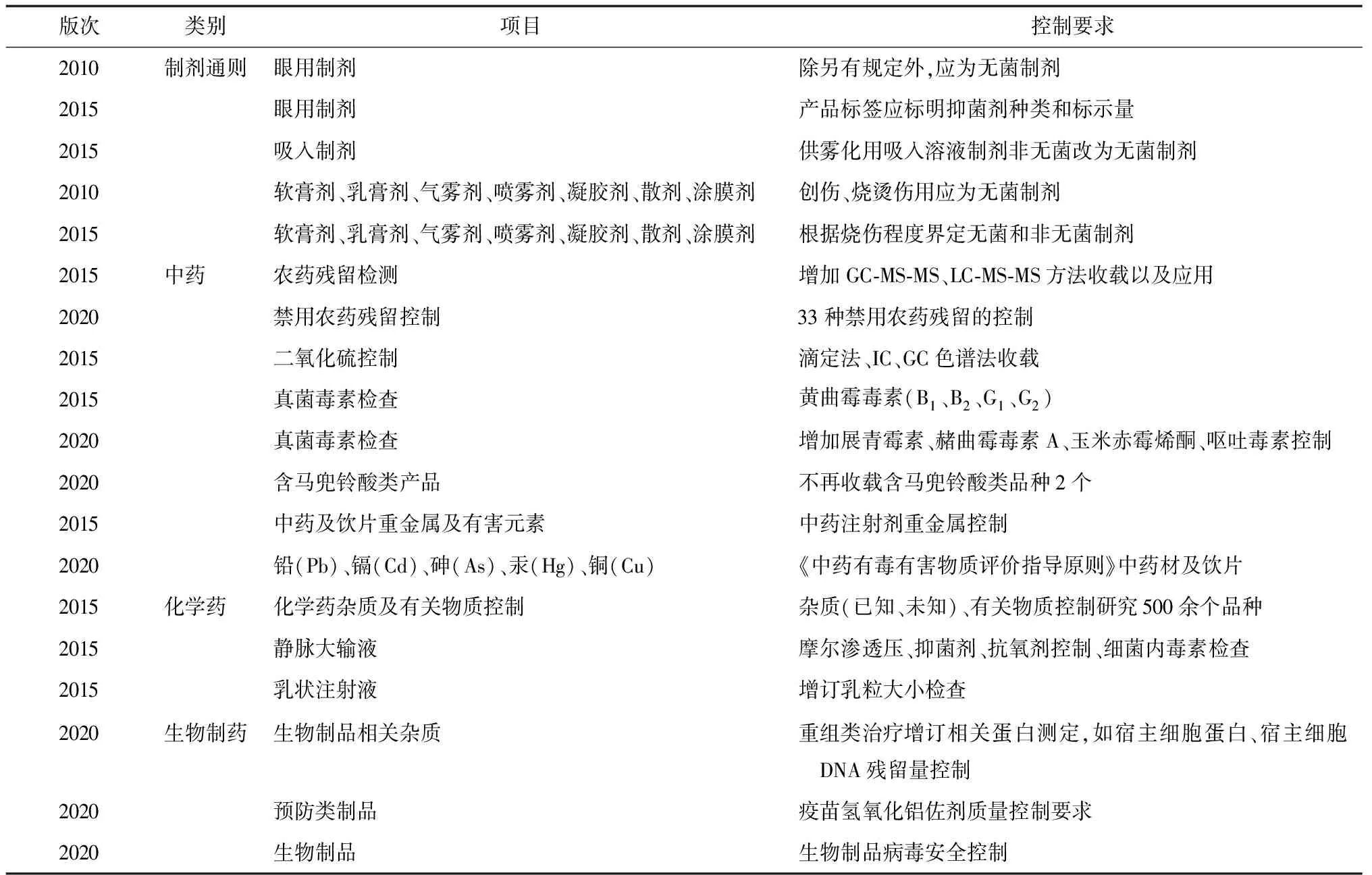
表2 《中國(guó)藥典》藥品安全性控制要求的提升
6 檢驗(yàn)技術(shù)在藥品安全性控制的應(yīng)用
檢測(cè)技術(shù)的應(yīng)用和方法的建立,是實(shí)施藥品安全性控制的基礎(chǔ)。《中國(guó)藥典》不斷將先進(jìn)、成熟的檢測(cè)技術(shù)應(yīng)用到藥品檢驗(yàn)中,特別是針對(duì)藥品安全性的控制。① 擴(kuò)大了HPLC、GC在藥品安全控制項(xiàng)目上的應(yīng)用,如在藥品鑒別檢查、含量測(cè)定、有關(guān)物質(zhì)檢查項(xiàng)等(見圖7);② 為進(jìn)一步提高檢測(cè)能力,近年來在MS、HPLC-MS、LC-MS-MS/GC-MS-MS的應(yīng)用呈明顯上升趨勢(shì)(見圖8)。如中藥材及飲片二氧化硫殘留量測(cè)定建立了IC和GC法,以進(jìn)一步提高二氧化硫檢測(cè)的靈敏度,原采用GC只能檢測(cè)22種農(nóng)藥殘留,現(xiàn)采用GC-MS-MS法,可將檢測(cè)能力擴(kuò)大到600余種;③ 加強(qiáng)檢測(cè)技術(shù)儲(chǔ)備,建立了中藥材DNA條形碼分子鑒別、色素測(cè)定法、中藥中真菌毒素測(cè)定法、中藥有害殘留物限量制定等指導(dǎo)原則。酶聯(lián)免疫吸附測(cè)定(ELISA)法作為一種快速、簡(jiǎn)便、高通量的免疫學(xué)檢測(cè)技術(shù),日益用于真菌毒素的檢測(cè)。
圖7 HPLC在藥典中的應(yīng)用情況
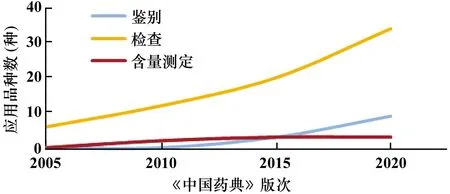
圖8 MS、HPLC-MS、LC-MS-MS、GC-MS-MS在藥典質(zhì)控中的應(yīng)用
7 結(jié)語
隨著“提高國(guó)家藥品標(biāo)準(zhǔn)行動(dòng)計(jì)劃”的實(shí)施,我國(guó)藥品標(biāo)準(zhǔn)的整體水平邁上了一個(gè)新臺(tái)階,藥品質(zhì)量有了極大的提升,對(duì)推動(dòng)我國(guó)醫(yī)藥產(chǎn)業(yè)整體水平的提高,發(fā)揮了至關(guān)重要的作用。《中國(guó)藥典》為公眾用藥安全構(gòu)筑起了一道堅(jiān)實(shí)可靠的“防護(hù)墻”,為支撐藥品監(jiān)管建立起了一條科學(xué)規(guī)范的“基準(zhǔn)線”,為促進(jìn)我國(guó)醫(yī)藥產(chǎn)業(yè)又好又快地發(fā)展提供了一個(gè)精確靈敏的“導(dǎo)航儀”。保障臨床用藥安全是藥典標(biāo)準(zhǔn)制修訂的根本目標(biāo)。全面落實(shí)“建立最嚴(yán)謹(jǐn)?shù)臉?biāo)準(zhǔn)”要求,堅(jiān)持以臨床為導(dǎo)向、防范系統(tǒng)風(fēng)險(xiǎn)、守住藥品安全底線、不斷完善國(guó)家藥品標(biāo)準(zhǔn)、促進(jìn)我國(guó)制藥產(chǎn)業(yè)高質(zhì)量發(fā)展,將是今后《中國(guó)藥典》標(biāo)準(zhǔn)制修訂的工作方向。

