新冠肺炎疫情下產生氣溶膠的醫療操作
黃文治,趙海鳴,付學勤,喬 甫,尹維佳,宗志勇,張 偉
(1. 四川大學華西醫院醫院感染管理部,四川 成都 610041; 2. 成都市第一人民醫院院感科,四川 成都 610016; 3. 四川大學華西醫院醫院管理研究所,四川 成都 610041)
目前,新型冠狀病毒肺炎(coronavirus disease 2019, COVID-19)在我國已引起八萬余人感染,四千余人死亡[1]。根據中國疾病預防控制中心報告[2],其中醫務人員感染人數已超過三千人。COVID-19主要傳播途徑是經呼吸道飛沫和密切接觸傳播,也存在經氣溶膠傳播的可能。《國家衛生健康委辦公廳關于加強疫情期間醫用防護用品管理工作的通知》(國衛辦醫函〔2020〕98 號)[3]以及《新型冠狀病毒感染的肺炎防控中常見醫用防護用品使用范圍指引(試行)》[4]指出,醫用防護口罩“原則上在發熱門診、隔離留觀病區(房)、隔離病區(房)和隔離重癥監護病區(房)等區域,以及進行呼吸道標本采集、氣管插管、氣管切開、無創通氣、吸痰等可能產生氣溶膠的操作時使用”。但產生氣溶膠操作的定義、種類以及風險性的高低,并未明確提及。對呼吸道病毒包括新型冠狀病毒(SARS-CoV-2)感染患者進行某些特定的醫療操作時,會形成氣溶膠,這些氣溶膠的重量較輕足以在空氣中遠距離播散。但在醫療環境中,這些操作在多大程度上導致了感染的傳播尚不清楚。同時世界各國家或機構發布的相關指南中,對與COVID-19相關的產生氣溶膠的操作(aerosol-generating procedures, AGPs)進行了界定,但內容不盡相同。為此,本文根據國內外相關指南及文獻,對氣溶膠、AGPs、高風險的醫療操作以及減少感染風險的策略進行文獻綜述。
1 氣溶膠及AGPs
氣溶膠是指懸浮在氣體中的顆粒,包括固體顆粒物和液體顆粒物,其粒徑介于0.001~100 μm之間[5-6]。而生物氣溶膠是指含有微生物和生物性物質的物質粒子,與氣體介質組成的物質體系。這些粒子包括病毒、細菌、真菌、苔蘚、酶、各種毒素等,可聚合在一起形成氣溶膠,或以液體或固體顆粒為載體懸浮在氣體中[7]。空氣動力學直徑<5~10 μm的小顆粒可以長時間懸浮在空氣中,具有潛在的短距離和長距離傳播能力。空氣動力學直徑>20 μm的大飛沫則更容易在重力作用下沉降,直徑為10~20 μm的顆粒可兼有前兩者一些特性,沉降速度及可能攜帶的病原體量可介于兩者之間[5]。氣溶膠也包括飛沫核,是呼出的呼吸道飛沫中水分在空氣中快速蒸發之后形成的,這類小顆粒空氣動力學直徑<10 μm,也有研究認為<5 μm[8]。
空氣氣流在液體表面移動時在氣液界面處產生小顆粒,從而形成氣溶膠,其粒徑的大小與空氣流速成反比。因此,如果某個操作或動作(包括說話、唱歌等)導致空氣在呼吸道黏膜及上皮細胞移動,即可能產生氣溶膠。在醫院內 AGPs被定義為可誘導產生各種大小的氣溶膠(包括飛沫核)的醫療操作[9],但目前各相關指南及文獻仍未明確界定AGPs具體包括哪些,根據世界衛生組織(WHO)對于AGPs的定義整理AGPs,見表1。
AGPs種類非常多樣,以上列舉仍可能不夠全面,總體而言可將其分為兩大類,即誘導性AGPs和機械性AGPs。誘導性AGPs指相應操作能夠激惹氣道,引起患者咳嗽或噴嚏,從而產生生物氣溶膠,如支氣管鏡檢查、心肺復蘇、氣管插管、誘導痰等;而機械性AGPs指通過操作使氣道產生氣溶膠,如吸痰、霧化治療、無創通氣、高流量經鼻給氧等。

表1 根據WHO對于AGPs的定義整理的AGPs
2 產生氣溶膠的高風險操作
如每一種AGPs都要求佩戴醫用防護口罩必然會加劇供需矛盾,影響醫用防護口罩的有效利用。而且并不是每一種操作都會增加醫務人員感染的風險,故有必要對這些AGPs的風險進行分級,如進行增加感染風險的操作則建議采用更高級別的防護(如佩戴醫用防護口罩)。
關于AGPs是否增加醫務人員感染風險的文獻,主要集中在對嚴重急性呼吸綜合征冠狀病毒(SARS-CoV)的研究。Tran等[10]對可能產生氣溶膠的操作,以及是否增加醫務人員感染SARS-CoV的風險進行了系統綜述,見表2。納入的文獻中有8篇都涉及氣管插管操作,且各文獻的報道結果類似,醫務人員插管過程中距離患者口腔近,操作時間長,患者呼吸道分泌物噴濺可能性大,氣管插管導致醫務人員感染SARS-CoV的風險增加,此較為明確。其他導致感染風險增加的操作包括無創機械通氣、氣管切開以及插管前人工通氣(P<0.05),雖然這些AGPs報道的文獻僅1~2篇,但這三類操作可能會加大呼吸氣道的壓力,使呼吸道分泌物形成的氣溶膠以更快的速度和更小的空氣動力學直徑噴射,再加上這些操作的管路或面罩等與患者之間形成的是非密閉回路,較大量的微小氣溶膠溢散到空氣中,從而增加醫務人員感染SARS-CoV的風險,需給予高度的關注。其余AGPs均未明顯增加感染SARS-CoV的風險(P>0.05)。各個國家/機構指南或規范中對COVID-19 高風險AGPs的界定有所差異,見表3。
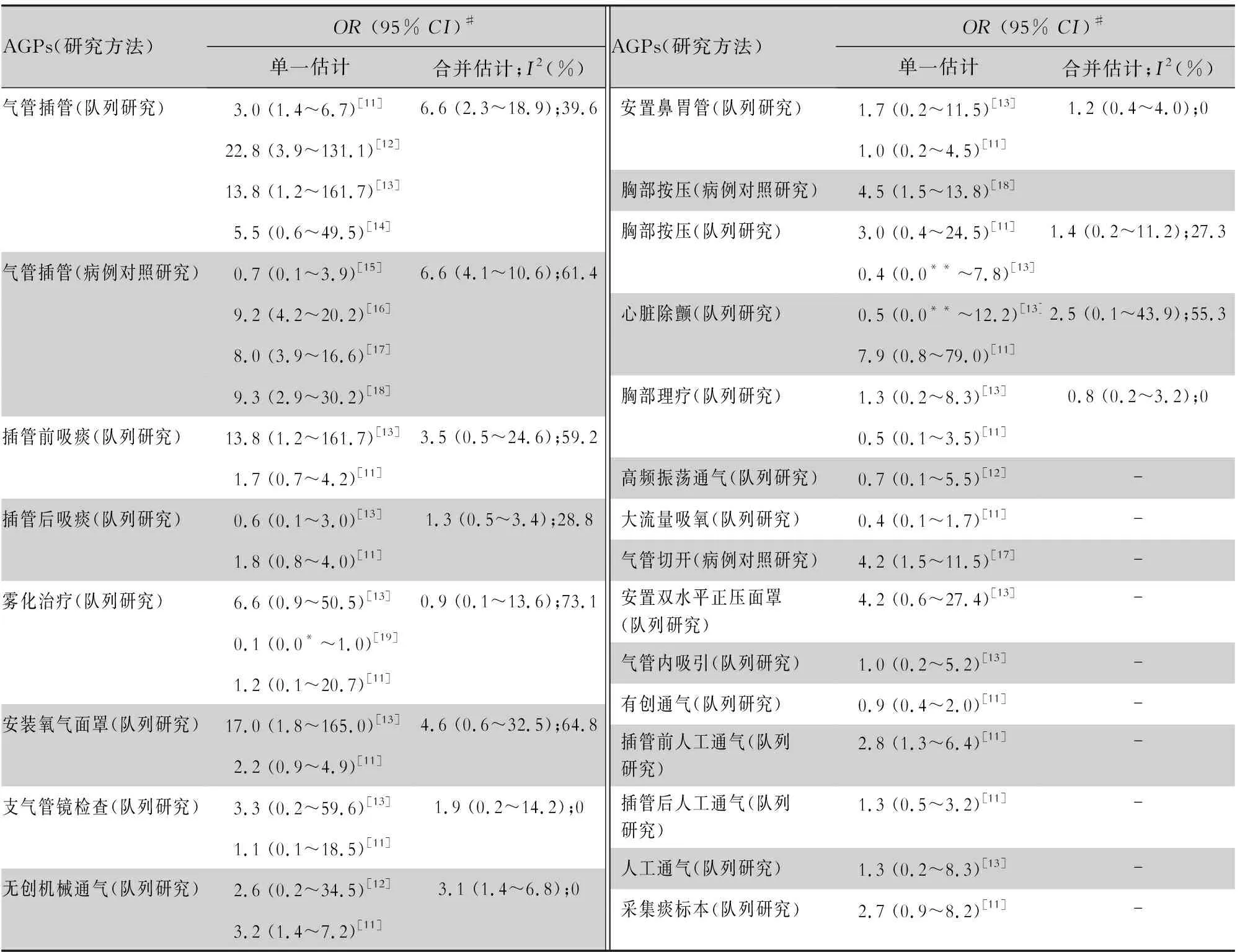
表2 AGPs對醫務人員感染SARS-CoV風險的影響
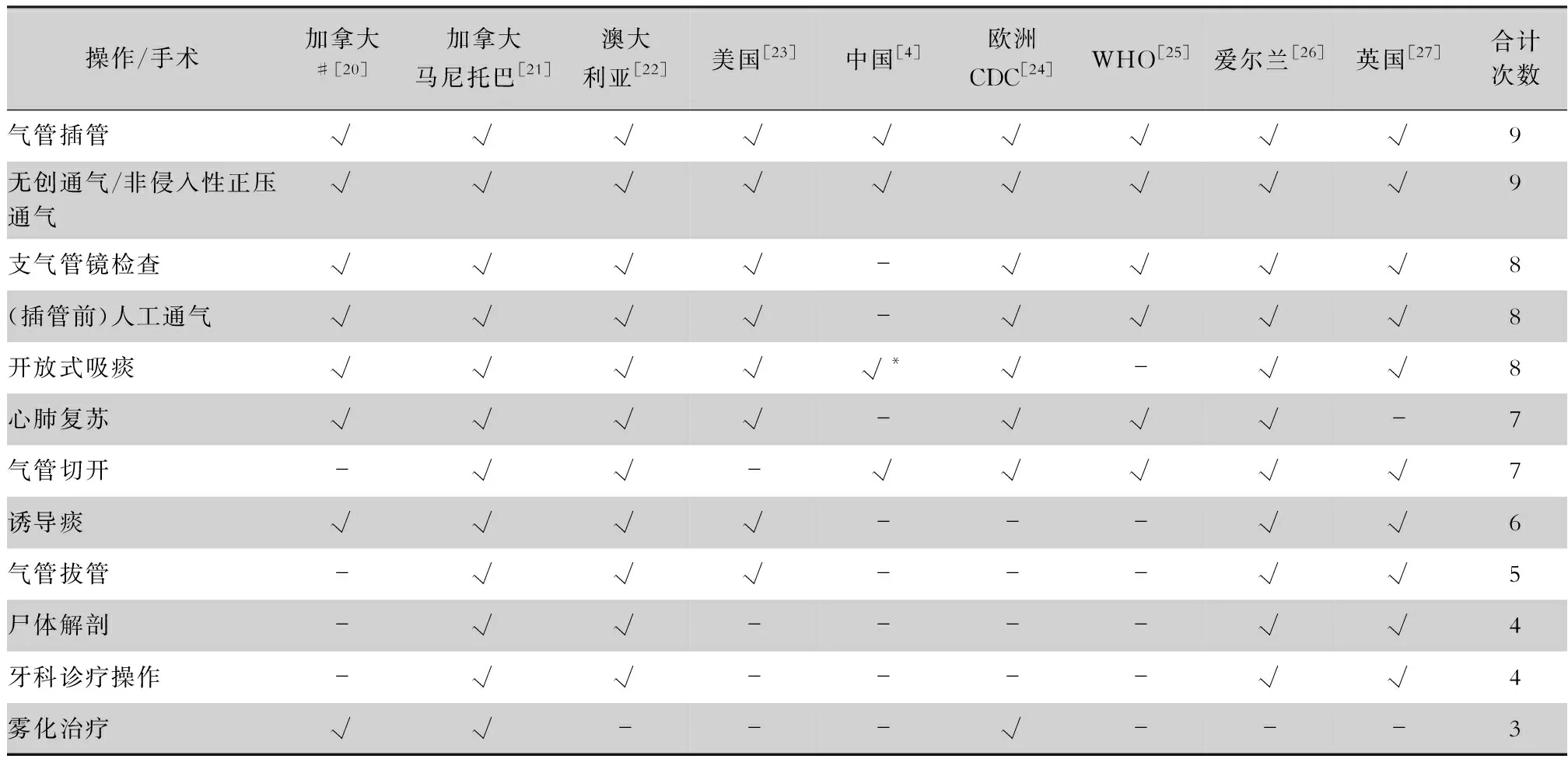
表3 全球主要國家/機構相關指南中COVID-19高風險AGPs概覽
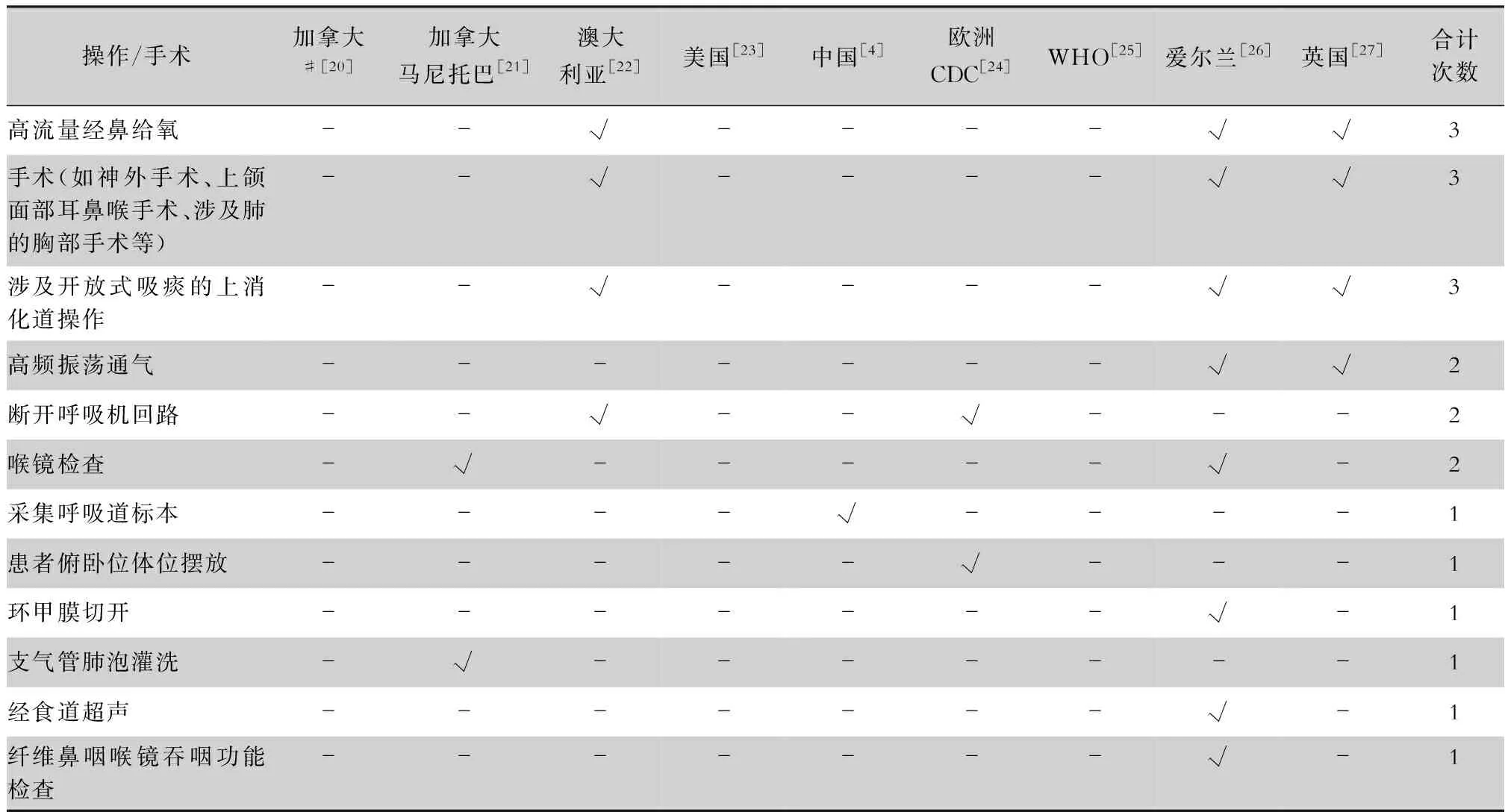
續表3 (Table 3, Continued)
2.1 氣管插管 所有國家/機構相關指南均認為氣管插管屬于高風險AGPs,與Tran等[10]系統綜述結果相一致。
2.2 支氣管鏡檢查 支氣管鏡檢查被絕大多數國家/機構相關指南認為是高風險AGPs,但文獻報道的證據支持不足,表2中兩篇分析性研究的結果都認為支氣管鏡檢查不增加SARS-CoV感染的風險[11-13];一篇描述性研究在摘要中提到在支氣管鏡檢查后更可能醫院感染SARS-CoV,但在正文中并未詳細提及相關內容[28];另有一篇關于流感的研究,在支氣管鏡檢查時采集空氣檢測,結果顯示與基線(無AGPs)相比,支氣管鏡檢查能增加空氣中的病毒量,但與基線相比差異無統計學意義[29]。
各國家/機構相關指南普遍認為支氣管鏡檢查風險高,且前述關于流感的研究提示該操作的確能產生氣溶膠,但其是否增加感染風險卻在文獻報道中未找到足夠的證據支持,可能是由于其前端有吸引孔,可將呼吸道分泌物經由密閉管道抽吸出來,較大程度地減少了氣溶膠的量,從而降低了感染風險。
2.3 心肺復蘇 心肺復蘇增加感染風險也被廣泛接受,而表2中相關研究均未呈現統計學差異,僅搜到一篇描述性的病例報道,醫務人員在對重癥急性呼吸綜合征(SARS)患者進行心肺復蘇后發生了聚集性感染,但除心肺復蘇外還有氣管插管等其他操作[30]。因此,支氣管鏡檢查、心肺復蘇等AGPs與氣管插管一起進行時,可能會較大程度增加SARS-CoV感染的風險。
2.4 無創通氣 雖無創通氣在各國相關指南中僅澳大利亞、中國和WHO認為是高風險AGPs,但在Tran等[10]系統綜述中有證據支持,其原因主要是各國家/機構相關指南對無創通氣的具體劃分不同,非侵入性正壓通氣包括雙水平正壓通氣(BiPAP)和持續氣道正壓通氣(CPAP)也屬于無創通氣,若將無創通氣與非侵入性正壓通氣合并統計則在各國家/機構相關指南中出現的次數達8次。
2.5 開放式吸痰 根據Tran等[10]系統綜述,吸痰不會增加SARS-CoV感染的風險,但未明確指出是采用開放式吸痰還是密閉式吸痰。開放式吸痰能產生大量氣溶膠且逸散到空氣中,筆者認為風險較高。
2.6 霧化治療 尚未找到文獻支持,且各個國家/機構相關指南的意見也有差異,如澳大利亞未將霧化治療納入高風險AGPs,也不建議對COVID-19患者采用霧化治療;英國和愛爾蘭明確指出該操作可能產生氣溶膠,但不增加SARS-CoV-2感染風險。
2.7 采集呼吸道標本 呼吸道標本采集在各國間的差異較為明顯,僅中國指南將采集咽拭子作為高風險AGPs。澳大利亞指南明確指出采集上呼吸道標本的操作不屬于AGPs,愛爾蘭指南認為該操作不會增加SARS-CoV-2感染風險,美國指南及歐洲CDC的高風險AGPs未提及采集咽拭子,但指出該操作可以引發咳嗽/噴嚏,可能產生氣溶膠,建議戴外科口罩或醫用防護口罩。而英國也對其指南進行修訂,將采集咽拭子從“不增加感染風險的AGPs”中剔除,建議佩戴外科口罩。
采集咽拭子是否能增加SARS-CoV-2感染的風險并未見文獻提及,僅有一篇研究提到采集痰標本不會增加感染風險。筆者認為該操作根據WHO的定義應屬于AGPs,但其引起感染的風險較低。首先采集咽拭子是上呼吸道的操作,并沒有明顯增加氣道壓力,使得氣流快速通過呼吸氣道;其次,采集時間僅持續數秒,醫務人員可能的暴露時間非常短;最后,采集時可能引起患者干嘔或咳嗽,有研究顯示咳嗽時產生的氣溶膠有99.9%都是由空氣動力學直徑超過8 μm的粒子組成[31-32],這些粒子很快會沉降到地面,對于粒徑較大的氣溶膠醫用外科口罩也能起到有效防護。筆者在醫務人員對COVID-19確診患者采集咽拭子時近距離進行空氣采樣,經SARS-CoV-2核酸檢測結果均為陰性,也提示采集咽拭子的感染風險較低(待發表)。
3 醫用防護口罩和醫用外科口罩
各個國家/機構指南均建議對于感染高風險的AGPs使用醫用防護口罩,而我國指南規定采集呼吸道標本屬于AGPs,需要佩戴醫用防護口罩,本院在COVID-19防控中的具體實踐表明,各臨床科室大都涉及為患者采集咽拭子進行COVID-19排查,造成醫用防護口罩消耗極大,在物資緊缺的情況下是否適宜仍需要更多相關研究進一步證實。同時筆者也根據國家標準和行業標準將醫用防護口罩和醫用外科口罩進行了對比(見表4),可知兩者的主要差異在于顆粒過濾效率、密閉性以及防滲性(醫用外科口罩優于醫用防護口罩)。
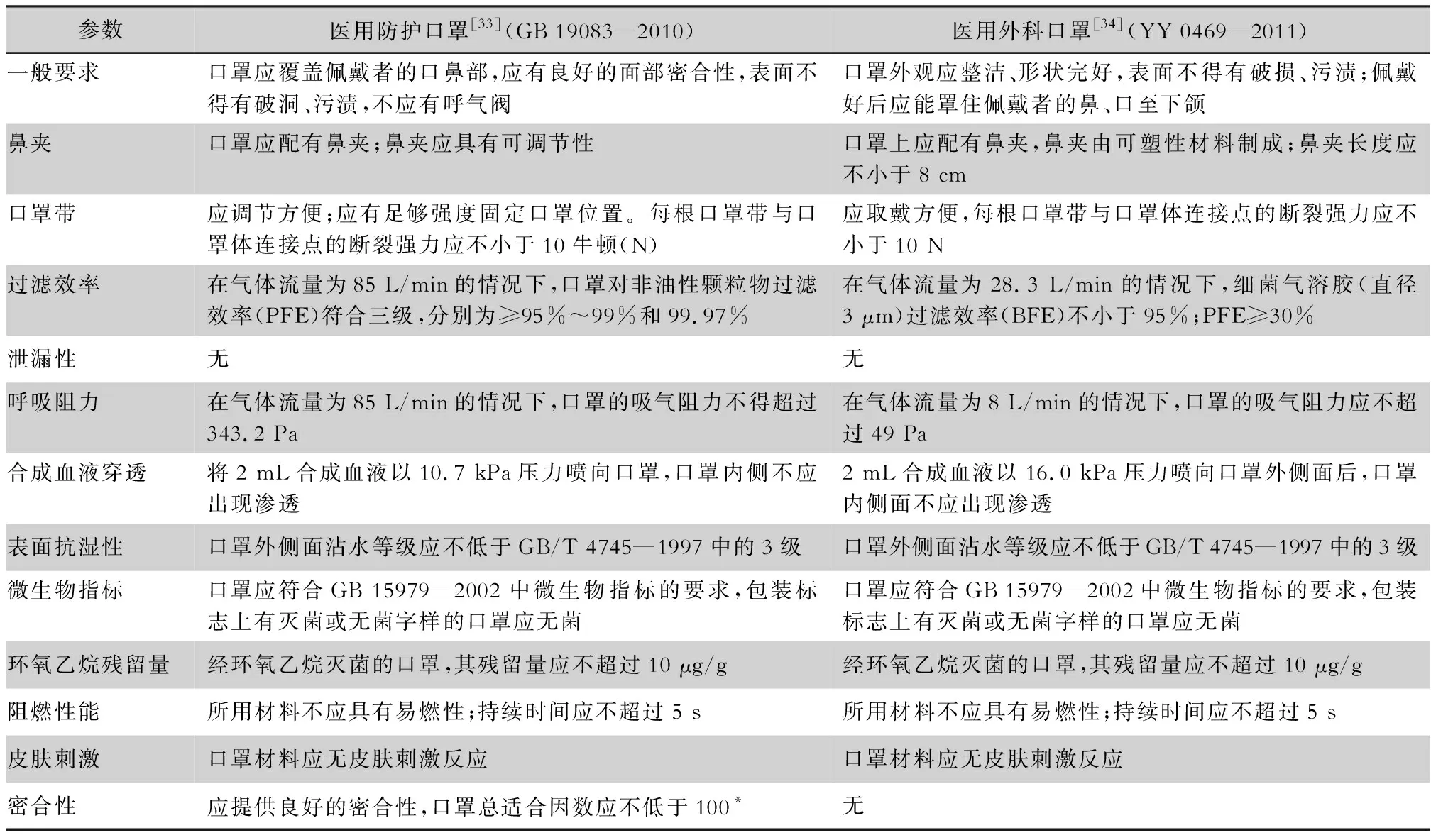
表4 醫用防護口罩和醫用外科口罩的參數對比
一般認為醫用防護口罩能提供更好的個人防護,但一項關于流感的隨機對照試驗(RCT)及系統綜述結果顯示,在預防流感方面醫用防護口罩并不優于醫用外科口罩,醫用外科口罩能達到足夠的防護效果[35-39]。其中一篇發表于JAMA的RCT研究[35],將護士隨機分配到醫用防護口罩組和醫用外科口罩組(除了結核病患者外所有AGPs均佩戴醫用外科口罩),結果顯示對于預防護士新發流感的效果兩組間未發現有差異(22.9% VS 23.6%,P=0.86)。另一篇樣本量更大的RCT[36]將醫務人員隨機分為三組,分別為工作時佩戴醫用防護口罩組、佩戴醫用外科口罩組和條件性佩戴醫用防護口罩組(如護理呼吸道疾病患者或AGPS時佩戴,其余時刻佩戴醫用外科口罩),結果顯示對于預防呼吸道病毒,佩戴醫用外科口罩組與條件性佩戴醫用防護口罩組、佩戴醫用防護口罩組分別相比差異均無統計學意義(3.3% VS 3.3%,P=0.99; 3.3% VS 2.2%,P=0.44)。
4 其他減少AGPs感染風險的策略
除佩戴醫用防護口罩外,其他減少AGPs感染風險的策略主要包括以下幾點:(1)避免不必要的AGPs,考慮是否有其他操作可以替代;(2)個人防護用品除醫用防護口罩外,還需穿戴長袖防水隔離衣、防護面屏或護目鏡、手套,并做好手衛生;(3)根據情況,適宜時對患者進行鎮靜處理;(4)在負壓隔離房間內進行AGPs,如無或條件不允許則在單間操作,操作時需關閉門窗,限制醫務人員數在最低水平,并在門口懸掛標識提醒其他醫務人員;(5)盡可能使用密閉式氣管內吸引系統。
5 展望
對于AGPs仍需要更為確切明晰的定義。增加醫務人員感染風險的AGPs相關文獻都集中在對SARS的研究上,且經過GRADE分級均為極低證據質量,COVID-19相關的AGPs有待更多的研究驗證。
目前,尚未找到文獻支持在AGPs中使用醫用防護口罩預防醫務人員呼吸道病毒感染的效果優于使用醫用外科口罩,醫用防護口罩與醫用外科口罩效果的差異仍需更多的文獻報道支持。

