抓住元素化合物“來龍去脈”,提升學科核心素養
2020-09-10 07:22:44莫美聰
新教育論壇
2020年4期
關鍵詞:核心素養
莫美聰
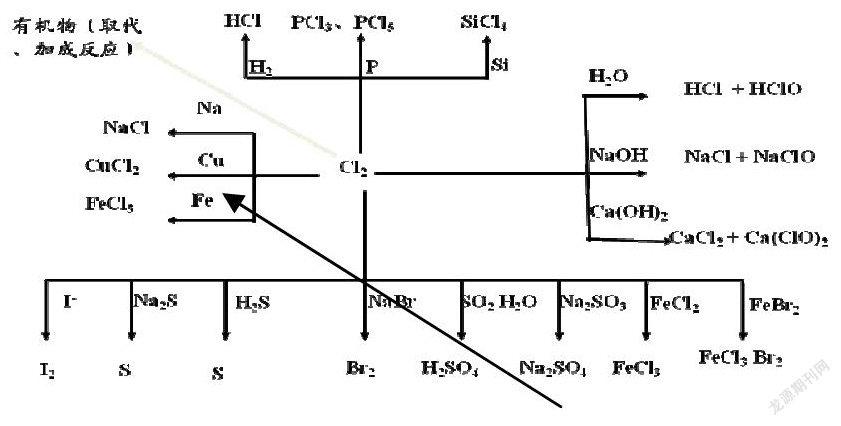

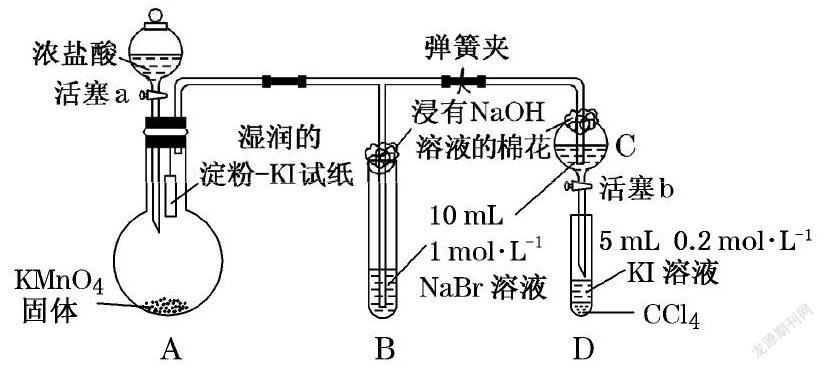
摘要:以“鹵素單質----氯氣”教學為例,通過氯氣的“來龍去脈”落實核心素養要求,達到提升學生學科核心素養的目的。
關鍵詞:核心素養;氯氣“來龍去脈”
高中化學核心素養包括宏觀辨識與微觀探析、變化觀念與平衡思想、證據推理與模型認知、科學探究與創新意識、科學精神與社會責任等,是學生接受相應學段的教育過程中逐步形成的適應個人終生發展和社會發展需要的必備品格和關鍵能力[1]。
氯氣的制備和性質是元素化合物中的重要內容,對于培養學生的學科核心素養典型性強。本文圍繞“鹵族元素——氯氣”的“來龍去脈”培養學生學科核心素養。
一、研讀考綱要求,落實復習策略
(一)2019年考綱要求(常見非金屬)
1.了解非金屬元素單質及其重要化合物的制備方法,掌握其主要性質及其應用。
2.了解常見非金屬單質及其重要化合物對環境的影響。
3.常見非金屬元素各部分知識的綜合應用。
(二)復習策略
1.考查重點:氯及其化合物的性質與應用;海水中溴、碘的提取原理及溴、碘的性質;X-的檢驗和Cl2的制法等。
2.題型以填空題材為主,難度中檔。預測2019年高考仍會以氯、溴、碘及其化合物為載體,根據反應流程,重點在氧化還原反應和離子方程式方面進行命題。
二、強化學習過程,體現學科核心素養
(一)氯氣的“來龍”——盡可能多地尋找氯氣的制備方法(用化學方程式表示,學會分類,歸納原理)
氯氣的實驗室制法:
1.用二氧化錳跟濃鹽酸混合加熱。
4HCl(濃)+ MnO2 == MnCl2 + 2H2O +Cl2↑
2.高錳酸鉀……
登錄APP查看全文
猜你喜歡
教師博覽·科研版(2016年9期)2016-11-23 08:48:52
數學學習與研究(2016年19期)2016-11-22 11:01:58
儷人·教師版(2016年14期)2016-11-22 00:18:31
中學生物學(2016年10期)2016-11-19 12:39:19
小學教學參考(綜合)(2016年11期)2016-11-14 20:28:04
考試周刊(2016年86期)2016-11-11 08:51:29
考試周刊(2016年79期)2016-10-13 23:11:06
今日教育(2016年7期)2016-10-08 09:44:23
小學教學參考(語文)(2016年9期)2016-09-30 08:30:46
小學教學參考(語文)(2016年9期)2016-09-30 08:23:58

