肢端肥大癥患者糖代謝異常發生情況及其影響因素
王 芳 鐘歷勇
(首都醫科大學附屬北京天壇醫院內分泌科,北京市 100070,電子郵箱:wangxyff@126.com)
糖代謝異常是肢端肥大癥患者常見的代謝性并發癥之一。文獻報告肢端肥大癥患者糖尿病的患病率差異較大(19%~56%)[1-4],這可能與納入患者的年齡、種族以及病程等因素存在差異有關。生長激素水平的明顯升高所導致的胰島素抵抗,被認為是肢端肥大癥患者糖代謝異常的主要機制。但是有研究報告,在肢端肥大癥患者中,正常糖耐量(normal glucose tolerance,NGT)、糖耐量異常(impaired glucose tolerance,IGT)及糖尿病3種不同糖代謝狀態的患者穩態模型胰島素抵抗(homeostasis model assessment of insulin resistance,HOMA-IR)指數并沒有明顯差異,提示胰島素抵抗的程度不能預測肢端肥大癥患者的糖耐量狀態[5]。由此可見,胰島素抵抗并不是影響肢端肥大癥患者糖耐量狀態的決定因素。因此,本研究分析肢端肥大癥患者糖代謝異常的發生情況,并探討其影響因素。
1 資料與方法
1.1 臨床資料 回顧性分析2012年1月到2018年12月于我院內分泌科初次診斷為肢端肥大癥的50例患者的臨床資料。納入標準:符合《中國肢端肥大癥診治指南(2013版)》中有關肢端肥大癥的診斷標準[6];患者行糖代謝狀態評估前未曾使用生長抑素類似物治療。排除標準:糖耐量狀態診斷不明確;共分泌其他激素如泌乳素、促甲狀腺激素的垂體腺瘤患者;合并惡性腫瘤、嚴重肝腎功能障礙的患者。其中男性患者24例,年齡(39.00±9.82)歲;女性患者26例,年齡(39.42±11.26)歲。
1.2 研究方法
1.2.1 收集一般臨床資料:包括患者的性別、年齡、病程(患者從出現臨床癥狀到診斷的時間)、糖尿病家族史、身高、體重、血壓,計算體質指數[體質指數=體重(kg)/身高(m)2]。
1.2.2 收集實驗室指標:入院第2天空腹抽血檢測相關指標,包括空腹血糖、空腹胰島素(fasting insulin,FINS)、糖化血紅蛋白(hemoglobin A1c,HbA1c)、血脂、生長激素、胰島素樣生長因子1(insulin-like growth factor 1,IGF-1)、C肽;住院期間均完善口服葡萄糖耐量試驗評估糖耐量狀態,葡萄糖抑制試驗評估垂體生長激素-IGF-1軸的功能。血糖的測定采用葡萄糖氧化酶法,總膽固醇的測定采用膽固醇氧化酶法,LDL-C測定采用選擇性保護法(直接測定法),三酰甘油的測定采用去游離甘油法,HbA1c的測定采用高壓液相色譜法,胰島素、C肽的測定采用直接化學發光法,生長激素測定采用化學發光酶免疫法(測定范圍上限為40μg/L),IGF-1測定采用直接化學發光法。IGF-1的結果評估使用年齡匹配的正常值范圍[7],IGF-1指數=IGF-1/年齡匹配的正常值范圍上限[8-9]。使用HOMA-IR指數評估胰島素抵抗程度,HOMA-IR=(空腹血糖×FINS)/22.5,使用穩態模型胰島B細胞功能(homeostasis model assessment of β-cell function,HOMA-β)指數評估胰島B細胞功能,HOMA-β指數=20×FINS/(空腹血糖-3.5)[10]。
1.2.3 糖代謝異常的診斷標準:糖代謝異常包括糖尿病、IGT;糖尿病、IGT及NGT的診斷標準參考1999年世界衛生組織提出的相關診斷標準[11]。
1.3 統計學分析 采用SPSS 19.0軟件進行統計分析。符合正態分布的計量資料以(x±s)表示,比較采用方差分析,如方差不齊使用非參數檢驗;非正態分布的資料以M(P25,P75)表示,經對數轉換后進行分析,組間均數比較使用方差分析;計數資料以例數(構成比)表示,組間比較使用χ2檢驗;多因素分析采用Logistic回歸模型。以P<0.05為差異有統計學意義。
2 結 果
2.1 50例肢端肥大癥患者糖代謝異常發生情況 50例患者中,NGT患者24例(48.0%),糖代謝異常患者26例(占52.0%),后者包括糖尿病患者14例(28.0%)、IGT患者12例(24.0%)。未發現單純空腹血糖升高患者。
2.2 不同糖耐量狀態患者臨床特征比較 3組患者性別、年齡、體質指數、血壓、血脂、FINS、HOMA-IR指數差異均無統計學意義(均P>0.05)。糖尿病組空腹血糖及HbA1c顯著高于NGT組和IGT組,病程長于NGT組和IGT組(P<0.05),但IGT組與NGT組間差異無統計學意義(P>0.05);NGT組、IGT組、糖尿病組HOMA-β指數依次降低(均P<0.05);IGT組患者IGF-1指數高于NGT組(P<0.05),但兩組與糖尿病組間差異無統計學意義(P>0.05)。糖代謝異常組(IGT組+糖尿病組)與NGT組的生長激素基礎值≥40 μg/L的患者構成比差異無統計學意義(P>0.05)。見表1。
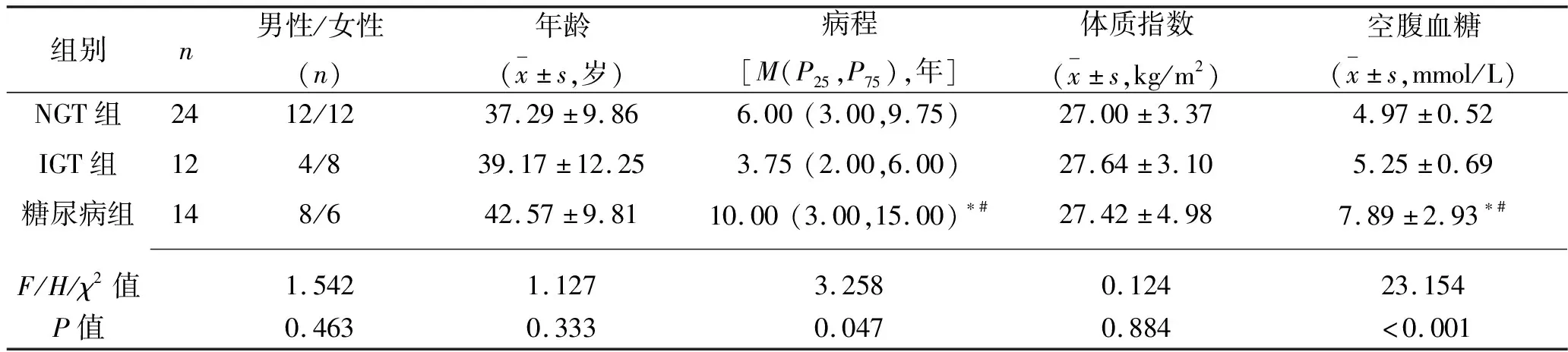
表1 不同糖耐量狀態的肢端肥大癥患者臨床特征比較
2.3 肢端肥大癥患者發生糖代謝異常影響因素的多因素分析 將可能與糖尿病或IGT相關的危險因素(性別、年齡、體質指數、病程、IGF-1指數、HOMA-β指數)作為自變量,以是否出現糖代謝異常(包括糖尿病及IGT)作為因變量,進行多因素Logistic回歸分析,變量賦值情況見表2。結果提示, 在校正性別、年齡、體質指數等因素后,IGF-1指數升高是肢端肥大癥患者發生糖代謝異常的獨立危險因素,而HOMA-β指數升高是保護性因素(均P<0.05)。見表3。

表2 變量賦值情況
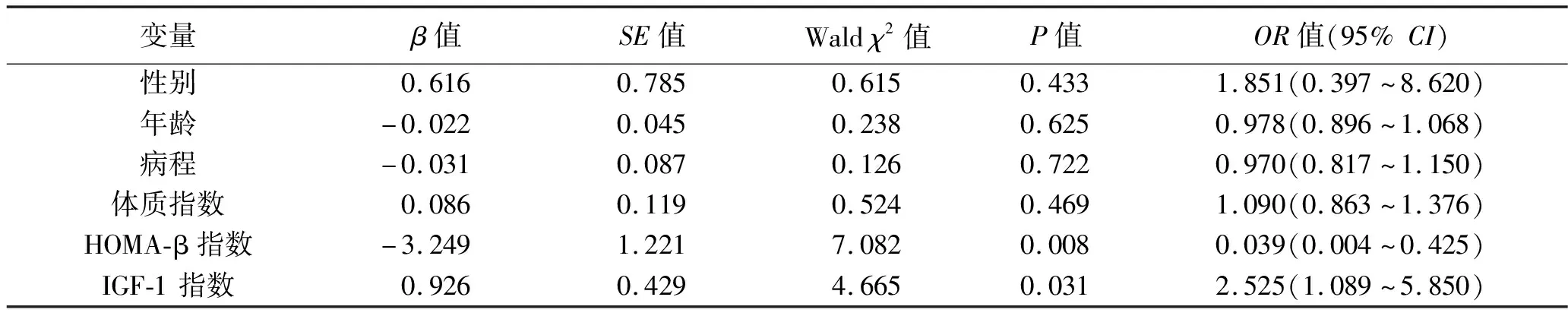
表3 影響肢端肥大癥患者發生糖代謝異常因素的多因素Logistic回歸分析
3 討 論
肢端肥大癥是一種隱匿起病的慢性內分泌疾病,即使在經蝶鞍手術治療后的患者中,死亡率仍顯著高于普通人群[12]。雖然近期研究提示腫瘤已經代替心血管系統并發癥成為肢端肥大癥患者死亡的主要病因[13],但心血管系統、呼吸系統及代謝系統并發癥仍是影響患者生活質量的重要并發癥,其中糖代謝異常是肢端肥大癥最常見的代謝性并發癥之一。在本研究入組的50例初診肢端肥大癥患者中,52%的患者被診斷為糖代謝異常,其中糖尿病患者占28%,IGT占24%,與國外文獻[5]報告的結果相似,提示肢端肥大癥患者糖代謝異常發生率高于普通人群,但本研究樣本量較小,還需擴大樣本量進一步研究。
生長激素與IGF-1對葡萄糖代謝的影響機制復雜。生長激素為胰島素拮抗激素,可以減少脂肪組織和肌肉對葡萄糖的攝取,而使肝臟糖異生增強及葡萄糖的輸出增多[14]。IGF-1可激活脂肪、肌肉和肝臟的胰島素/IGF-1雜合受體以發揮其胰島素樣作用,同時IGF-1依賴性的腸道抑胃肽的分泌可進一步刺激胰島素的分泌[15];但IGF-1又可增加肝細胞對生長激素的敏感性,使葡萄糖輸出增加。生長激素呈脈沖分泌,生長激素基礎值的高低不能反映生長激素-IGF-1軸的功能狀態,而IGF-1則較穩定,常作為疾病活動程度的指標。傳統觀點認為,肢端肥大癥患者的糖代謝異常主要與生長激素-IGF-1水平升高所致胰島素抵抗有關,而血漿生長激素和IGF-1水平與胰島素抵抗有密切的關聯[16]。本研究結果顯示,不同糖耐量狀態的肢端肥大癥患者之間IGF-1指數差異有統計學意義,多因素Logistic回歸分析提示,IGF-1指數升高是肢端肥大癥患者發生糖代謝異常的危險因素(P<0.05),這提示IGF-1水平異常可能是引起肢端肥大癥患者糖代謝異常的原因之一,這與上述觀點一致。
在本研究中,3組患者HOMA-IR指數差異無統計學意義,但NGT、IGT、糖尿病組HOMA-β指數依次降低,且多因素Logistic回歸分析提示HOMA-β指數是保護性因素(均P<0.05),提示胰島B細胞功能降低可增加肢端肥大癥患者發生糖代謝異常的風險。因此,肢端肥大癥患者的糖代謝異常除了與生長激素-IGF-1軸功能亢進相關外,胰島B細胞功能或亦是決定糖耐量狀態的重要因素之一。研究顯示,經治療肢端肥大癥病情緩解的患者中,仍有一部分患者糖代謝異常會持續[17],這也支持生長激素-IGF-1軸功能亢進引起的胰島素抵抗僅是作用機制之一的觀點,這些患者本身可能存在胰島B細胞的遺傳性缺陷,導致在胰島素抵抗因素去除以后,糖代謝狀態仍不能夠恢復。
除此之外,在肢端肥大癥患者使用生長抑素類似物治療過程中,藥物在抑制生長激素分泌、使疾病控制達標的同時,對胰島素分泌也具有抑制作用,使胰島素水平降低,負荷后血漿葡萄糖水平升高,并使HbA1c水平升高[18]。有研究發現,在初診肢端肥大癥患者中,不同糖代謝狀態的患者使用奧曲肽治療半年后,胰島素抵抗狀態均較用藥前改善,而NGT組和IGT組胰島素分泌水平明顯降低[9]。由此可見,作為肢端肥大癥患者重要的治療藥物,生長抑素類似物同時會抑制胰島素的分泌,有可能導致患者出現血糖異常。而這也是本研究納入均未曾使用生長抑素類似物治療的患者,以排除藥物對糖代謝狀態評估的影響的原因。肢端肥大癥患者在疾病發展甚至治療過程中,都有可能會出現血糖代謝的異常,因此在疾病診治的不同階段,都應該關注患者的血糖。
綜上所述,肢端肥大癥患者糖代謝異常發生率高,這不僅與生長激素-IGF-1軸功能亢進相關,而且與患者本身胰島B細胞功能相關。在肢端肥大癥患者診斷治療的不同階段,都有必要對患者的糖代謝狀況進行評估,以明確患者的糖耐量狀態,及時進行診斷和治療,避免相關并發癥的發生。

