基于線粒體自噬探討參苓白術散對COPD骨骼肌損傷細胞的保護作用機制
周曉蕓,宋雨鴻,薛丹,張麗華,胡濤
(廣州醫科大學附屬市一人民醫院,廣東 廣州 510180)
慢性阻塞性肺部疾病(chronic obstructive pulmonary disease,COPD)的發生與肺部對香煙煙霧(CSE)等有害氣體或有害顆粒的異常炎癥反應有關[1]。CSE刺激細胞可釋放大量活性氧(reactive oxygen species,ROS),引起氧化/抗氧化失衡,導致線粒體的結構和形態改變,使線粒體中受損的蛋白質、DNA 和脂質等含量顯著增加,線粒體能量代謝障礙[2-3]。越來越多研究[4]發現線粒體自噬在維持線粒體結構和功能方面具有重要作用。線粒體自噬通過選擇性的清除功能障礙的線粒體,降低細胞內ROS水平,維持線粒體的動態和能量代謝平衡,從而下調細胞的凋亡或壞死[5]。骨骼肌是線粒體能量代謝的重要器官,COPD的發生過程中,線粒體動態平衡受到破壞,從而引起骨骼肌功能障礙[6]。中醫學認為COPD骨骼肌疲勞的關鍵病機是“脾虛 (痰)濕盛”。參苓白術散為培土生金的代表方,具有益氣健脾功效,臨床研究[7-9]發現參苓白術散對治療COPD 呼吸疲勞有較好的臨床療效,可改善肌肉能量代謝,提高患者生活質量,且降低急性加重次數,但其相關作用機制目前尚不清楚。本文擬采用CSE處理L6大鼠成肌細胞模擬COPD骨骼肌損傷狀態,探討在參苓白術散作用下PINK1/Parkin介導的線粒體自噬對保護COPD骨骼肌細胞的可能作用機制。
1 材料和方法
1.1 材料
L6大鼠成肌細胞(中國科學院細胞庫),DMEM 培養基(美國ThermoFisher公司),胎牛血清(美國 Gibco 公司),BCA 蛋白定量試劑盒(美國 Sigma 公司),PINK1、Parkin、LC3B、P62等多克隆抗體(美國 Cell Signaling 公司),抗兔、抗鼠IgG(美國 Cell Signaling 公司),活性氧檢測試劑盒、JC-1 線粒體膜電位熒光探針試劑盒、ATP檢測試劑盒(均為碧云天試劑公司)。參苓白術散(蓮子肉10 g,薏苡仁10 g,砂仁10 g,桔梗10 g,白扁豆15 g,白茯苓20 g,黨參20 g,炙甘草20 g,白術20 g,山藥20 g),購自康美智慧藥房,經廣州中醫藥大學中藥中心鑒定合格,采用常規方法煎煮,濃縮后制成凍干粉,放置 -20 ℃冰箱保存備用。酶標儀((美國 Bio-RAD 公司),電泳及轉膜裝置(美國 Bio-RAD 公司),CO2恒溫培養孵箱(美國 Thermo 公司)。
1.2 方法
1.2.1 細胞培養 將L6大鼠成肌細胞置于 37 ℃、50 mL/L CO2培養孵箱中,用DMEM 培養基(5.5 mmol /L 葡萄糖) 培養,每2~3天換液 1 次,待細胞貼壁生長一段時間,光鏡下觀察其融合度在 75%~85%左右,即可進行種板、傳代、凍存等操作。
1.2.2 香煙提取物CSE的制備[10]用市售的過濾嘴香煙(大前門牌香煙,中國上海煙草有限公司)。每次用1支香煙,三通管一頭接 50 mL 注射器上,將濾嘴插入 1 mL 移液吸頭內,吸頭另一端連接在三通管另一頭上,形成一個驅動抽吸裝置。每次抽取 50 mL 香煙煙霧,將吸入的煙霧通入10 mL DMEM 基礎培養基中,形成香煙霧懸液,上下反復搖動注射器 100 次,使煙霧溶解至培養基內,將剩余煙霧排出。上述過程重復 6 次,混勻后用 1 mol/L NaOH 溶液滴定至 pH 7.4 左右,經無菌 0.22 μm微孔過濾裝置過濾后備用。
1.2.3 參苓白術散溶液配制 取參苓白術散凍干粉0.5 g(采用常規方法煎煮,濃縮后制成凍干粉),溶于5 mL DMEM基礎培養基混勻后形成 100 mg/mL的母液,超聲震蕩儀 5 min,吸取至注射器針管中,用 0.22 μm過濾器過濾后 1 h 內使用。
1.2.4 實驗分組 將L6大鼠成肌細胞隨機分為5個組:①control組:用DMEM培養基培養L6大鼠成肌細胞,不作任何處理。②CSE模型組:用含有2.5%CSE的DMEM培養基培養L6大鼠成肌細胞的24 h后換正常DEME培養液繼續培養。③SLB-L組:用含有2.5%CSE的DMEM培養基培養L6大鼠成肌細胞,24 h后換含有2.5 mg/mL參苓白術散藥液的DMEM培養基繼續培養24 h。④SLB-M組:用含有2.5%CSE的DMEM培養基培養L6大鼠成肌細胞,24 h后換含有5 mg/mL參苓白術散藥液的DMEM培養基繼續培養24 h。⑤SLB-H組:用含有2.5%CSE的DMEM培養基培養L6大鼠成肌細胞,24 h后換含有10 mg/mL參苓白術散藥液的DMEM培養基繼續培養24 h。
1.2.5 熒光酶標儀檢測細胞內的ROS 將各分組的細胞收集后懸浮于稀釋好的DCFH-DA中,細胞1×106個/m2,37 ℃細胞培養箱內孵育20 min。用無血清細胞培養液洗滌細胞3次,以充分去除未進入細胞內的DCFH-DA。在熒光酶標儀上使用488 nm激發波長,525 nm發射波長,檢測各組細胞的ROS含量。
1.2.6 ATP檢測試劑盒檢測細胞內線粒體的ATP水平 按實驗分組分別處理后,吸除培養液,6孔板每孔加入200 uL裂解液裂解細胞。裂解后4 ℃ 12 000g離心5 min,取上清,冰浴上溶解待用試劑,把ATP標準溶液用ATP檢測裂解液稀釋成適當的濃度梯度,按照說明配置 ATP檢測工作液。取96孔黑板,每孔加100 μL ATP檢測工作液,在檢測孔內加上80 μL樣品或標準品,用luminometer測定RLU值。
1.2.7 JC-1染色試劑盒檢測L6大鼠成肌細胞內線粒體膜電位水平 制備L6大鼠成肌細胞懸液,調整細胞密度為5×105個/mL置于流式細胞管。按實驗分組分別處理后,按照說明配置 JC-1 染色工作液。流式管中加入0.5 mL 細胞培養液及0.5 mL JC-1 工作液,充分混勻。37 ℃ 避光孵育20 min,600g4 ℃離心3~4 min,沉淀細胞,棄上清。預冷的 JC-1 染色緩沖液(1×)洗滌2次,棄之,加入1 mL JC-1染色緩沖液(1×)重懸后,流式細胞儀檢測及記錄,Cellquest Pro 軟件分析處理數據。
1.2.8 蛋白質印跡法檢測各蛋白的表達水平 按實驗分組分別處理后,加入細胞裂解液后提取蛋白。以 BCA 法測定蛋白濃度。配置 SDS-聚丙烯酰胺凝膠。組裝電泳轉膜裝置,上樣,電泳,轉膜,將蛋白轉移至聚偏氟乙烯(PVDF) 膜上。脫脂奶粉封閉孵育 1 h。各條帶分別孵育兔抗 PINK1 抗體、兔抗LC3B 抗體、兔抗P62抗體、鼠抗Parkin 抗體、鼠抗β-actin 抗體(稀釋比例均為1∶1 000,4 ℃ 孵育過夜)。1∶2 000比例稀釋抗兔IgG 孵育 1 h。其中需要清洗的步驟均可用 TBST 清洗 3 次。用化學發光法檢測目的條帶,以β-actin 為內參標化各蛋白表達的水平。
1.3 統計學處理
2 結果
2.1 參苓白術散對CSE誘導的L6大鼠成肌細胞內的ROS水平的影響
結果顯示,與control組相比,CSE模型組細胞內ROS水平上升(P<0.05);與CSE模型組比較,中藥組各組細胞內ROS水平下降,其中SLB-M、SLB-H組(P<0.05)具有統計學意義。見圖1。
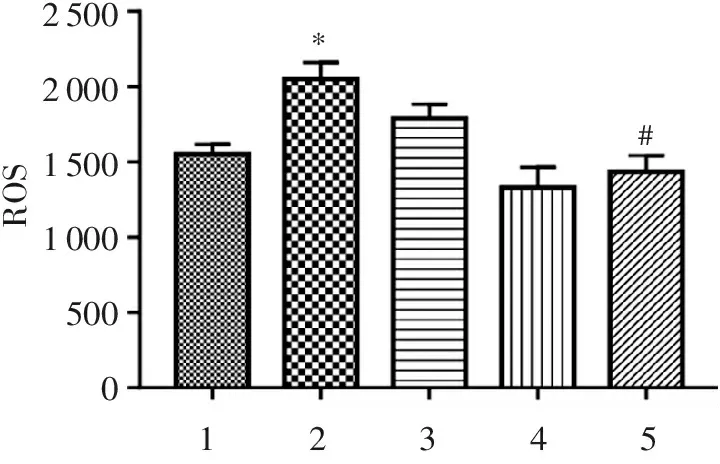
1234525002000150010005000ROS*#
1. control; 2. 2.5%CSE; 3.SLB-L; 4.SLB-M; 5.SLB-H(下圖同)。 與正常組相比:*P<0.05; 與模型組相比:#P<0.05。
圖1不同濃度SLB對CSE誘導的L6細胞內的ROS水平的影響
Figure1Effect of different SLB concentrations on ROS level in CSE-induced L6 cells
2.2 各組細胞的線粒體ATP水平的檢測
結果顯示,與control組相比,CSE模型組線粒體膜ATP水平下降(P<0.05),與CSE模型組比較,SLB-M組細胞ATP水平上升(P<0.05)。見圖2。

151050ATP*#12345
與正常組相比:*P<0.05; 與模型組相比:#P<0.05。
圖2不同濃度SLB對CSE誘導的L6細胞的線粒體ATP水平的影響
Figure2Effect of different SLB concentrations on mitochon-drial ATP levels in CSE-induced L6 cells
2.3 各組細胞內線粒體膜電位變化的 JC-1檢測
結果顯示,與control組相比,CSE組線粒體膜電位水平下降(P<0.05),SLB-H組細胞內線粒體膜電位下降(P<0.05); 與 CSE模型組比較,SLB-L、SLB-M組細胞線粒體膜電位水平上升(P<0.05)。見圖3。
2.4 參苓白術散對CSE誘導的L6大鼠成肌細胞線粒體自噬相關蛋白表達水平的影響
采用 Western blot 法檢測各組細胞中蛋白表達水平結果顯示,與control組比較,CSE模型組LC3B、p62、PINK1蛋白表達水平升高(P<0.05),Parkin表達水平下降(P<0.05),各中藥組LC3B蛋白表達均升高(P<0.05); SLB-L組PINK1蛋白表達水平明顯升高(P<0.05) ; 與CSE模型組比較,SLB-M、SLB-H組LC3B、Parkin蛋白水平顯著升高(P<0.05),而各中藥組p62蛋白表達水平下降(P<0.05),SLB-H組PINK1蛋白表達下降(P<0.05)。見圖4。

與正常組相比:*P<0.05; 與模型組相比:#P<0.05。
圖3不同濃度SLB對CSE誘導的L6細胞的線粒體膜電位的影響
Figure3Effect of different SLB concentrations on mitochondrial membrane potential in CSE-induced L6 cells

LC3Bp62Pink1Parkinβ-actin160001400052000600006600042000123453.02.01.00.02.01.51.00.50.0LC3B/β-actinParkin/β-actinP62/β-actinPink1/β-actin3.02.01.00.01.51.00.50.0123451234512345*#**#**###*##**#
與正常組相比:*P<0.05; 與模型組相比:#P<0.05。
圖4不同濃度SLB對CSE誘導的L6大鼠成肌細胞線粒體自噬相關蛋白LC3B、PINK1、Parkin、P62 蛋白表達
Figure4Effect of different SLB concentrations on the expression of LC3B,PINK1,Parkin and p62 in CSE-induced L6 cells
3 討論
COPD患者由于通氣功能障礙,呼吸阻力升高,耗能增加,使呼吸肌長期超負荷運動,導致呼吸肌順應性下降、肌力和耐力顯著降低[11]。呼吸肌屬于橫紋肌的范疇,從胚胎學與形態學的角度分屬于骨骼肌。研究表明,持續性的呼吸肌功能障礙會引起骨骼肌損傷,骨骼肌損傷是呼吸衰竭發生的重要原因之一[12]。香煙煙霧包含較高濃度的自由基和氧化產物,可刺激機體產生大量的ROS 導致氧化應激,破壞體內的氧化平衡[13]。有研究顯示,COPD患者骨骼肌組織的氧化應激明顯增加,且發現氧化應激的增加與其活動能力和活動耐力呈負相關[14]。本實驗研究發現CSE模型L6大鼠成肌細胞內的ROS含量增加,采用參苓白術散藥劑干預治療后,明顯降低細胞內的ROS含量,表明參苓白術散可能是通過調節COPD骨骼肌損傷狀態下細胞內氧化/抗氧化系統的平衡,使細胞清除ROS的能力增加,阻斷或消除ROS對骨骼肌細胞的過氧化損傷。
線粒體膜電位的穩定是維持線粒體ATP合成和氧化磷酸化的重要條件之一。近年來研究發現,線粒體膜電位是觀察細胞早期凋亡以及線粒體膜流動性和通透性功能的直接指標[15]。線粒體膜電位下降可引起線粒體內膜通透性增加,蓄積的Ca2+釋放入細胞質,引起電子泄露,產生更多的ROS,使線粒體功能出現障礙,合成的ATP減少,能量代謝失衡,從而引起細胞凋亡甚至壞死[16-17]。本研究結果顯示,CSE誘導的L6大鼠成肌細胞線粒體膜電位水平及ATP合成水平顯著下降,而參苓白術散組線粒體膜電位水平及ATP水平較CSE模型組均明顯升高,提示參苓白術散可通過調節COPD骨骼肌損傷狀態下細胞線粒體的能量代謝平衡來維持細胞氧化/抗氧化系統的平衡,在細胞凋亡早期抑制線粒體膜電位的下降,改善線粒體膜的通透性,維持ATP的合成,從而清除細胞內過多的ROS,降低細胞的早期凋亡。
線粒體自噬可通過調控線粒體的融合和分裂清除受損及多余線粒體、減少ROS累積,從而維持線粒體的動態和能量代謝平衡[18]。PINK1是一種絲氨酸/蘇氨酸激酶,存在于線粒體外膜的一種蛋白激酶,能夠作為受損線粒體的分子感受器;Parkin是由PARK2基因編碼的存在于細胞質中的一種E3泛素-蛋白連接酶活性的蛋白,主要介導底物泛素化,調節蛋白降解和信號轉導等[19-20]。在生理狀態下,PINK1存在于線粒體外膜并很快被蛋白水解酶降解使其維持穩定的低水平狀態。CSE誘導L6大鼠成肌細胞使細胞內受損線粒體外膜處于去極化,線粒體膜電位下降,負責降解 PINK1 的蛋白水解酶被抑制,PINK1 在受損線粒體外膜聚集,這一過程可誘導Parkin 轉位到受損線粒體,從而介導線粒體自噬的發生。Parkin 轉位至受損線粒體后,其 E3 泛素酶被激活,從而線粒體基質蛋白泛素化,泛素化的自噬受體蛋白P62在去極化的線粒體基質上積累,進而與 LC3 結合,介導泛素化的底物進入自噬體,募集受損線粒體到溶酶體上從而完成線粒體自噬[21-23]。本研究發現CSE模型L6大鼠成肌細胞內的自噬蛋白LC3B、P62 、PINK1蛋白表達水平增高,Parkin 表達水平下降,而參苓白術散干預后細胞內自噬相關蛋白Parkin、LC3B表達明顯增加,p62表達顯著下降,提示參苓白術散可通過激活COPD骨骼肌損傷細胞內PINK1 /Parkin 介導的線粒體自噬途徑,清除受損及多余的線粒體,維持細胞內線粒體的動態平衡和能量代謝平衡,提高細胞清除多余ROS的能力,改善細胞內氧化/抗氧化失衡,從而保護骨骼肌細胞的正常結構和功能。
綜上所述,本實驗在細胞水平證明參苓白術散可激活PINK1/Parkin介導的線粒體自噬通路,提高COPD骨骼肌細胞的線粒體自噬水平,維持體內線粒體動態平衡,減少CSE引起的氧化損傷,提示參苓白術散對改善線粒體功能,改善COPD骨骼肌肌力和耐力狀態有重要作用,從而為中藥復方在 COPD骨骼肌損傷治療方面提供了科學的實驗依據。

