中性粒細胞/淋巴細胞比值及空腹血糖對急性腦出血患者短期死亡的評估作用
李 春 趙高峰 滕軍放△
1)鄭州大學第一附屬醫院神經內科,河南 鄭州 450052 2)鄭州市第三人民醫院神經內科,河南 鄭州 450001
急性非外傷性腦出血(ICH)一直是一項主要的公共衛生問題,占美國、歐洲及澳大利亞腦卒中的10%~15%,在亞洲占20%~30%,發病1個月內病死率高達40%[1];與缺血性腦卒中相比,其發病年齡更早,致殘率及病死率更高,占卒中導致的“生產壽命年損失”比例最高[2]。針對ICH尚無明確證據(Ⅲ期)的藥物及手術治療[3-4],臨床依據出血部位、出血量及患者的整體狀況選擇治療方案,從支持治療到更積極的減壓手術,這些治療措施的不當選擇可能給病人帶來更大的風險,因而尋找能預測臨床預后的可靠而準確的生物標志物顯得尤其重要。有研究[5-6]顯示,炎癥機制參與了ICH后腦損傷的發生,某些炎癥指標與ICH臨床預后較差有關,但這些指標普及性較差。本試驗通過前瞻性研究以期發現臨床常用且對ICH預后有較高預測價值的生物標志物。
1 資料與方法
1.1研究對象選取2016-06-01—2018-05-31在鄭州大學第一附屬醫院神經內科住院的急性腦出血患者,根據納入及排除標準,納入189例為研究對象。納入標準:年齡≥18歲,發病至就診時間≤24 h,經頭顱CT或MRI證實為腦出血。排除標準:蛛網膜下腔出血、硬膜下出血、硬膜外出血、心血管疾病、心肌梗死、心功能衰竭,2周內有急性感染、急性中毒,腎臟疾病、腫瘤或血液系統疾病影響中性粒細胞或淋巴細胞(如骨髓增殖性疾病和白血病),有明確原因導致的腦出血(外傷、藥物、先天畸形、凝血功能障礙、血管炎、腦腫瘤、淀粉樣血管病或梗死后再出血)史者,服用影響中性粒細胞或淋巴細胞的藥物者(惡性腫瘤的化療或放療、粒細胞集落刺激因子治療、糖皮質激素等)。其中男108例,女81例,年齡(59.70±13.63)歲;基底節區出血88例,腦葉出血27例,小腦出血14例,丘腦出血21例,腦室出血18例,腦干出血21例;發病30 d時死亡21例,生存168例。同期健康體檢者189例為正常對照,男97例,女92例;年齡(61.69±8.09)歲。2組年齡、性別比較差異無統計學意義(P>0.05)。
1.2方法收集患者的年齡、性別、飲酒、吸煙及既往病史。所有患者入院時均進行格拉斯哥昏迷評分(GCS),于入院當時實驗室檢查血常規、持續監測血壓、計算出血量,次日清晨采集空腹肘靜脈血送檢,實驗室檢查空腹血糖、血脂、同型半胱氨酸、尿酸、膽紅素和C反應蛋白,住院期間統計有無合并肺部感染、應激性潰瘍、下肢深靜脈血栓(DVT);發病30 d時統計生存及死亡病人資料。
1.3統計學方法所有數據采用SPSS 21.0 軟件包進行統計分析。計量資料符合正態分布用均數±標準差描述,組間比較采用獨立樣本t檢驗,非正態分布的采用中位數表示,組間比較采用Mann-Whitney檢驗;計數資料組間比較采用卡方分析;與患者死亡相關的因素進行多因素Logistic回歸分析。應用ROC曲線評價NLR和FBG對急性腦出血患者短期死亡的預測價值,根據Youden指數確定最佳cut-off值。P<0.05為差異有統計學意義。
2 結果
2.12組一般資料比較2組一般資料比較顯示,性別、年齡、吸煙、飲酒在2組間的分布差異無統計學意義(P>0.05);高血壓史、糖尿病史、WBC、NLR、FBG、SBP、DBP在2組間的分布差異有統計學意義(P<0.05)。見表1。
2.2發病30d時生存組與死亡組資料比較發病30 d時根據臨床結局分為生存組168例,死亡組21例,對2組間的相關指標進行分析,結果顯示,糖尿病史、肺部感染、年齡≥80歲、WBC、NLR、FBG、LDL、HDL、GCS差異有統計學意義(P<0.05)。見表2。
2.3影響急性腦出血患者發病30d時死亡的危險因素Logistic回歸分析將上述有統計學意義的指標作為自變量(肺部感染、糖尿病史、年齡≥80歲、NLR、FBG、HDL、LDL、WBC及入院時GCS評分),腦出血預后為因變量Y,分為生存(Y=1)和死亡(Y=2)兩種情況,進行多因素Logistic回歸分析,結果顯示,WBC、FBG、NLR、GCS是引起腦出血發病30 d時死亡的獨立危險因素(P<0.05)。見表3。
2.4ROC曲線分析NLR和FBG預測急性腦出血患者短期死亡的AUC分別為0.777(95%CI:0.667~0.877,P<0.01)、0.864(95%CI:0.792~0.937,P<0.01);當NLR預測死亡截斷值為6.350時,對應的敏感性為81.0%,特異性為62.5%;當FBG預測死亡截斷值為8.80時,對應的敏感性為71.4%,特異性為88.7%。見圖1。
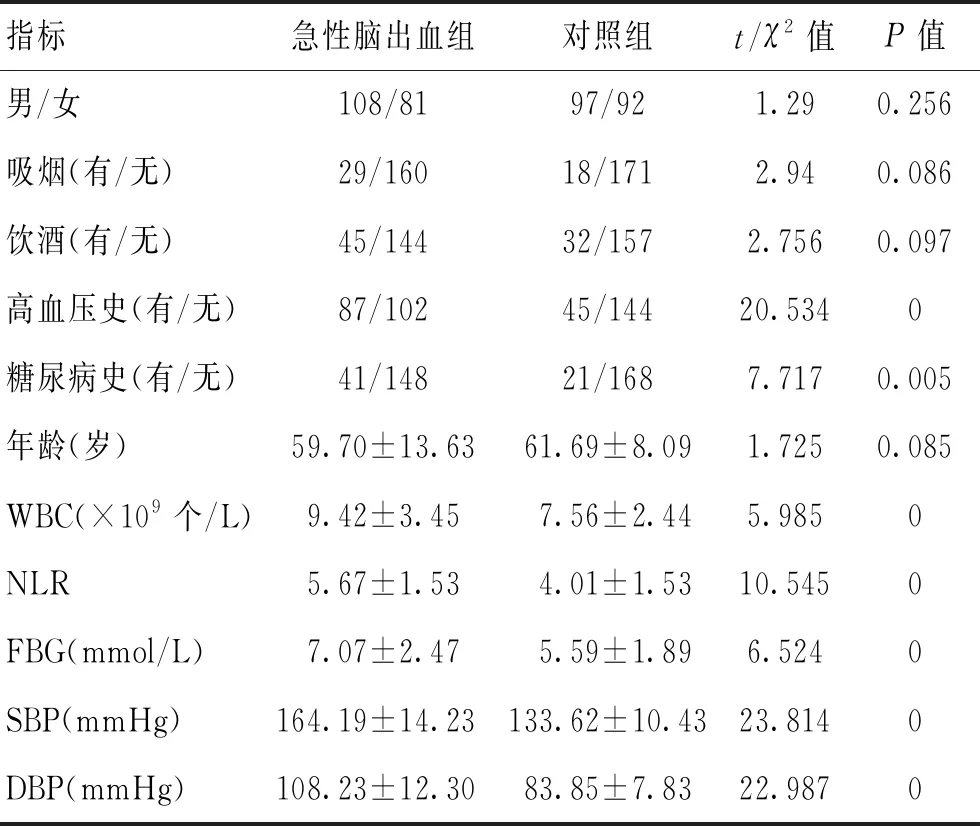
表1 2組一般資料比較
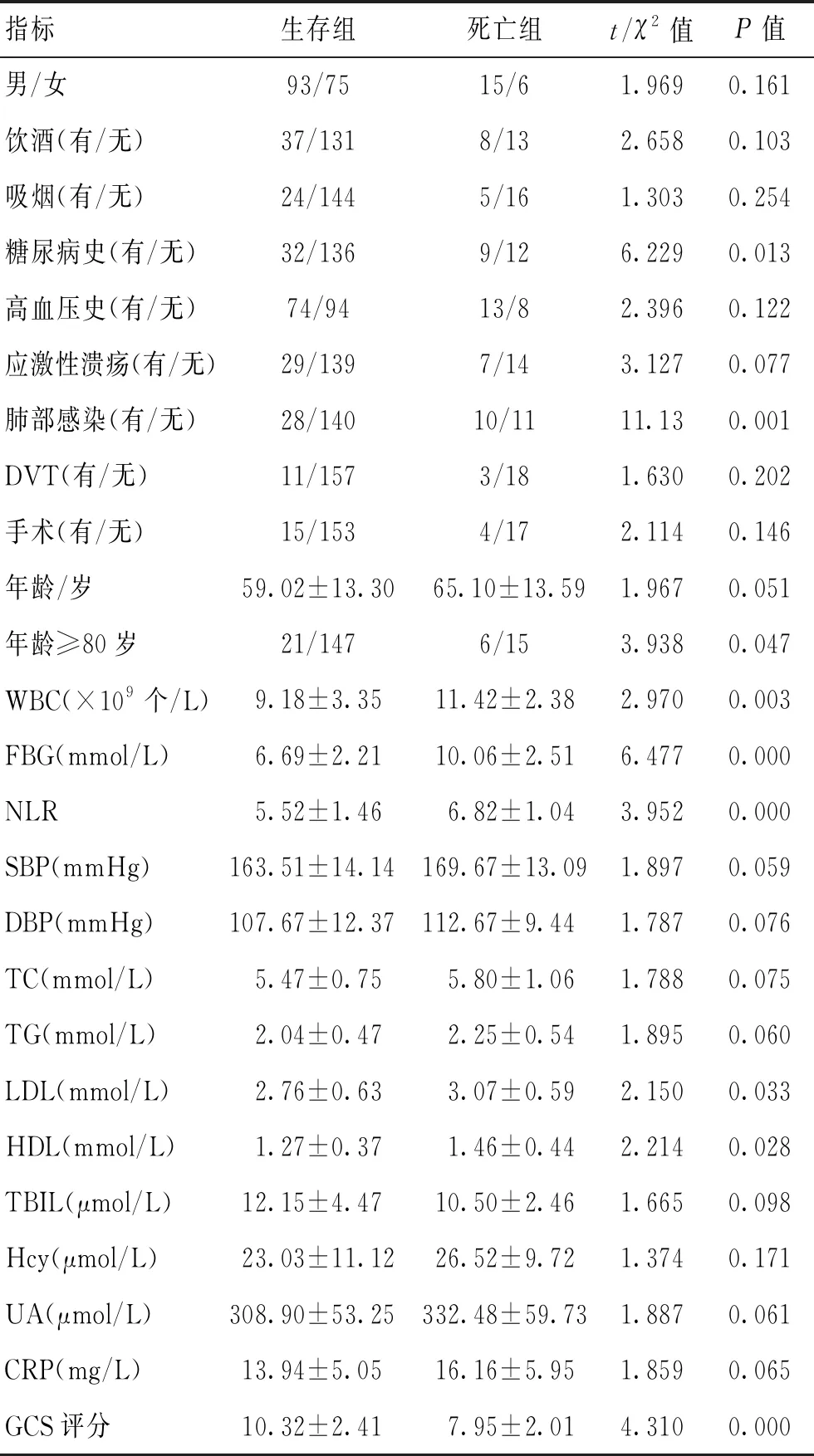
表2 發病30 d生存組與死亡組間相關指標比較
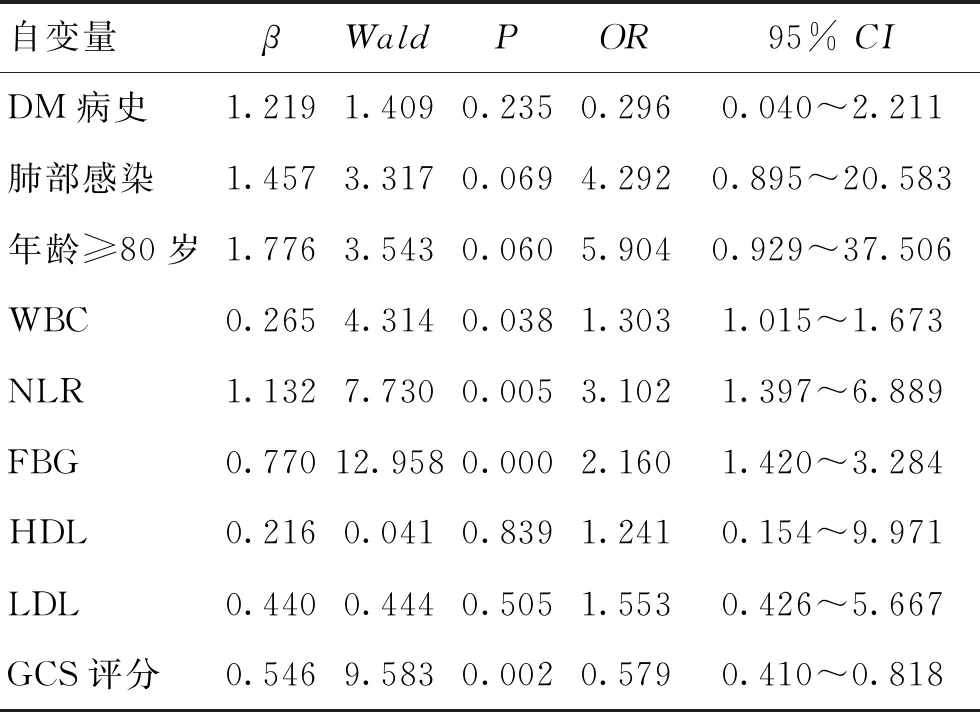
表3 多因素Logistic回歸分析結果
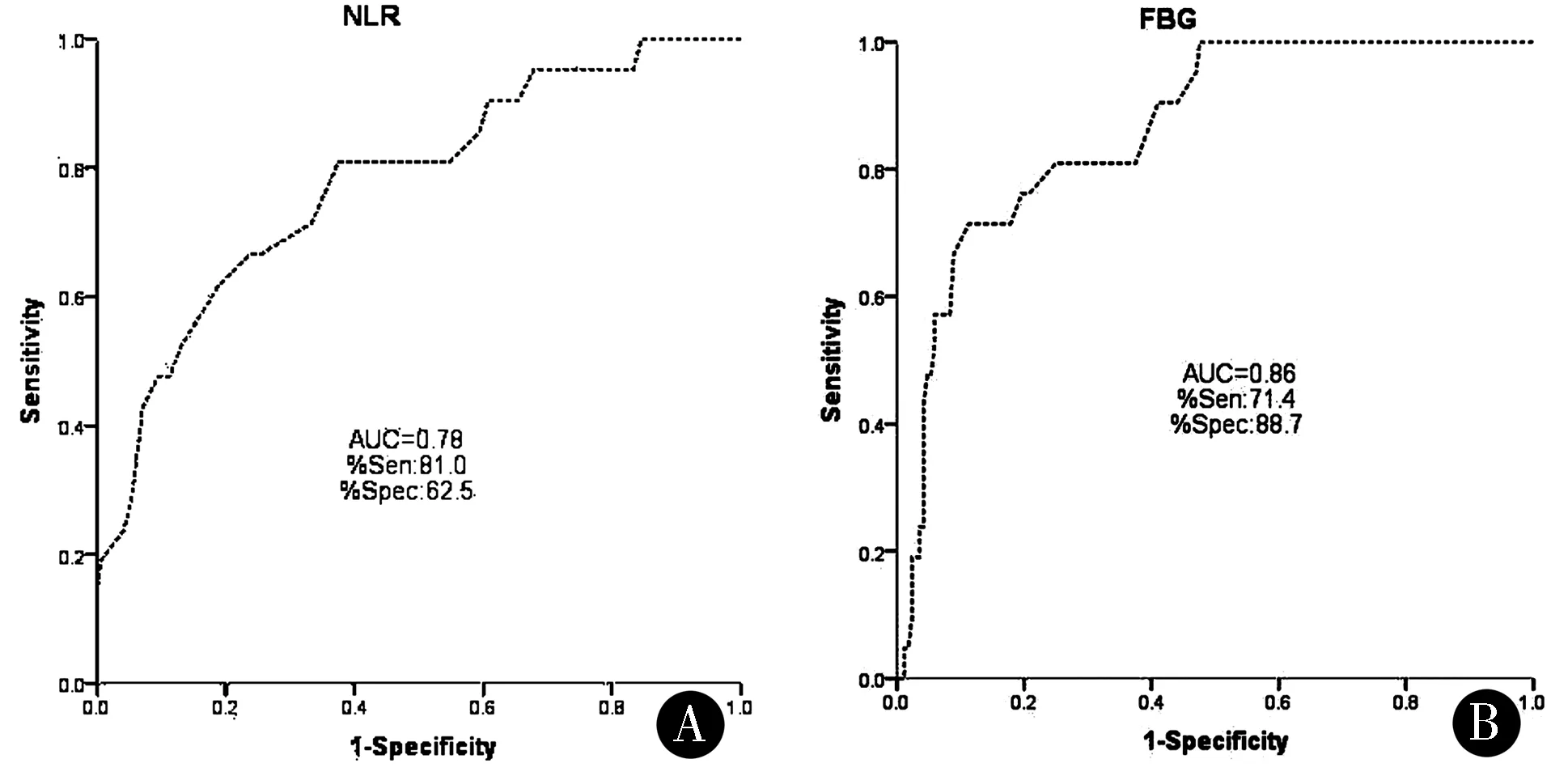
圖1 NLR和FBG預測急性腦出血短期死亡的ROC曲線Figure 1 ROC curve of NLR and FBG predicting short-term death from acute cerebral hemorrhage
3 討論
腦出血發病年齡相對較輕、癥狀重、預后差,給家庭及社會造成巨大負擔,因此,積極尋找影響腦出血預后的因素尤其重要。由于腦出血病因繁多、病理生理機制復雜、影響因素較多以及研究對象、方法及觀察指標不一致,導致研究結論不一致。本研究共納入189例,死亡21例,病死率11.1%,低于已報道的病死率[1,7],考慮與納入的研究對象較少,就診患者的病情嚴重程度及治療措施等多種因素有關。多因素Logistic回歸分析顯示,入院時WBC、FBG、NLR、GCS是急性腦出血患者短期死亡的獨立危險因素。
腦出血后血腫對腦組織的機械損傷是造成發病早期腦損傷的主要機制[5],因此,早期移除血腫及阻止血腫擴大是最佳的治療策略,然而早期移除血腫的外科試驗(STICH & MISTIE)并未提供能改善臨床結局的證據[8-9]。研究者開始將治療重點轉移至腦出血引起的繼發損傷,腦出血觸發的炎癥和炎癥反應誘導級聯反應介導的損傷機制可能會影響疾病進展,從而影響疾病的轉歸[10]。
本研究發現,急性腦出血組患者入院時WBC及NLR較健康對照組明顯升高,死亡組較生存組明顯增高,提示炎癥參與了腦出血的發生發展,造成神經功能損傷,與急性腦出血短期預后不良有直接關系,與相關文獻報道一致[11-12]。腦出血后數分鐘小膠質細胞被激活,大量被激活的小膠質細胞釋放各種細胞因子、化學趨化因子、自由基、一氧化氮和其他的潛在化學毒素引起和加劇腦損傷[10,13],釋放促炎調節因子(細胞因子和化學趨化因子),促進外周炎癥細胞(白細胞及巨噬細胞)進入。中性粒細胞是最早進入出血腦組織的白細胞亞型,有研究[14-15]顯示,中性粒細胞與腦出血病人神經功能惡化及死亡有直接關聯,其通過產生活性氧、釋放促炎蛋白酶、調節血腦屏障的通透性直接損傷腦組織,興奮性毒性和氧-糖剝奪誘導的中性粒細胞可以加劇神經元的死亡,白細胞一旦進入出血腦組織,就會在2 d內凋亡,死亡的白細胞釋放其內容物通過刺激鄰近的小膠質細胞/巨噬細胞分泌促炎毒素因子進一步損傷腦組織,形成惡性循環。
淋巴細胞參與的細胞免疫及體液免疫反應在機體防御病原體感染方面起重要作用。動物實驗顯示,腦出血引起的主要免疫反應導致外周淋巴細胞的減少[16],進入腦部的淋巴細胞增強腦出血誘發的腦部炎癥反應及腦損傷[17]。急性腦出血誘發淋巴細胞凋亡及功能失活,淋巴器官及外周血中淋巴細胞減少嚴重損傷機體的防御能力[18],使機體更易于感染,增加院內感染的發生率,是導致腦出血病人死亡的一個主要原因。NLR與腦出血的病死率有關,主要與血腫周圍或系統的炎癥反應增強和腦出血誘發的免疫抑制有關[19],NLR增高反映了機體固有免疫應答的增強(中性粒細胞增高)及適應性免疫應答的減弱(淋巴細胞減少)[20]。
與健康對照組相比,腦出血組血糖明顯增高,與SALIBA等[21]的一項隊列研究結果一致,但HESAMI等[22]的研究顯示高血糖與腦出血之間無直接關系,目前高血糖與腦出血之間的關系尚無定論。但有研究[23-24]顯示,高血糖與腦出血短期不良預后有關。高血糖通過多種機制加重腦損傷,增加腦出血患者的病死率。動物實驗研究[25-26]顯示,高血糖誘發神經元凋亡,一些研究[27]發現神經元的死亡與高血糖誘發的炎癥反應和氧自由基的毒性效應有關。同時有研究[28]發現,高血糖可以導致過氧化物產生過多,血腦屏障破壞和腦水腫增強,導致臨床癥狀加重,預后不良。因此,高血糖可能是一個預測腦出血病死率的良好指標。
采用ROC曲線分析NLR及FBG在急性腦出血患者短期死亡中的預測價值,統計結果顯示,NLR及FBG預測急性腦出血患者短期死亡的AUC分別為0.777和0.864;Youden index最大時確定截斷值;當NLR預測死亡截斷值為6.35時,對應的敏感性為81.0%,特異性為62.5%;當FBG預測死亡截斷值為8.80時,對應的敏感性為71.4%,特異性88.7%。雖然NLR及FBG對腦出血短期死亡的預測有一定的準確性,但兩者的敏感性及特異性均一般,考慮與影響腦出血短期死亡的因素較多有關。
本研究首次觀察了在綜合醫院急性腦出血患者入院時WBC、NLR、空腹血糖及入院時GCS與發病30 d時的死亡獨立相關,對腦出血短期預后有較好的預測能力,有望為臨床工作提供幫助。白細胞計數及血糖測定具有簡易、快速、價格低廉、普及度高、良好的標準化、易于觀察等優點,增加了患者的依從性。最近有研究顯示,NLR與單一中性粒細胞或淋巴細胞相比是更強的炎癥標志物[29]。由于腦出血后神經損傷的病理生理機制尚不完全明確,可靠的生物標志物也許會為這種毀滅性損傷的發生機制提供研究方向。

