PLL-Ferumoxytol標記小鼠胰島β細胞系MIN6的生物活性研究
Silvany Simone Sanches TAVARES,張淼,祝曉陽,顧寧
(東南大學 生物科學與醫學工程學院,生物電子學國家重點實驗室,江蘇省生物材料與器件重點實驗室,江蘇 南京 210009)
糖尿病是嚴重危害人類健康的慢性疾病。與傳統治療方法相比,胰島移植技術可以更好地模擬生理性的胰島素分泌,為患者提供了一種風險較小且療效更好的替代療法[1-2]。目前由于缺乏有效、無創傷的胰島移植物監測技術,移植物移植入體內后難以在活體狀態下評價細胞的分布、增殖和遷移等,也導致了胰島移植效率及療效不理想等問題[3],制約了胰島細胞用于移植治療糖尿病的臨床應用。磁共振成像(magnetic resonance imaging,MRI)因其高空間分辨率、多方位成像而成為理想的移植細胞活體示蹤手段。超順磁性氧化鐵納米顆粒(superparamagnetic iron oxide nanoparticles,SPIONs) 是目前移植細胞示蹤較為理想的標記物,尤其在干細胞移植領域的應用表現突出[4]。其優勢為粒徑小,弛豫率高,生物相容性和生物可降解性好,并且進入體內后可被細胞代謝。通過對細胞進行磁標記,國內外學者已經成功地進行了腦和心臟等部位磁標記干細胞的體外成像及活體示蹤[5]。近期對微囊化胰島β細胞移植的MRI示蹤也成為新的研究熱點[6]。另外研究發現,將SPIONs與正電荷轉染劑多聚賴氨酸(poly-L-lysine,PLL)結合,使納米粒子更容易穿越帶負電荷的細胞膜進入細胞內,可以提高標記率且使MR顯像更為敏感,并已證明其對細胞無毒性[7]。本課題組在生物醫用磁性納米材料的研究與應用方面已有多年的深厚積累,自制的超順磁性氧化鐵納米粒子Ferumoxytol作為補鐵劑與磁共振造影劑,其生物安全性超越其他研究所使用的磁性納米顆粒[8],并且Ferumoxytol也是目前唯一獲批可在臨床上單獨應用的SPIONs。本研究以Ferumoxytol作為對照,研究PLL修飾的Ferumoxytol體外標記小鼠胰島β細胞系MIN6的可行性,對細胞的標記效率以及對細胞活力、增殖、胰島素合成與分泌功能等的影響。
1 材料與方法
1.1 細胞培養
MIN6細胞由南京醫科大學江蘇省人類功能基因組學重點實驗室提供,細胞用含20%牛血清(Gibco,南美)的DMEM高糖培養基(Sigma),于37 ℃、5%CO2環境下常規培養,待到70%~80%融合后以1∶2方式傳代。
1.2 體外標記MIN6細胞
將MIN6細胞接種到培養板上,將制備的Ferumoxytol或PLL-Ferumoxytol分別以200、500和800 μg·ml-1的濃度加入培養基與細胞共孵育,分別培養24、48、72 h;同時設置正常培養組為對照。
1.3 細胞增殖和細胞活性檢測
使用細胞增殖檢測試劑盒(cell counting kit-8,CCK-8)進行細胞增殖分析。將MIN6細胞接種到96孔板中,生長24 h后替換成含200、500和800 μg·ml-1的Ferumoxytol或PLL-Ferumoxytol的新鮮培養基,分別孵育24、48、72 h后,將培養板用磷酸緩沖鹽溶液(PBS)洗滌,添加10 μl CCK-8溶液后培養3 h,然后使用酶標儀測定450 nm處的吸光度。為了進一步分析細胞活性,進行LIVE/DEAD染色,待細胞融合達到70%~80%后,將其接種到24孔板中(每孔0.05×106個細胞),在24 h的培養時間內向培養基中加入不同濃度的納米顆粒,用PBS洗滌細胞,并按照LIVE/DEAD試劑盒指示進行染色操作。
1.4 肌動蛋白纖維及細胞核染色
當融合達到70%~80%后,將細胞接種到96孔板中(每孔1.25×104個細胞),與含有不同濃度Ferumoxytol和PLL-Ferumoxytol的新鮮培養基共孵育24 h。吸棄PBS,加入3.7%甲醛固定30 min。PBS沖洗3次后,加FITC-鬼筆環肽(Alexa Fluor 488)孵育30 min,吸棄后用PBS洗3次。其中 Hoechst 33342被用作核染色的復染色。
1.5 Perl的普魯士藍染色法
將細胞接種到24孔板中(每孔5×104個細胞),與納米顆粒(PLL-Ferumoxytol或Ferumoxytol)共培養24 h。24 h后去除培養基,PBS洗滌,并用4%甲醛固定。使用普魯士藍染色液進行染色測定以確定IONP的存在,最后觀察細胞并使用顯微鏡(TS100/TS100-F,Nikon Co. Ltd.,日本) 進行成像。
1.6 透射電鏡(TEM)觀察
使用TEM觀察MIN6細胞內部氧化鐵納米顆粒的存在。 MIN6細胞分別與Ferumoxytol和PLL-Ferumoxytol在200、500和800 μg·ml-1濃度下共培養24 h。PBS洗3次后,使用2.5%的戊二醛溶液在4 ℃環境下固定過夜。重復脫水后,將樣品與環氧乙烷和環氧樹脂共培養過夜,并用新鮮的環氧樹脂滲透3次。用超薄切片機切片,通過醋酸鈾水溶液和檸檬酸鉛溶液進行雙染色,用FEI Tecnai F30顯微鏡觀察細胞并對其成像。
1.7 葡萄糖刺激下的胰島素分泌試驗(GSIS)
將細胞與不同濃度的Ferumoxytol和PLL-Feru-moxytol分別共孵育24、48、72 h后,接種到48孔板中(每孔1.25×104個細胞)。將細胞置于含2 mmol·L-1葡萄糖的Krebs-Ringer碳酸氫鹽緩沖液(KRBH:125 mmol·L-1NaCl、1.2 mmol·L-1MgSO4、1.2 mmol·L-1CaCl2、22 mmol·L-1NaHCO3、10 mmol·L-1HEPES、1.19 mmol·L-1KH2PO4)溶液中1 h,然后換成含20 mmol·L-1葡萄糖的KRBH 溶液中反應1 h。分別收取上清液,用ELISA試劑盒測定其中胰島素濃度,以檢測細胞的胰島素分泌功能。
1.8 統計學處理
所有數據均以均數±標準差表示,應用GraphPad Prism 8軟件進行分析,兩組間比較采用雙因素方差分析,多組間比較采用Dunnett-t檢驗法。P<0.05 認為差異具有統計學意義。
2 結 果
2.1 MIN6細胞形態評估
使用相差顯微鏡評估納米顆粒存在情況下的細胞形態變化。結果(圖1)顯示,與Ferumoxytol或PLL-Ferumoxytol共培養的細胞形態無明顯變化。為了更好地了解納米顆粒對MIN6細胞形態的影響,我們單獨測試了不同濃度PLL的細胞毒性,發現較高濃度(19 μg·ml-1)的PLL對細胞具有明顯毒性。

圖1 MIN6細胞形貌表征 對照組、800 μg·ml-1 Ferumoxytol和PLL-Ferumoxytol標記MIN6細胞24 h后的細胞形態
2.2 細胞增殖和細胞活力檢測結果
將細胞暴露于不同濃度(200、500和800 μg·ml-1)的Ferumoxytol中,通過CCK-8法和LIVE/DEAD細胞染色測定法檢測細胞增殖和細胞活力。CCK-8檢測結果顯示,與對照細胞相比,與Ferumoxytol、PLL-Ferumoxytol共孵育24、48、72 h后,對細胞增殖沒有顯著影響(圖2)。并且LIVE/DEAD染色結果(圖3)顯示,對照組與實驗組(Ferumoxytol和PLL-Ferumoxytol組)細胞均保持了較高的活性,而純PLL(濃度分別為2、11、19 μg·ml-1)則會抑制細胞增殖和生存。因此,我們認為本研究中使用的Ferumoxytol和PLL-Ferumoxytol具有良好的生物相容性。

圖2 MIN6細胞增殖檢測 CCK-8法檢測與納米粒子共孵育24、48、72 h后對MIN6細胞增殖的影響。n=9,細胞與200 μg·ml-1 PLL-Ferumoxytol共孵育24 h后,細胞增殖率高于對照組(a P<0.05)
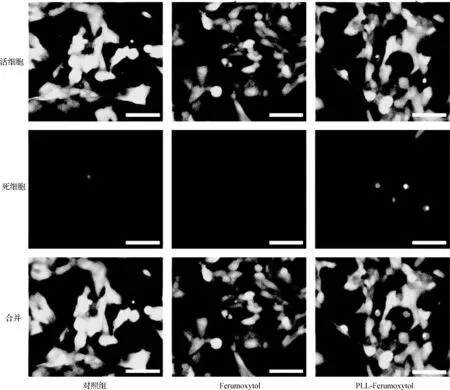
圖3 MIN6細胞活性表征 與Ferumoxytol、PLL-Ferumoxytol(800 μg·ml-1)共培養24 h后的細胞活性分析,染綠色為活細胞,染紅色為死細胞(標尺:50 μm)
2.3 F-肌動蛋白絲和細胞核染色
與對照組相比,納米顆粒處理的細胞進行鬼筆環肽染色后,未顯示出其F-肌動蛋白細胞骨架特性具有顯著差異。因此我們認為,納米顆粒可以保護并幫助維持MIN6細胞的結構。用Hoechst 33342染色法觀察納米顆粒處理后細胞的核形態變化和核濃縮,結果(圖4)顯示,核呈圓形,無核濃縮,表明沒有凋亡細胞。
2.4 細胞攝取和普魯士藍染色
將MIN6細胞與Ferumoxytol和PLL-Ferumoxytol(濃度分別為200、500、800 μg·ml-1)共孵育24 h,對細胞進行普魯士藍染色(圖5A)檢驗細胞的鐵攝取。結果顯示,與PLL-Ferumoxytol共培養的細胞被染成藍色,而與Ferumoxytol共培養的細胞則沒有表現出對鐵納米粒子的攝取,說明僅與Ferumoxytol共孵育24 h不足以標記細胞。此外,TEM觀察結果證實,MIN6細胞內部存在氧化鐵納米顆粒。 在不同的細胞結構中都能發現納米顆粒,主要在溶酶體中觀察到較多納米顆粒,其余能夠觀察到納米顆粒附著在細胞膜上或被困在細胞之間(圖5B、C、D)。
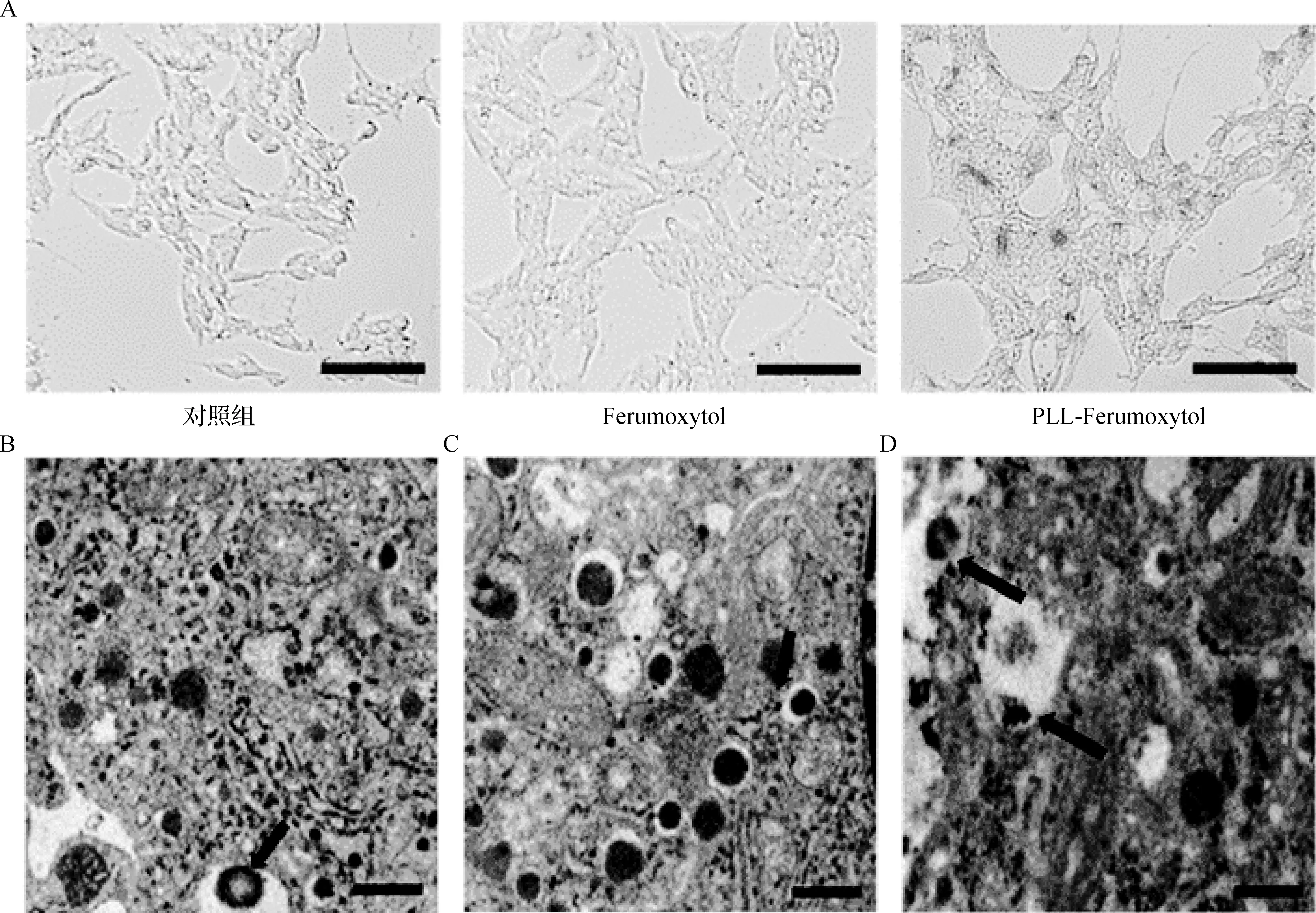
圖5 普魯士藍染色及TEM表征 將MIN6細胞分別與Ferumoxytol和PLL-Ferumoxytol(800 μg·ml-1)在24孔中共培養24 h,然后用Perl的普魯士藍染色法進行染色 (標尺:50 μm),孵育24 h后,MIN6細胞的TEM圖像(A);箭頭指向含有納米顆粒的溶酶體(B)、胰島素囊泡(C)及附著在細胞膜和溶酶體上的納米顆粒(D)(標尺:0.5 μm)
2.5 GSIS結果分析
分別培養24、48、72 h后,通過在低糖基礎條件(2 mmol·L-1)和高糖刺激條件(20 mmol·L-1)下培養樣品,研究響應葡萄糖刺激的MIN6細胞胰島素分泌。結果表明,在刺激性高濃度葡萄糖條件下,與200 μg·ml-1PLL-Ferumoxytol共培養的細胞釋放的胰島素量顯著增加(P<0.05,圖6A)。并且涂覆PLL和未涂覆PLL的納米顆粒處理的細胞之間胰島素合成量沒有顯著差異(圖6B)。上述結果表明,與納米顆粒共培養后,MIN6細胞仍然對葡萄糖具有響應性。
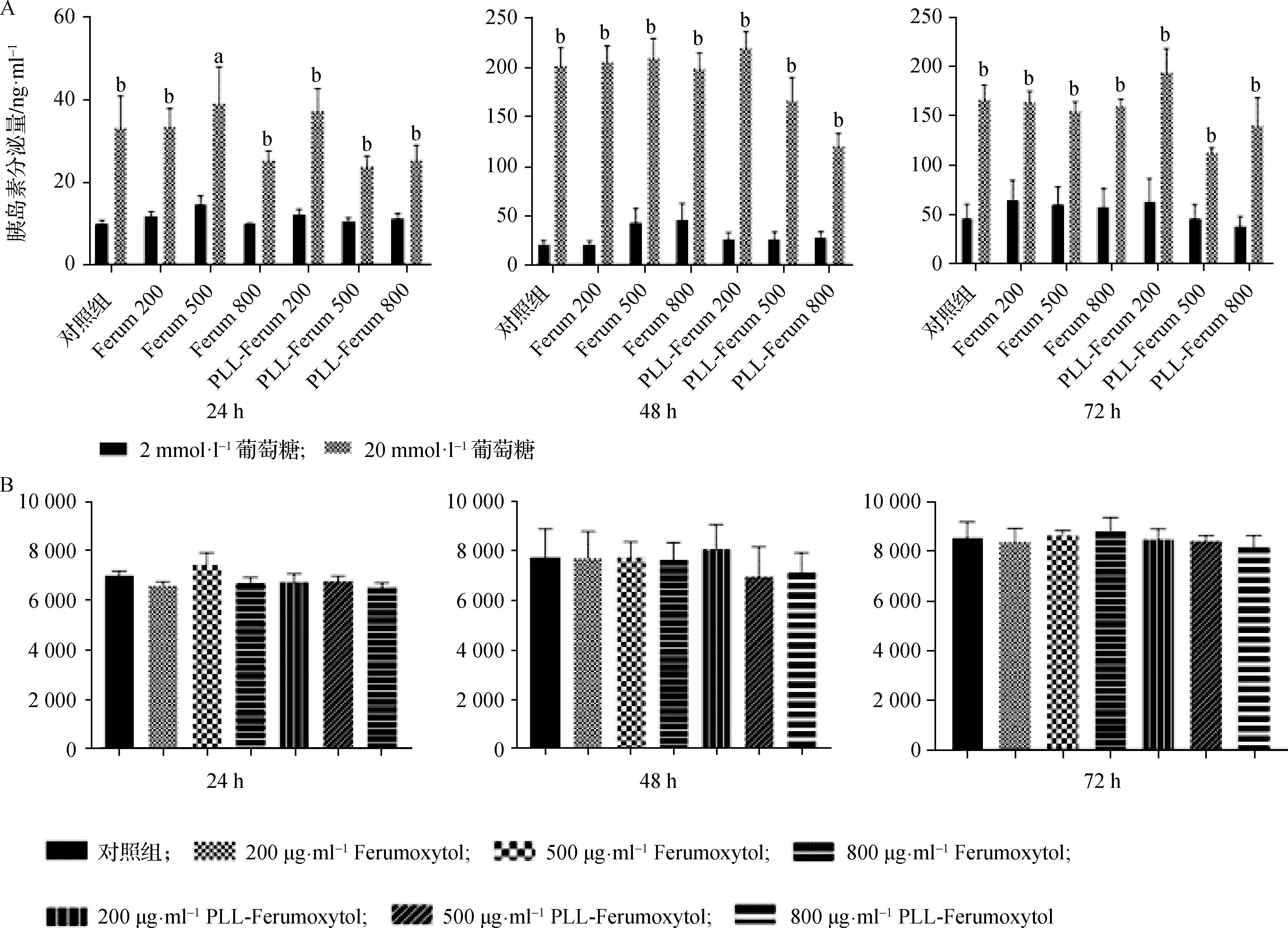
圖6 GSIS及合成量檢測 分別與200、500、800 μg·ml-1 Ferumoxytol和PLL-Ferumoxytol共孵育24、48、72 h 后,對MIN6細胞進行GSIS和胰島素抽提實驗,低糖及高糖處理組胰島素分泌量(A)及胰島素合成量(B)比較(n=9),高糖(20 mmol·L-1)處理組胰島素分泌量高于低糖(2 mmol·L-1)處理組(a P<0.05;b P<0.01)
3 討 論
目前,糖尿病的傳統治療方案主要為終身注射胰島素以及服用口服降糖藥物,但是由于血糖水平難以控制,胰島素劑量或者藥物使用不當,不能完全達到理想的治療效果[9]。胰島移植技術為患者提供了一種風險較小且療效更好的替代療法。對移植物進行有效、無創的活體示蹤是胰島移植成功的保障。在胰島中,胰島β細胞是已知的產生胰島素的唯一內分泌細胞,胰島β細胞功能障礙甚至被認為是糖尿病發生的根本原因[10]。因此,本研究中我們將MIN6細胞與Ferumoxytol納米顆粒共培養,然后評估納米顆粒與細胞之間的相互作用,并對細胞增殖和細胞活性進行檢測。研究發現,應用PLL作為轉染劑介導并增強了PLL-Ferumoxytol對MIN6細胞的標記效率。實驗結果表明,PLL-Ferumoxytol具有良好的生物相容性。通常,納米顆粒在不同類型細胞中的內化具有時間依賴性,并且達到最大飽和點時攝取會趨于平穩,進行納米顆粒攝取后細胞的活力預計也會隨著時間而降低[11]。已有研究說明SPIO標記對人骨髓間充質干細胞(BMSC)的功能作用,并表明帶有或不帶有TA的SPIO標記不會顯著影響充質干細胞(MSC)的分化或活性[12]。
肌動蛋白的細胞骨架是一種動態結構,會根據響應信號的變化而被重塑。在胰島β細胞中,F-肌動蛋白排列為質膜下的致密網絡結構,當葡萄糖刺激胰島素分泌后,其迅速解聚[13]。細胞骨架結構中的F-肌動蛋白絲是調節和維持細胞形態完整性的必要因素,因此,任何結構上的破壞都可能導致細胞骨架蛋白表達的改變。基因芯片分析顯示,人類原代成纖維細胞暴露于氧化鐵納米顆粒48 h后,可以上調與肌動蛋白重塑相關基因的表達[14]。此外,氧化鐵納米顆粒也被報道可以促進細胞信號相關基因(包括整聯蛋白亞基、酪氨酸激酶和蛋白激酶C家族成員)的表達增加,表明氧化鐵納米顆粒也可以影響信號轉導途徑[15]。與對照組相比,將氧化鐵納米顆粒處理的細胞F-肌動蛋白絲染色后,其F-肌動蛋白細胞骨架沒有顯著差異。但是,PLL會對細胞相互作用有關的基因下調產生某些影響,從而影響細胞的運動,因此必須對顯著增加的細胞外基質蛋白進行定量以確定其基質的重組。
用不同濃度的納米顆粒處理細胞后,細胞對PLL-Ferumoxytol內吞表明納米顆粒可能與分泌胰島素的囊泡有一些相互作用。典型的普魯士藍染色能夠證明鐵在β細胞以及其他類型細胞中的堆積,鐵的吸收主要與幾種類型細胞的內吞作用有關。最近有文獻報道,商業化的Resovist(羧基葡聚糖包被的SPION)處理胰島細胞可以作為MRI造影劑。納米粒子標記對MIN6細胞的胰島素合成與分泌功能無顯著影響,證明了其良好的生物安全性[16]。鐵的超負荷可能影響胰島素的分泌,葡萄糖轉運蛋白4(GLUT4)的表達水平對促進葡萄糖擴散很重要[13]。攝取鐵氧化物納米顆粒的主要機制是內吞作用,而胰島素則通過胞吐作用分泌[17],因此可以猜測胰島素分泌也可能會受納米顆粒的代謝與胰島素囊泡之間的相互作用影響,這需要進一步進行研究。
SPIONs作為較為理想的細胞磁標記物,在對移植物的移植后活體示蹤領域具有廣闊的應用前景。本研究中將PLL與Ferumoxytol結合,制備的PLL-Ferumoxytol具有良好的生物相容性及生物安全性,對于MIN6細胞的形貌、活性、增殖和胰島素合成與分泌功能沒有顯著影響,并且相較單純的Ferumoxytol具有更高的細胞標記率。

