補腎益氣活血方對胚胎著床障礙大鼠子宮內膜孕激素受體和信號傳導與活化轉錄因子3表達的影響
鐘志艷 黃冬梅 黃光英
胚胎著床是制約體外受精—胚胎移植(in vitro fertilization and embryo transfer, IVF-ET)成功的關鍵因素,其中子宮內膜容受性發揮著重要作用。卵巢甾體激素、各類細胞因子、轉錄因子以及血管活性物質在調節子宮內膜著床微環境中扮演重要角色,其中孕激素是著床所必需的,其功能主要由孕激素受體介導,通過促進子宮內膜蛻膜化的改變,促進胚胎著床。胚胎著床過程中,類固醇激素對子宮內膜的作用受到許多重要的細胞因子和(或)生長因子調節,其中如白介素-6(interleukin 6, IL-6)家族中多種細胞因子:白介素-11(interleukin 11, IL-11)、白血病抑制因子(leukaemia inhibitory factor, LIF)等,它們被證實與胚胎著床過程關系密切;其均通過gp130受體進行胞內信號傳遞,并介導信號傳導與活化轉錄因子3(signal transducer and activator of transcription 3, STAT3)的激活[1]。STAT3作為STAT家族中的重要成員,是一種具有轉錄作用的蛋白質,在調控細胞生長、增殖、分化及免疫活動中具有重要作用。實驗研究發現,STAT3及其下游通路對人類子宮內膜基質細胞的增殖和分化至關重要[2];條件性敲除子宮內膜上皮細胞的STAT3基因,雌性小鼠表現為不孕[3]。課題組前期臨床實踐[4]發現補腎益氣活血方能促進多次人工輔助生殖治療失敗的患者受孕;且動物實驗研究[5]表明,補腎益氣活血方能通過調節胚泡著床障礙小鼠雌孕激素及其受體的表達,促進胚胎著床。基于上述文獻調研及結果,本研究進一步探討補腎益氣活血方對胚胎著床障礙大鼠孕激素受體(progesterone receptor, PR)和STAT3的影響。通過采用米非司酮誘導的胚胎著床障礙大鼠模型,觀察補腎益氣活血方對模型大鼠子宮內膜PR和STAT3表達的影響,探討補腎益氣活血法促進胚胎著床的分子機制。
1 材料與方法
1.1 實驗動物
選用性成熟、未孕SPF級Wistar雌鼠,體重220~240 g;成年、性成熟SPF級Wistar雄鼠,體重250~300 g;所需動物全部來自于湖北省衛生與疾病防控中心,許可證號為SCXK(鄂)2015-0018。
1.2 主要藥品和試劑
米非司酮(華潤北京紫竹制藥公司,規格25 mg/片)由同濟醫院藥房提供,片劑碾碎后溶于無水乙醇,繼而懸浮于食用芝麻油溶液,制配為2 mg/mL的米非司酮—芝麻油懸液。補腎益氣活血方(桑寄生18 g、黃芪14 g、當歸9 g、川芎9 g、丹參9 g)免煎顆粒由同濟醫院中藥房提供,用無菌蒸餾水配成1.35 g/mL生藥濃度的無菌制劑,4℃保存。黃體酮注射液(浙江仙琚制藥股份有限公司,規格1 mL∶10 mg)由同濟醫院藥房提供。大鼠孕激素酶聯免疫吸附實驗試劑盒(EHC9030)購自武漢欣博盛公司,DAB顯色試劑盒及Cocktail蛋白酶抑制劑由武漢谷歌生物科技有限公司提供;組織總蛋白提取試劑盒以及BCA蛋白溶度測定試劑盒由武漢博士德公司提供。設計引物、提取組織總RNA的Trizol提取試劑盒、反轉錄試劑盒(RR036A)、SYBR熒光定量試劑盒(RR420A)、RNA酶游離水購自Takara公司。兔抗大鼠PR多克隆抗體(DF6829)購自美國Affinity生物技術公司;兔抗大鼠STAT3(4904)單克隆抗體購自美國CST公司;兔抗大鼠GADPH內參(ab37168)多克隆抗體購自美國Abcam公司;熒光素標記的羊抗兔熒光二抗(072071506)購自KPL公司。
1.3 主要設備與儀器
各規格微量加樣槍(德國Eppendorf),4℃、-20℃、-80℃冰箱(中國海爾),制冰機(日本松下),純水系統(美國Millipore),電泳槽、電泳儀及轉膜槽(美國Bio-Rad),光學顯微鏡(日本奧林巴斯),核酸蛋白質分析儀(美國Quawell),PCR擴增儀(德國耶拿),一步法實時熒光定量PCR儀(美國ABI),Quantityone分析軟件(北京六一廠),酶標儀(美國Bio Tek),佳能350 d顯微照相系統(日本佳能),雙色近紅外激光掃描攝像系統(美國Odyssey)。
1.4 動物分組與處理
所有大鼠在適應性喂養一周后,連續觀察雌鼠兩個動情周期,動情周期正常則納入實驗。將處在動情前期的雌鼠和雄鼠于下午6點按2∶1進行合籠交配,次日上午8點觀察陰道涂片,以出現大量精子者記錄為懷孕第1天。將全部孕鼠隨機分為正常組、模型組、中藥組和黃體酮組,其中正常組10只,模型組22只,中藥組15只,黃體酮組13只。除正常組外,其余三組在懷孕第3天上午9點皮下注射5.5 mg/kg米非司酮—芝麻油懸液進行造模處理,正常組則皮下注射等體積芝麻油溶液。中藥組于造模當日下午4點開始每日給予補腎益氣活血方灌胃(根據人-大鼠體表面積換算,每只大鼠每次給予2.3 mL灌胃)直至處死前一天,與此同時,黃體酮組每日給以黃體酮注射液20 mL/kg(0.5 mL/只)肌肉注射直至處死前一天。
1.5 標本收集與指標檢測
各組大鼠于懷孕第8天下午4點用1%的戊巴比妥腹腔麻醉后進行剖腹。觀察并記錄子宮的顏色、形態、胚泡大小及數目,經腹主動脈采血留取血液標本后摘取子宮標本,記錄每只大鼠妊娠情況及著床胚胎個數。血液標本經3000 r/min,離心15分鐘后獲取血清,分裝后存于-80℃冰箱,用于ELISA檢測。根據ELISA試劑盒使用說明檢測各組大鼠血清孕酮水平,RT-PCR法檢測各組大鼠子宮內膜PR和STAT3 mRNA的表達,Western blot法檢測各組大鼠子宮內膜PR及STAT3蛋白表達。
1.5.1 ELISA檢測血清孕酮水平 嚴格按照ELISA試劑盒的使用說明和操作步驟,檢測各組大鼠血清孕酮水平。ELISA試劑盒的檢測范圍為0.5~30 ng/mL,靈敏度為0.2 ng/mL,組內及組間變異系數不超過15%。
1.5.2 RT-PCR檢測子宮內膜中PR及STAT3 mRNA含量 從-80℃冰箱中取出適當保存的子宮胚胎標本,在冰面上解凍數分鐘后,將組織放入無菌的一次性培養皿中,刮取子宮內膜組織(第8天子宮組織在體視顯微鏡下小心去除胚胎),加入1 mL預冷的Trizol裂解液,在冰上充分碾磨,按試劑盒說明書步驟提取內膜組織總RNA,各管取2 μL檢測樣本RNA的純度和濃度,A260/A280在1.8~2.0便可進入下一步逆轉錄過程。根據公式(2 μg樣本=濃度μg/μL×體積20μL=樣本體積+ Mix體積+ dH2O體積)計算出樣本和dH2O的體積,進行逆轉錄反應。用逆轉錄所得的cDNA做模板,進行RT-PCR擴增,SYBR?Premix Ex TaqTM(2×) 10 μL、Rox Reference Dye(50×) 0.4 μL、稀釋后上游引物(10μm) 0.4μL、稀釋后下游引物(10 μm) 0.4μL、cDNA 2 μL和RNase-Free H2O組成20 μL反應體系,每個樣本做3個平行復孔,以β-actin為內參。采用Comparative Delta-delta CT法,每個標本的相對RNA含量通過2-ΔΔCT計算得到。具體引物序列見表1。

表1 引物序列
1.5.3 Western blot檢測子宮內膜中PR及STAT3蛋白表達 從-80℃冰箱中取除凍存的子宮胚胎標本,在冰上解凍數分鐘后,于冰上將組織置于無菌的一次性培養皿中,刮取子宮內膜組織(第8天子宮組織在體視顯微鏡下小心去除胚胎),按1 mL∶20 μL∶10 μL的比例配備組織蛋白提取液、蛋白酶抑制劑及PMSF的混合液,子宮內膜組織與該混合液與按1∶10加入。在冰面靜置30分鐘后,經4℃低溫離心機獲取上清液,轉速12000 r/min,離心15分鐘。經BCA蛋白濃度測定試劑盒測定樣品蛋白濃度后,每個蛋白提取物樣品大致定容,再加1/4體積的上樣緩沖液,煮沸10分鐘蛋白變性,所得樣品分裝后保存在-80℃冰箱。制備10%SDS-PAGE膠,加樣后進行電泳,先80伏特30分鐘而后120伏特1小時跑膠,將跑膠后分離的目的蛋白轉移到PVDF膜上,在室溫條件下,經過5%的脫脂牛奶封閉2小時后,去除多余牛奶,給予相應一抗于4℃冰箱孵育過夜。PR、STAT3和GAPDH(內參)的一抗稀釋濃度分別為1∶1000、1∶2000、1∶5000。第二天PBST洗5次,每次10分鐘,避光加入恰當的熒光二抗(按1∶10000稀釋)室溫孵育1小時,PBST避光洗4次,每次5分鐘,用雙色近紅外激光攝像系統掃膜。所得圖片用Image J計算灰度比值。
1.6 統計學處理
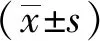
2 結果
2.1 各組大鼠胚胎著床情況比較
肉眼觀察可見正常組子宮血供豐富,胚泡呈串珠狀隆起,大小均等,分布均勻;模型組子宮蒼白,部分子宮腔變細,胚泡數減少,胚泡較多融合;中藥組子宮血供較模型組豐富,胚泡數較模型組增多,胚泡大小及分布較為均等;黃體酮組子宮血供較為豐富,但不及正常組,胚泡數較模型組增多,胚泡大小及分布較模型組均勻。見圖1。與正常相比,模型組懷孕率明顯下降(P<0.05),平均著床胚胎數明顯減少(P<0.05);與模型組比較,中藥組和黃體酮組懷孕率及平均著床胚胎數均明顯增加(P<0.05);與黃體酮組相比,中藥組妊娠情況無顯著性差異(P>0.05)。見表2。

注:A:正常組;B:模型組;C:中藥組;D:黃體酮組。
圖1各組胚胎著床障礙大鼠第8天子宮形態圖
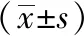
表2 各組胚胎著床障礙大鼠第8天 懷孕率及平均著床胚胎數比較
注: 與正常組相比,aP<0.05;與模型組相比,bP<0.05。
2.2 各組胚胎著床障礙大鼠血清孕酮含量比較
與正常組比較,模型組血清孕酮含量明顯下降(P<0.05);與模型組相比,中藥組和黃體酮組血清孕酮含量均顯著增加(P<0.05);與黃體酮組比較,中藥組血清孕酮含量明顯降低(P<0.05)。見表3。
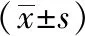
表3 各組胚胎著床障礙大鼠血清孕酮含量比較
注: 與正常組相比,aP<0.05;與模型組相比,bP<0.05;與黃體酮組相比,cP<0.05。
2.3 各組胚胎著床障礙大鼠子宮內膜中PR及STAT3的mRNA表達情況
與正常組相比,模型組子宮內膜PR mRNA表達顯著降低(P<0.05),STAT3 mRNA表達無顯著差異(P>0.05);與模型組相比,中藥組子宮內膜PR mRNA表達顯著增加(P<0.05),STAT3 mRNA表達無顯著差異(P>0.05),與模型組相比,黃體酮組子宮內膜PR及STAT3 mRNA表達均無顯著差異(P>0.05);與黃體酮組相比,中藥組子宮內膜PR及STAT3 mRNA表達均無顯著差異(P>0.05)。見表4。
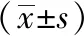
表4 各組胚胎著床障礙大鼠子宮內膜中PR及STAT3 的mRNA表達比較
注: 與正常組相比,aP<0.05;與模型組相比,bP<0.05。
2.4 各組胚胎著床障礙大鼠子宮內膜PR及STAT3蛋白表達情況
與正常組相比,模型組子宮內膜PR及STAT3蛋白表達均顯著降低(P<0.05);與模型組比較,中藥組和黃體酮組子宮內膜PR及STAT3蛋白表達顯著增加(P<0.05)。與黃體酮組相比,中藥組子宮內膜PR及STAT3蛋白表達無顯著差異(P>0.05)。見圖2表5。

注:N:正常組;M:模型組;BR:中藥組;P:黃體酮組。
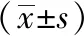
圖2 各組胚胎著床障礙大鼠子宮內膜PR 及STAT3蛋白表達(Western blot)表5 各組胚胎著床障礙大鼠子宮內膜中PR 及STAT3蛋白表達比較
注: 與正常組相比,aP<0.05;與模型組相比,bP<0.05。
3 討論
眾所周知,孕激素是維持妊娠的重要激素;在胚胎著床過程中,孕激素是子宮內膜轉化為分泌組織的必備因素,其有利于胚胎的黏附及維持黏附之后的蛻膜化反應[6]。孕激素的效應主要由PR介導,PR缺失的雌性小鼠表現為不孕,并在子宮和卵巢功能方面有著不同程度的缺陷。米非司酮作為PR的競爭性拮抗劑,能阻斷孕激素的靶效應從而干擾著床。胚胎著床前期米非司酮的應用,可阻滯子宮內膜的發育,導致子宮內膜與胚胎發育不同步,而影響著床。在嚙齒動物中,胚胎著床發生于懷孕的第4天傍晚至第5天凌晨[7],此時子宮內膜在雌、孕激素等的調節下,發生一系列復雜而精密的變化,為胚胎植入創造適宜的微環境。大鼠妊娠第3天,發育良好的胚泡開始移行于子宮腔,此時皮下注射米非司酮可排除其對胚胎本身發育及輸卵管運動的影響,較好地建立大鼠胚胎著床障礙動物模型[8]。此外,此模型可以較好地模仿IVF-ET過程中子宮內膜容受性低下的狀態,為進一步探討有關機制并尋求解決手段提供基礎。
一般認為,IL-6家族細胞因子對于胚胎植入的意義重大[9]。STAT3是IL-6家族細胞因子活化的重要通路和中心環節,STAT3的活化能幫助提高子宮內膜容受性[10]。此外,有研究[11]表明,STAT3通過蛋白質-蛋白質的相互作用協同PR在胚胎著床中發揮重要作用。本研究著眼于PR及STAT3在胚胎著床中的作用,探討補腎益氣活血方對胚胎著床障礙大鼠子宮內膜PR及STAT3表達的影響,結果顯示,模型組大鼠第8天子宮內膜PR及STAT3蛋白表達顯著減少,提示米非司酮所致的大鼠胚胎著床障礙通過降低PR及STAT3蛋白表達而減少著床,而補腎益氣活血方能顯著增加子宮內膜PR及STAT3蛋白表達,促進基質細胞蛻膜化,從而促進胚胎著床。各組STAT3 mRNA表達雖無統計學差異(可能與樣本數有限以及動物個體差異過大有關),但模型組STAT3 mRNA含量低于其他三組,提示STAT3在促進胚胎著床、維持基質細胞蛻膜化中有著重要作用。模型組子宮內膜PR mRNA與正常組相比顯著降低,這與文獻[12]報道米非司酮能降低妊娠大鼠PR基因及蛋白的表達相一致。中藥組與模型組相比PR mRNA有顯著增加,而黃體酮組與模型組相比PR mRNA無統計學差異,提示補腎益氣活血方可能存在其他途徑改善子宮內膜PR基因表達。而補腎益氣活血方能顯著提高模型大鼠第8天子宮內膜PR的蛋白和mRNA表達,表明該方改善胚胎著床的效應與增加子宮內膜PR表達密切相關。
補腎益氣活血方以補腎為立方之本,兼以益氣、活血,其中桑寄生等補腎固沖之要藥,有取自古方壽胎丸之意;另有丹參、當歸活血養血,黃芪益氣以生血,全方發揮補腎、益氣、活血、安胎的功效。本實驗結果發現,給予補腎益氣活血方后,模型大鼠懷孕率及平均著床胚胎數均顯著增加,子宮內膜發育趨于同步化,且血清孕酮水平、子宮內膜PR及STAT3表達顯著提高,表明補腎益氣活血方在一定程度能上提高子宮內膜PR及STAT3表達,改善子宮內膜容受性,促進胚泡成功著床。中藥組與黃體酮組相比,懷孕率、平均著床胚胎數及子宮內膜PR及STAT3表達差異無統計學意義;中藥組血清孕酮水平雖低于黃體酮組,但結合中藥組的懷孕率及平均著床胚胎數可推測:補腎益氣活血方可能不僅限于通過補充孕激素來改善胚胎著床。
綜上,補腎益氣活血方能改善大鼠胚胎著床及促進胚胎生長,其作用與改善子宮內膜PR及STAT3的表達密切相關,但二者的具體協同作用機理有待于進一步發掘證實。

