黃連素對阿爾茲海默癥大鼠學習記憶功能及海馬組織GSK3β、p-Tau蛋白表達的影響
周晶 董笑克 馬青科 金香蘭 張志辰
阿爾茲海默癥(alzheimer’s disease,AD)是一種在全球范圍內(nèi)常見的神經(jīng)退行性疾病,患者表現(xiàn)為記憶缺失、語言、定向力障礙、幻覺等,患者及家屬的生活質(zhì)量嚴重降低。目前,尚無有效的藥物預防或逆轉(zhuǎn)AD的發(fā)展。研究發(fā)現(xiàn),淀粉樣蛋白-β(amyloid-beta ,Aβ)激活絲氨酸蛋白激酶3β(serine protein kinase 3 β,GSK3β),上調(diào)的微管相關蛋白Tau蛋白過度磷酸化,是AD發(fā)病關鍵環(huán)節(jié)。中草藥及其提取物對AD的治療具有一定的優(yōu)勢,中藥抗AD有效物質(zhì)的篩選及其機制研究是AD治療研究的重點。中藥黃連提取物黃連素具有抗炎、抗氧化等作用,可有效地改善大鼠認知缺陷和記憶力。為了進一步探究黃連素治療AD的機制,本研究旨在通過阿爾茲海默癥大鼠模型,探究不同劑量黃連素對大鼠學習和認知功能的影響,并通過對AD發(fā)病的關鍵蛋白GSK3β、p-Tau表達量的檢測,闡釋黃連素治療AD的可能機制。
1 材料與方法
1.1 實驗動物
SPF級雄性wistar大鼠62只,6周齡,體重(220±20)g,購自北京維通利華實驗動物技術有限公司,動物許可證編號:SYXK(京):2019-0013。飼養(yǎng)于北京中醫(yī)藥大學東方醫(yī)院動物中心,飼養(yǎng)級別為SPF級,5只/籠,保證正常光照節(jié)律、溫度適度、環(huán)境安靜,正常大鼠生長繁殖飼料飼養(yǎng),自由進食和飲水。
1.2 藥物及試劑
鹽酸小檗堿(黃連素),成都錦華藥業(yè)有限公司生產(chǎn),批號:180613;Aβ25-35,美國Sigma公司生產(chǎn),批號:053M4804V,注射前用生理鹽水將Aβ25-35配制為10 μg/μL的溶液,在37℃ 孵育1周;重組Anti-GSK3 beta抗體(Y174),abcam公司,貨號:ab32391;重組Anti-Tau (phospho S396)抗體,abcam公司,貨號:ab109390。
1.3 主要試驗儀器
WMT-100 Morris水迷宮視頻跟蹤系統(tǒng),成都泰盟科技有限公司;大鼠數(shù)顯腦立體定位儀,北京眾實迪創(chuàng)科技發(fā)展有限公司,規(guī)格:ZS-B/S;微量注射針Trajan Scientific and Medical(SGE),規(guī)格:10 μL;實驗動物飲水機(MN-LM500J),北京木牛流馬凈化工程技術有限公司;SDS-PAGE電泳系統(tǒng),美國BIO-Rad公司;凝膠成像系統(tǒng),美國UVP公司。
1.4 造模與給藥方法
所有大鼠適應性飼養(yǎng)一周后,隨機分為假手術組、模型組,黃連素低劑量組、黃連素中劑量組、黃連素高劑量組,假手術組10只,其余每組各13只。假手術組大鼠注射生理鹽水,其余各組大鼠腹腔注射D-半乳糖,100 mg/kg,每日1次,共注射6周。連續(xù)注射D-半乳糖2周后,黃連素低、中、高劑量組分別給予黃連素50 mg/kg、100 mg/kg、150 mg/kg灌胃,其余大鼠給予等體積生理鹽水灌胃,干預4周。注射第3周時,1%戊巴比妥鈉腹腔注射40 mg/kg麻醉大鼠。在大鼠腦立體定位儀下,自顱頂前囟向后4.4 mm、旁開 2.2 mm,硬腦膜下3.0 mm,微量注射泵緩慢注射Aβ25-3510 μg于一側海馬,留針5分鐘,同樣方法將等劑量Aβ25-35注入對側海馬[1]。假手術組大鼠同方法注射等量生理鹽水。注射后大鼠傷口縫合,術區(qū)消毒。術后每天碘伏傷口消毒,連續(xù)3天。造模7天后進行水迷宮學習記憶能力測試,以第5天假手術組大鼠逃避潛伏期均值為參考值,若各造模大鼠平均逃避潛伏期與參考值之差占該鼠平均逃避潛伏期的比值>20%則表示造模成功[2]。模型組和黃連素低、中、高劑量組各有3只造模失敗,剔除。
1.5 觀察指標與檢測方法
1.5.1 Morris水迷宮實驗 大鼠藥物干預4周后,進行為期7天的Morris水迷宮行為學檢測,其中第1~6天為定位航行實驗,第7天為空間探索實驗。第1~2天進行訓練,每日上午、下午(間隔兩小時以上)固定時間訓練,記錄大鼠找到平臺所需時間,即逃避潛伏期,并記錄大鼠線路圖、總路程等。若大鼠90秒內(nèi)不能找到平臺,將其引導至平臺,在平臺停留15秒后放回籠中,記錄該大鼠的逃避潛伏期為 90秒。第3~6天,在固定時間將大鼠背對平臺分別從對側象限及相鄰象限放入池中,每天兩次,記錄逃避潛伏期。第7天,撤掉平臺,將大鼠從對側象限放入水池,記錄90秒內(nèi)大鼠穿越原平臺位置次數(shù)、中心區(qū)域值、中環(huán)區(qū)域值等。
1.5.2 海馬組織GSK3β及p-Tau蛋白表達 水迷宮結束后,各組大鼠麻醉,取雙側新鮮海馬迅速凍存于液氮中,進行Western Bolt檢測。實驗流程見圖1。
1.6 統(tǒng)計學處理
2 結果
2.1 各組阿爾茲海默癥大鼠死亡情況
術后模型組、黃連素低、高劑量組各死亡1只,死亡原因為手術損傷。
2.2 各組阿爾茲海默癥大鼠Morris水迷宮實驗結果分析
2.2.1 游泳路徑圖 對比各組大鼠游泳路徑線路圖(見圖2),假手術組以趨向式、直線式為主,模型組以隨機式、邊緣式為主,黃連素低劑量組以隨機式、趨向式為主,黃連素中劑量組以趨向式、隨機式為主,黃連素高劑量組以趨向式、直線式為主。
2.2.2 定位航行實驗 取第6天各組大鼠兩次逃避潛伏期、總路程平均值進行分析。與假手術組相比,模型組、黃連素低中劑量組逃避潛伏期、總路程顯著增加(P<0.01),與模型組相比,黃連素高劑量組逃避潛伏期、總路程顯著降低(P<0.01)。見表1。
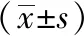
表1 各組阿爾茲海默癥大鼠定位航行實驗逃避潛伏期、 總路程對比
注: 與假手術相比,aP<0.05,bP<0.01;與模型組相比,cP<0.05,
dP<0.01。
2.2.3 空間探索實驗 各組大鼠第一次穿越目標區(qū)域時間對比:與假手術組相比,其余四組第一次穿越目標區(qū)域時間均顯著增高(P<0.01),與模型組相比,黃連素中、高劑量組第一次穿越目標區(qū)域時間降低(P<0.05,P<0.01)。各組大鼠中心區(qū)域值無顯著差異(P>0.05)。各組大鼠中環(huán)區(qū)域?qū)Ρ龋耗P徒M、黃連素中高劑量組中環(huán)區(qū)域顯著低于假手術組(P<0.01,P<0.05),與模型組相比,低劑量組中環(huán)區(qū)域數(shù)值增加(P<0.05)。各組大鼠穿越目標區(qū)域次數(shù)對比:模型組、黃連素低劑量組穿越次數(shù)顯著低于假手術組(P<0.01),與模型組相比,黃連素中、 高劑量組穿越次數(shù)顯著增加(P<0.05,P<0.01)。
2.3 各組阿爾茲海默癥大鼠海馬組織GSK3β、p-Tau蛋白表達
各組大鼠海馬組織GSK3β蛋白表達:與假手術組相比,其余各組GSK3β蛋白表達均顯著升高(P<0.01);與模型組相比,黃連素中、高劑量組GSK3β蛋白表達下降(P<0.05,P<0.01)。各組大鼠海馬組織p-Tau蛋白表達:與假手術組相比,模型組、黃連素低、中劑量組p-Tau蛋白表達均顯著升高(P<0.01);與模型組相比,高劑量組p-Tau蛋白表達下降(P<0.05)。見圖3、表3。
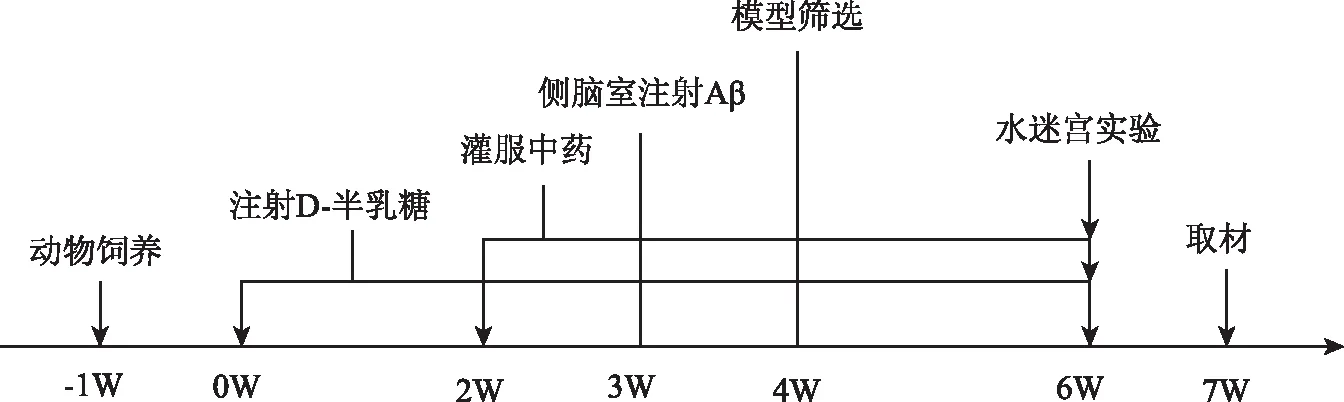
圖1 實驗流程圖
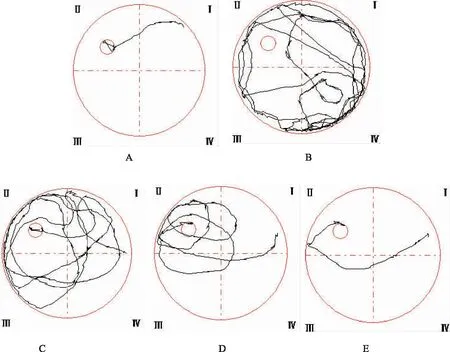
注:A 假手術組;B模型組;C 黃連素低劑量組;D 黃連素中劑量組;E 黃連素高劑量組。
圖2各組大鼠游泳軌跡圖
表2 各組阿爾茲海默癥大鼠空間探索實驗分析
注: 與假手術相比,aP<0.05,bP<0.01;與模型組相比,cP<0.05,dP<0.01。
表3 各組阿爾茲海默癥大鼠GSK3β、p-Tau蛋白 表達結果比較
注: 與假手術相比,aP<0.05,bP<0.01;與模型組相比,cP<0.05,
dP<0.01。
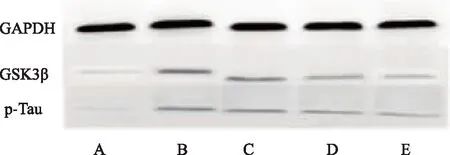
注:A假手術組;B模型組;C黃連素低劑量組;D黃連素中劑量組;E黃連素高劑量組。
圖3各組阿爾茲海默癥大鼠腦組織GSK3β、p-Tau蛋白表達
3 結論
阿爾茲海默癥是全球癡呆最常見的類型,約占癡呆癥主要原因的70%[3],全球約有4000萬人患有AD,并且AD的患病率逐年上漲[4]。AD患者自身承受著巨大的痛苦,此外,對于家庭和社會都造成了巨大的經(jīng)濟負擔。AD典型病理改變?yōu)槟X組織中大量Aβ斑塊的積累[5],以及神經(jīng)細胞內(nèi)產(chǎn)生神經(jīng)纖維纏結(neurofilament tangle,NFT)。目前認為其產(chǎn)生機制主要為Aβ抑制AKT的磷酸化[6],從而減少GSK-3磷酸化失活,增加活性的GSK-3,促進Tau過度磷酸化,從微管脫離,導致微管結構不穩(wěn)定,最終形成AD的標志性物質(zhì)NFT[7]。基于此,學者提出GSK3是Aβ和tau橋梁[8]。針對于Aβ研發(fā)的靶向藥物都以失敗告終,研究發(fā)現(xiàn),影響AD進展的主要因素是Tau而不是Aβ[3]。因此,尋找選擇性抑制GSK3的藥物有望有效延緩AD進展,是目前AD治療的熱點。
阿爾茲海默癥屬中醫(yī)“呆病”“癡呆”“善忘”等范疇,多認為其與痰濁、瘀血、腎虛、抑郁及情志因素密切相關。部分學者提出癡呆與“熱”“毒”有關,并用清熱解毒法治療癡呆取得了良好的效果[9-10]。大量的臨床及實驗研究均證實了黃連解毒湯等清熱解毒方劑及中藥對癡呆的療效[11-12]。此外,對中醫(yī)治療健忘或癡呆的中藥方劑進行用藥規(guī)律分析,發(fā)現(xiàn)重補虛藥、安神藥、清熱藥,其中清熱藥的核心藥物為甘草、生地及黃連[13]。
黃連素是中藥黃連的主要有效成分之一,除抗菌、抗炎、降糖、降脂、抗氧化、抗抑郁等作用之外,研究發(fā)現(xiàn)黃連素還有治療阿爾茲海默癥的潛力[14]。對記憶缺陷的動物,黃連素具有顯著的改善大/小鼠記憶力的作用[15]。研究發(fā)現(xiàn),黃連素可以減輕突觸損傷[16],通過部分抑制凋亡級聯(lián)、神經(jīng)炎癥、氧化應激來部分改善LPS誘導的大鼠認知缺陷[17]。本研究中,通過Morris水迷宮實驗發(fā)現(xiàn),三種劑量的黃連素均能不同程度地改善阿爾茲海默癥大鼠逃避潛伏期、中環(huán)區(qū)域比例、游泳距離等指標,其療效與劑量呈正相關,150 mg/kg黃連素對大鼠學習及記憶能力改善更佳。對GSK3β、p-Tau蛋白表達的結果與行為學檢測結果一致,150 mg/kg黃連素對GSK3β、p-Tau蛋白表達具有最強的下調(diào)作用。
綜上所述,黃連素具有顯著的改善阿爾茲海默癥模型大鼠學習和記憶能力的作用,療效與用量成正相關,其機制與黃連素降低活性GSK3β蛋白含量,抑制Tau磷酸化相關。

