犬干擾素的中試生產工藝及臨床前研究
趙明 蔣貽海 魏波 曲信芹
犬干擾素的中試生產工藝及臨床前研究
趙明①蔣貽海③魏波②曲信芹③
(①青島蔚藍生物制品有限公司 山東 青島 266114 ②青島動保國家工程技術研究中心有限公司 山東 青島 ③青島蔚藍生物股份有限公司 山東 青島)
為了探索基因工程重組犬干擾素500L發酵罐中試規模生產工藝的建立以及犬干擾素的臨床評價而進行了研究;結果表明,中試生產得到的犬干擾素純度為98.4%,比活性為2.97×106U/mg,內毒素含量為19IU/ml,符合產業化要求。
重組犬干擾素 中試 生產工藝
干擾素(INF)是由Isasscs等在進行雞胚細胞流感病毒感染試驗中首次發現的一類能干擾和抑制病毒復制的可溶性細胞分泌物,并將其命名為干擾素(interferon,INF)。干擾素是一種多功能的細胞因子家族中的一員,由干擾素誘生劑作用于細胞膜后,可使細胞產生一種特異因子,這種因子和細胞DNA中的干擾素基因抑制物結合,解除了干擾素基因的抑制作用,從而合成干擾素。干擾素作用的發揮是一個復雜的過程,通過 “INF系統”來實現,表現出一定的抗病毒、免疫調節、抗腫瘤、抗細菌和寄生蟲等作用。隨著人們對寵物疫病防治的關注,有效預防和治療寵物病毒性疾病成為研究的重點。Hiummler等(1987)首先對犬的INF-α基因進行了研究,并報道了犬INF-α基因序列。Devos K等(1992)克隆了犬INF-r基因,楊琪等(2002)克隆了犬INF-r cDNA,并用PRC/CMV2表達載體率先在鼠骨髓瘤細胞中進行表達,張海峰等(2005)實現了重組犬INF-r在大腸桿菌中的高效表達。犬干擾素無論是天然的還是重組的干擾素均具有較強的抗病毒能力,臨床上已經將重組的犬干擾素應用于防治狂犬病、犬細小病毒病、犬瘟熱、犬病毒性肝炎等病毒病。
本研究將本公司構建完成的基因工程重組犬干擾素pBV220-caIFN/ BL21(DE3)菌種,在前期完成的實驗室制備工藝的基礎上進行中試放大,按照GMP的相關要求進行試制,得到的犬干擾素純度為98.4%,比活性為2.97×106U/mg,內毒素含量為19EU/ml,適合產業化要求。
1 材料與方法:
1.1 材料
1.1.1 菌株、細胞株及毒株 pBV220-caIFN/ BL21(DE3)、MDCK細胞(犬腎細胞),VSV(水泡性口炎病毒)均為本實驗室保存。
1.1.2 儀器設備 生化培養箱、恒溫震蕩培養箱、500L發酵罐、管式離心機、大容量高速冷凍離心機、高壓勻漿細胞破碎儀、蛋白質電泳儀、磁力攪拌器、超濾濃縮裝置、BIAO-RAD BioLogic LP層析系統、恒溫水浴鍋、酶標儀
1.1.3 試劑耗材 胰蛋白胨、酵母提取物、氯化鈉、氨芐青霉素、磷酸氫二鈉、磷酸二氫鈉、氯化鉀、硫酸銨、咪唑、鱟試劑檢測試劑盒、Brandford法蛋白濃度檢測試劑盒、
1.2 方法
1.2.1 中試制備 將保存的凍干pBV220-caIFN/BL21(DE3)菌種,用無菌水混懸后,轉移至試管中37℃ 200rpm恒溫震蕩培養4h后劃線接種于LB Amp平板,37℃于生化培養箱中孵育過夜;挑單菌接種于5ml LB Amp培養基中37℃ 200rpm恒溫震蕩培養過夜作為一級種子;將活化好的pBV220-caIFN/ BL21(DE3)菌種轉接于3L LB Amp培養基中37℃ 200rpm恒溫震蕩培養過夜作為二級種子;將培養好的二級種子,1%接種于300L滅菌培養基的發酵罐中30℃發酵培養至OD為0.6~0.8時提高溫度至42℃進行誘導表達,繼續培養5~6h后停止發酵培養。
1.2.2 菌體回收 用管式離心機12000g 100L/h離心收集菌體后用10倍體積生理鹽水混懸菌體,菌懸液用大容量高速冷凍離心機4℃ 7000rpm 15min離心收集菌泥,保存于-20℃中備用。
1.2.3 菌體破碎 將保存好的菌泥用10倍體積的PBS混懸,于磁力攪拌器上攪拌均勻后,用高壓勻漿細胞破碎儀4℃, 800-1000 Bar, 10L/h破碎三次后用大容量高速冷凍離心機4℃ 7000rpm 15min離心收集沉淀。
1.2.4 純化分離 將沉淀用變性緩沖液(6mol/L鹽酸胍,5mmol/L EDTA,50 mmol/L Tris·HCl,10 mmol/L DTT,150mmol/L NaCl,pH9.0)溶解沉淀,4℃條件下,8000rpm 15min收集上清得到變性蛋白溶液,將變性蛋白溶液緩慢滴加到復性緩沖液(0.5mol/L L-Arg;2mmol/L EDTA,15%甘油;0.9mmol/L GSSG,50mmol/L Tris·HCl,150 mmol/L NaCl,pH8.0)中,4℃靜置48h,4℃條件下,8000rpm 15min收集上清,即為含有重組蛋白的溶液。將重組蛋白溶液加入等體積的飽和硫酸銨溶液于磁力攪拌器上攪拌均勻后室溫靜置沉降過夜,用大容量高速冷凍離心機4℃,9000 rpm,15min離心收集沉淀,沉淀用9倍體積的PBS混懸并加入1倍體積的飽和硫酸銨溶液于磁力攪拌器上攪拌均勻后室溫靜置沉降過夜后用大容量高速冷凍離心機4℃,7000rpm,15min離心收集上清;上清用0.45um的圓片膜過濾澄清后,5KD膜包超濾濃縮10倍后用PBS洗濾4次。所得濃縮液0.22um的圓片膜過濾澄清后用裝有chelating sepharose fastflow的XK26/20層析柱于BIAO-RAD BioLogic LP層析系統進行分離純化,純化所得樣品用5KDA膜包超濾用PBS洗濾4次并0.22um除菌過濾后得到半成品。
1.2.5 半成品檢驗 按照生物制品規程進行無菌檢驗和內毒素含量測定、總蛋白濃度測定、蛋白純度分析、犬干擾素α抗病毒比活性測定、用Western-BLOT法檢測特異性。并進行小鼠安全性試驗、實驗室犬安全性試驗及實驗室犬有效性試驗。
2 試驗結果
2.1 發酵培養
表達結果SDS-PAGE分析見圖1。
2.2 無菌檢驗實驗結果
根據《中華人民共和國曾藥典》,供試品在25℃和相對濕度60%±10%條件下抽樣檢測無細菌污染。
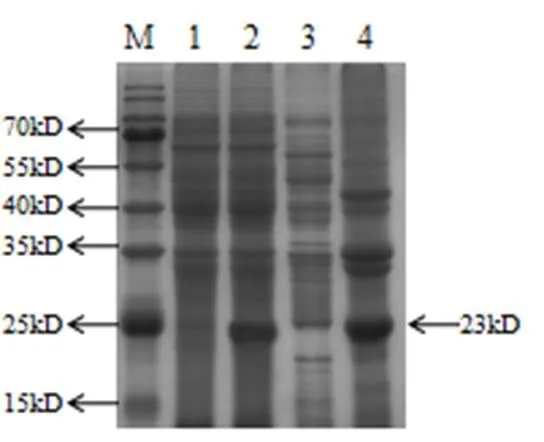
圖1 重組大腸桿菌表達形式鑒定
M:蛋白Marker;1:未誘導全菌;2:誘導全菌 3:裂解上清;4:沉淀
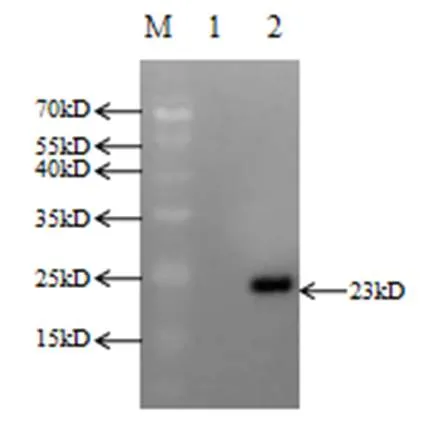
圖2 重組大腸桿菌表達產物特異性分析結果
M:蛋白Marker;1:未誘導對照;2:復性液
2.3 內毒素含量測定
根據《中華人民共和國獸藥典》,供試品在25℃和相對濕度60%±10%條件下抽樣檢測內毒素含量均低于20IU/ml,為19IU/ml。
2.4 總蛋白濃度、純度測定
根據《中華人民共和國獸藥典》,干擾素半成品用Bradford法測定總蛋白濃度為0.21mg/ml,SDS-PAGE分析后灰度掃描犬干擾素純度為98.4%。
2.5 犬干擾素α抗病毒比活性測定
參考Wish-VSV檢測方法和微量細胞病變抑制法,建立MDCK-VSV體系測定重組犬干擾素α抗病毒比活性,細胞系是MDCK細胞(犬腎細胞),病毒用VSV(水泡性口炎病毒)。測定方法用以細胞病變(CPE)抑制為基礎的抑制微量測定法。用含有10% FBS的DMEM細胞培養基將細胞接種于96孔板中,于5%CO2,37℃培養至單層。將干擾素樣品預稀釋1000倍,再按4倍梯度稀釋,每個梯度重復兩孔。按每孔100ul接入。18h后,換入用不含FBS的DMEM培養基稀釋的100TCID50病毒液,同時設置不加干擾素的病毒對照組和不加干擾素及病毒的細胞對照組,待病毒對照組出現90%以上細胞病變時,進行結晶紫染色,用酶標儀(Thermo,MultiSkan FC)在570nm波長讀值。結果根據Reed-Muench法計算,活性為6.3×105U,比活性為2.97×106U/mg。
2.6 Western-BLOT特異性分析
取復性液進行Western-blot,結果在預期大小處約23kD出現目的條帶,能特異性地被干擾素抗體識別,呈陽性(詳見圖2)。
2.7 小鼠安全性試驗
將30只昆明系小鼠分為3組每組10只,分為對照組、單倍劑量實驗組和10倍劑量實驗組分別注射犬干擾素后觀察14d,全部健活無異常。
2.8 實驗室犬安全性試驗
將15只比格犬分為3組每組5只,分為對照組、單倍劑量實驗組和10倍劑量實驗組分別注射犬干擾素后觀察14d,全部健活無異常。
2.9 實驗室犬有效性試驗
將15只比格犬(50~70日齡)分為3組每組5只,分為空白對照組、攻毒組和實驗組分別攻毒(劑量為1×107TCID50/只)待其出現明顯的臨床癥狀時用經過上述細胞病變法檢測含有高生物學活性的重組犬α干擾素(重組犬α干擾素按40萬IU/kg體重)進行治療,結果表明犬治愈率增加,死亡率降低。
3 討論
(1)現在動物干擾素在獸醫臨床應用尚處于初級階段,通常用于緊急治療傳染性病毒病。在臨床應用研究方面,國內外主要研究方向為,提高表達量和比活性、延長體內代謝半衰期、常溫保存技術、擴大臨床適用癥范圍以及蛋白質空間結構和改構等。隨著犬類動物在國人生活中的伴侶作用越來越重要,加速研發適用于臨床應用于多種犬類的干擾素生物制劑,更好的預防和治療犬類疾病越來越重要。因為動物干擾素直接生產成本高、效率低、種屬差異大、穩定性差等原因,利用基因工程技術大批量生產高純高效干擾素是大多數研究者的首選方法,國內研究主要集中在大腸桿菌和酵母等表達系統方面,建立一個制備基因工程重組犬干擾素高純高效的生產工藝,不僅僅可以獲得巨大的經濟效益,而且具有深刻的社會效益。(2)本研究利用前期構建好的基因工程重組犬干擾素表達菌株,在前期完成的實驗室制備工藝的基礎上進行中試放大,按照GMP的相關要求進行試制。本工藝采用大規模發酵培養技術發酵培養得到表達犬α干擾素的菌體,經過離心回收、洗滌后采用高壓勻漿的方式裂解菌體;將收集的包涵體通過變性復性得到的重組犬干擾素,通過鹽析、超濾濃縮、層析純化、超濾脫鹽和除菌過濾得到]=P8I7U5TR犬α干擾素半成品。整套工藝重復性好、操作簡便、質量穩定,易于大規模成產,得到的基因工程重組犬α干擾素純度為98.4%,比活性為2.97× 106U/mg,內毒素含量為19EU/ml,適合產業化要求。按照獸用生物制品規程的要求,本文通過進行無菌檢驗和內毒素含量測定、總蛋白濃度測定、蛋白純度分析、犬干擾素α抗病毒比活性測定、用Western-BLOT法檢測特異性,并進行了小鼠安全性試驗、實驗室犬安全性試驗及實驗室犬有效性試驗,結果表明基因工程重組犬α干擾素,在小鼠和比格犬上的單劑量和超劑量安全性良好,無不良反應;在犬細小病毒病治療試驗中顯示治愈率明顯增加,死亡率明顯降低。
本研究表明該基因工程重組犬干擾素已經具備臨床研究的基礎,并具備大規模產業化商業開發的可能。
[1] 奧斯伯等. 主編金由辛, 包慧中, 趙麗云等譯校.精編分子生物學實驗指南/(美)F.M[M]. 北京:科學出版社, 2016.
[2] 辛普森主編. 蛋白質純化實驗指南:用于蛋白質組學研究/R.J[M]. 北京: 科學出版社, 2004.
[3] 薩姆布魯克, D.W. 拉塞爾著黃培堂等譯. 分子克隆實驗指南/(美)J[M]. 北京: 科學出版社, 2016.
[4] 夏春, 汪明, 夏兆飛. 拉布拉多犬和德國牧羊犬干擾素alpha基因克隆及測序[J]. 農業生物技術學報, 1999(3): 243-245.
[5] 林德貴. 注射用重組犬干擾素α治療犬瘟熱病犬的臨床應用[A]. 中國畜牧獸醫學會獸醫外科學分會、中國畜牧獸醫學會小動物醫學分會. 全國獸醫外科學第13次學術研討會、小動物醫學第1次學術研討會暨奶牛疾病第3次學術討論會論文集[C]. 中國畜牧獸醫學會獸醫外科學分會、中國畜牧獸醫學會小動物醫學分會: 中國畜牧獸醫學會, 2006: 4.
[6] 王艷. 犬α干擾素基因的克隆,表達及其活性測定[D].南京農業大學: 南京, 2005.
[7] 任玉瑩, 范泉水, 邱薇等. 基因工程犬干擾素α的制備及純化工藝[J]. 生物技術通訊, 2009, 20(1): 47-49.
[8] 李瑩瑩. 犬用干擾素的制備方法研究及質量體系建立[D]. 長春工業大學: 長春, 2012.
[9] 郭佳宏, 廖學文, 姚惠娟等. 犬干擾素的基因工程研究與應用[J]. 畜牧與獸醫, 2013, 45(10): 105-108.
[10] 付玉和. 犬α干擾素畢赤酵母表達條件的優化、純化及其活性研究[D]. 吉林農業大學: 長春, 2016.
[11] 田春玲. 重組干擾素對犬疫苗免疫影響及細小病毒病的療效研究[D]. 河北農業大學: 保定, 2018.
(2019–10–01)
十三五國家重點研發計劃項目(2016YFD0501006) ;山東半島國家自創區發展建設基金項目
S852.4+4
A
1007-1733(2019)12-0012-03

