孕酮回植通過調節內質網應激誘導的細胞自噬與凋亡阻止小鼠月經發生
于明明,謝 卓,金 華,王乾興
(1.遵義醫科大學 細胞生物學教研室,貴州 遵義 563099;2.習水縣人民醫院 醫教科,貴州 遵義 564600)
月經發生的實質是體內雌孕激素水平急劇下降誘導的子宮螺旋動脈收縮,導致子宮內膜功能層缺血缺氧,進而子宮內膜細胞死亡、崩解、脫落[1]。臨床實踐推遲月經常為月經前3~7d口服孕酮(黃體酮)及其類似物(炔諾酮、甲地孕酮等),但用藥一般不超過7d,否則易出現用藥期間點滴狀出血。說明外源性補充孕酮可以推遲月經的發生,也提示孕酮推遲月經的作用并不是無限期的,已經分化的子宮內膜細胞似乎有著既定的命運。研究發現月經期人子宮內膜中真核起始因子2α(eukaryotic initiation factor 2α,eIF2α)的磷酸化水平升高,并同時伴有內質網應激(endoplasmic reticulum stress,ERS)所致的關鍵蛋白活化所需的轉錄激活因子4(activating transcriptionfactor4,ATF4)和內質網特異性凋亡信號C/EBP同源蛋白(C/EBP-homologous protein,CHOP)表達增加,且可被米非司酮(孕酮拮抗劑)或salubrinal(eIF2α磷酸化抑制劑)所逆轉[2~6]。提示內質網應激所致的eIF2α相關信號可能參與了孕酮撤退誘導的月經發生和孕酮對其調控的關鍵作用。但上述研究結果是在離體組織中得到的,在體情況下孕酮如何調控上述信號的表達還不清楚。本研究利用小鼠生理性孕酮撤退的月經模型進行孕酮回植實驗,全面探索孕酮回植對小鼠月經發生過程中ERS所致的自噬關鍵信號通路PERK/eIF2α/ATF4和凋亡信號通路關鍵成員CHOP、Caspase12表達的調控情況,以期為月經發生機制的解析和臨床月經調控的時機選擇提供基礎性技術資料。
1 材料與方法
1.1 實驗動物與試劑 SPF級8~10周齡雌性健康C57BL/6J小鼠,購自斯貝福(北京)生物技術有限公司(許可證號:SCXK(京)2016-002),光照周期12 h(08:00-20:00),自由進食和攝水,21±1℃控溫。本項研究動物實驗獲得遵義醫科大學倫理委員會批準。雌激素(Estrogen)購自英國Alfa Aesar公司;孕酮(Progesterone)購自美國Sigma公司;山羊抗兔、山羊抗鼠IgG二抗購自北京中杉金橋生物技術開發公司;兔抗鼠PERK、鼠抗鼠ATF4、兔抗鼠CHOP多抗和鼠抗鼠GADPH單抗購自武漢三鷹生物技術有限公司;兔抗鼠p-PERK、p-eIF2α、eIF2α、Caspase12多抗購自北京博奧森生物技術有限公司;所有引物均由上海生工生物工程技術有限公司合成,引物序列為:PERK(F:GAGATCTGGCTCAAAGACGAAA;R:AAGGAGCTATGACTTCGATCTG)、eIF2α(F:GTCTCAGACCCATCTATCTTGG;R:CATACCTGGGTGGAGCTATTAG)、ATF4(F:GACCGAGATGAGCTTCCTGAACAG;R:CCGCCTTGTCGCTGGAGAACCACC)、CHOP (F:CTCCAGATTCCAGTCAGAGTTC;R:ACTCTGTTTCCGTTTCCTAGTT)、Caspase12(F:TGGCCCATGAATCACATCTAAT;R:TGGACAAAGCTTCAGTGTATCT)、GAPDH (F:TGGTGAAGACGCCAGTGGA;R:GCACCGTCAAGGCTGAGAAC);RNAiso Plus試劑盒和real-time PCR試劑盒購自日本TAKARA公司。
1.2 小鼠生理性孕酮撤退月經模型的建立及孕酮回植實驗 參考本課題組前期工作進行[7]。將30只C57BL/6J雌鼠在乙醚麻醉下行雙側卵巢去除術。小鼠術后恢復1周以清除內源性雌孕激素的干擾,而后雌孕激素序貫干預,最后將20 μL花生油注入小鼠的子宮腔以誘導子宮內膜蛻膜化,49 h后移除孕酮皮埋管。將小鼠分為12 h組、16 h組和孕酮回植組(每組10只),其中12 h組和16 h組分別在皮埋管移除后12 h和16 h處死;回植組則在皮埋管移除后12 h再次回植皮埋管并在16 h處死。收集小鼠雙側子宮角,生理鹽水沖洗后裝入去酶EP管液氮中凍存或盛有固定液的EP管中待用。
1.3 real-time PCR檢測PERK、eIF2α、ATF4、CHOP和Caspase12 mRNA表達 RNAiso Plus試劑盒提取小鼠全子宮總RNA,紫外分光光度計測定總RNA濃度。取2 μg總RNA逆轉錄成cDNA,20μL體系進行real-time PCR實驗。反應條件為:95 ℃預變性30 s,95 ℃變性5 s,60 ℃退火30 s,共40個循環。以GAPDH為內參,目的基因的相對表達量以2-△△Ct表示。
1.4 蛋白印跡法檢測t-PERK、p-PERK、t-eIF2α、p-eIF2α、ΑTF4 、CHOP和Caspase12蛋白表達 取約100 mg小鼠全子宮,加入1 mL混合液(組織裂解液、PMSF、蛋白酶抑制劑、蛋白磷酸酶抑制劑按100∶1∶1∶1配制)提取總蛋白,BCA法測定蛋白濃度。40 μg蛋白上樣,80 V恒壓電泳,冰上轉膜,牛奶封閉,一抗(t-PERK 1∶1 000;p-PERK 1∶1 000;t-eIF2α 1∶1 000;p-eIF2α 1∶1 500;ATF4 1∶1 500;CHOP 1∶800;Caspase12 1∶2 000;GAPDH 1∶5 000)4 ℃孵育過夜。洗膜后常溫孵育二抗2 h,ECL顯影,Image Pro Plus進行條帶分析。
1.5 免疫組化法檢測p-PERK、p-eIF2α、ATF4、CHOP和Caspase12蛋白的原位表達 小鼠全子宮10%中性甲醛過夜固定后石蠟包埋,3μm連續切片,常規脫蠟水化后高壓法修復抗原,一抗(p-PERK 1∶100;p-eIF2α 1∶150;ATF4 1∶100;CHOP 1∶50;Caspase12 1∶100)4 ℃過夜。PBS洗片后滴加二抗,37 ℃孵育30 min。DAB顯色,蘇木素復染,梯度酒精脫水,二甲苯透明,中性樹膠封片后OLYMPUS光學顯微鏡下拍攝圖像。
2 結果
2.1 小鼠子宮組織中PERK、eIF2α、ATF4的表達 如圖1、圖2,12 h組和孕酮回植組PERK、eIF2α和ATF4 mRNA表達量無明顯差異,但均明顯高于16 h組(P<0.05)。在蛋白水平上,各組子宮內膜組織中總PERK(t-PERK)和總eIF2α(t-eIF2α)表達未見顯著差異;但其磷酸化蛋白(p-PERK、p-eIF2α)在12 h組和孕酮回植組是顯著升高的,因而其活性表現形式(p-PERK/t-PERK、p-eIF2α/t-eIF2α的比值)及ATF4表達量顯著高于16 h組(P<0.05)。如圖3,免疫組化結果顯示,p-PERK、p-eIF2α和ATF4蛋白在子宮內膜組織中的分布情況類似,表達于子宮內膜基底層與蛻膜化基質細胞交界處的基質細胞細胞質,且12 h組和孕酮回植組表達強度相似,均高于16 h組。

*:與12 h組相比較,P<0.05;#:與孕酮回植組比較,P<0.05。 圖1 孕酮回植對小鼠子宮 PERK、eIF2α和ATF4 mRNA表達的影響(real-time PCR)

*:與12 h組相比較, P<0.05;#:與孕酮回植組比較,P<0.05。圖2 孕酮回植對小鼠子宮PERK、eIF2α和ATF4蛋白表達的影響(Western blot)
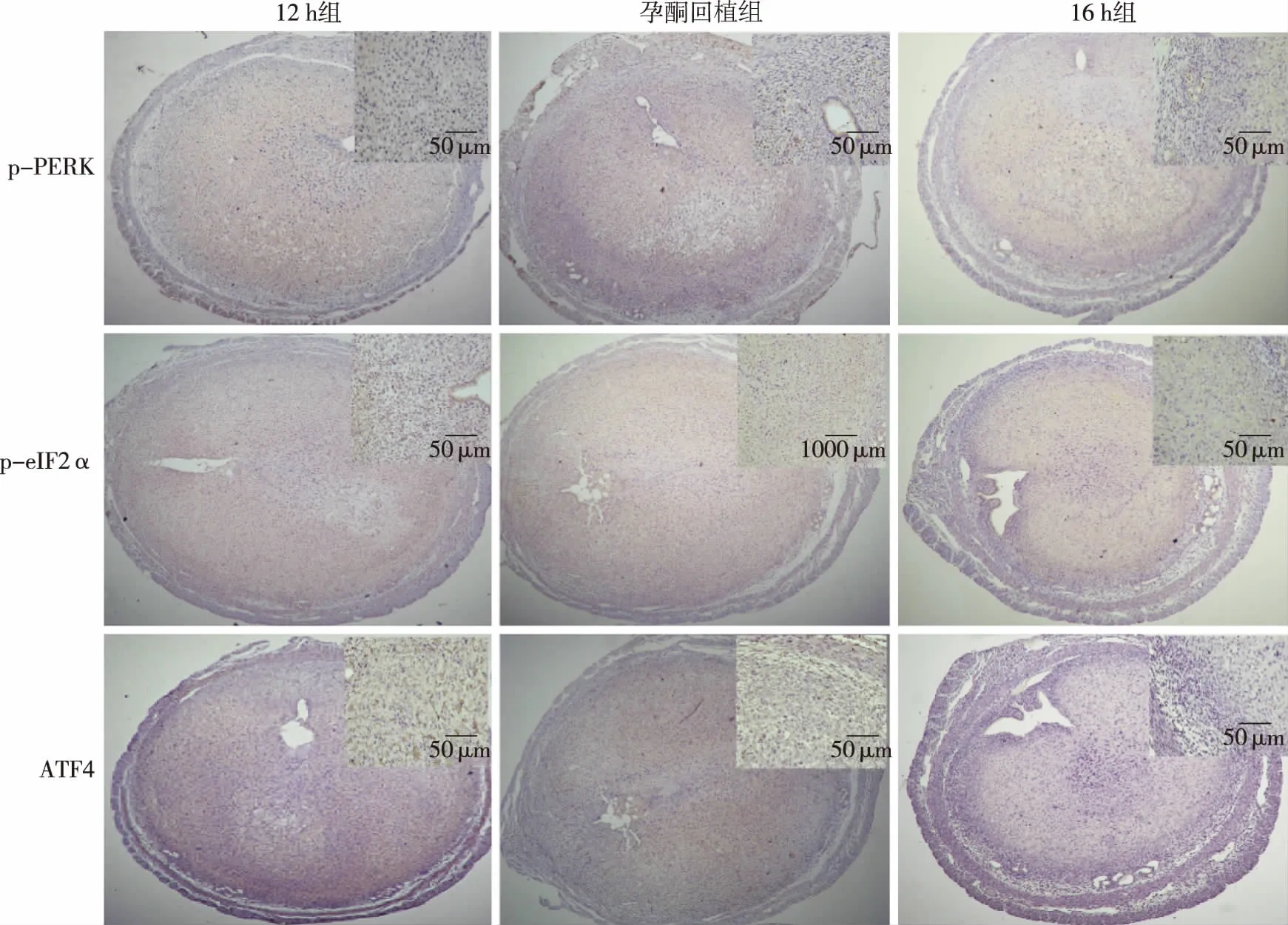
圖3 孕酮回植對小鼠子宮p-PERK、p-eIF2α和ATF4 蛋白原位表達的影響(IHC,SP法)
2.2 小鼠子宮組織中CHOP和Caspase12的表達 如圖4,孕酮回植組和12 h組的CHOP和Caspase12在mRNA和蛋白水平上的表達無明顯差異,但均明顯低于16 h組(P<0.05)。同時免疫組化結果顯示,CHOP和Caspase12蛋白在12 h組和孕酮回植組表達強度類似,都顯著低于16 h組,主要表達于充分蛻膜化的基質細胞和腺上皮細胞的細胞質(見圖5)。

*:與12 h組比較,P<0.05;#:與孕酮回植組比較,P<0.05。圖4 孕酮回植對小鼠子宮CHOP和Caspase12 mRNA和蛋白表達的影響
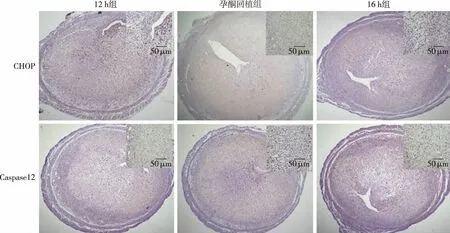
圖5 孕酮回植對小鼠子宮組織CHOP和Caspase12蛋白原位表達的影響(IHC,S-P法)
3 討論
月經周期貫穿于女性的整個生育期,月經是否規律對其生活質量影響巨大。闡明月經發生機制,將可為臨床上經血過多、過少、痛經等子宮內膜異常出血相關疾病的治療及月經周期的人工干預提供新的策略。
目前認為月經發生存在由血管外周細胞介導的可逆階段和白細胞介導的不可逆階段。在可逆階段通過孕酮的補充可阻斷子宮內膜的崩解[8],從而推測月經發生存在一個可為孕酮逆轉的關鍵時期。這已在恒河猴[9]和小鼠模型中得到了證實,其中小鼠中這一關鍵時期在孕酮撤退后12 h,即在孕酮撤退后12 h回植孕酮能阻斷月經發生,16 h回植則不能[7]。但孕酮是如何調控子宮內膜基質細胞的生存或死亡的?目前并不清楚。
細胞自噬是一個受基因調控的、涉及具有雙層膜結構的自噬體形成,并將物質運輸到溶酶體中降解的復雜過程[10]。正常情況下,細胞通過基礎水平的自噬清除受損的蛋白質或細胞器,從而維持細胞穩態。研究表明,自噬缺陷小鼠表現出錯誤折疊的受損蛋白質的累積[11]。自噬與凋亡參與人類月經發生已有零星報道[12],但尚缺乏系統、全面的研究。PERK(protein kinase RNA-like ER kinase,蛋白激酶RNA樣內質網激酶)是存在于內質網膜上的跨膜蛋白,其活性受到內質網腔中的葡萄糖調節蛋白78(glucose regulated protein 78,GRP78)的調節[11]。正常情況下,PERK與GRP78結合而無活性;當發生ERS時,特異性地觸發未折疊蛋白反應(unfolded protein response,UPR),PERK與GRP78分離而磷酸化被快速激活[13-14],進而磷酸化eIF2α,下調細胞內蛋白合成的整體水平,減輕UPR而維持細胞生存;但當ERS進一步加劇時,eIF2α也可上調ATF4表達[3],進而直接上調CHOP表達而誘導細胞凋亡[15]。本研究通過在月經發生關鍵時期之前(孕酮撤退后12 h)回植孕酮,將其與孕酮撤退后12 h和16 h小鼠子宮中內質網應激誘導的自噬和凋亡情況進行比較。結果發現:雖然各組PERK、eIF2α總蛋白的表達無顯著性差異,但在12 h組和孕酮回植組,其mRNA表達量、磷酸化形式的蛋白及其下游信號ATF4的表達量卻顯著高于16 h組。與此同時,內質網特異性凋亡信號CHOP和Caspase12 mRNA和蛋白表達模式剛好相反,即在12 h和回植組顯著低于16 h組。由此提示,孕酮撤退后12 h,小鼠子宮內膜基質細胞產生了ERS,誘導UPR,激活PERK/eIF2α/ATF4信號通路的表達,增強自噬作用以清除異常蛋白質而維持細胞穩態。但當孕酮撤退時間延長到16 h,基質細胞的UPR反應進一步加重,內質網已無法有效清除積累的異常蛋白質,轉而誘導內質網特異性的凋亡信號CHOP和Caspase12表達。這兩種凋亡蛋白的表達一方面負反饋抑制其上游PERK/eIF2α/ATF4信號表達,另一方面介導各自的特異凋亡途徑或共同協調誘導小鼠子宮內膜基質細胞的凋亡[16-17]。而這一效應可被在孕酮撤退后12 h回植孕酮所阻斷,說明孕酮回植能有效維持較高水平的自噬并抑制內質網特異的凋亡蛋白表達,從而阻斷小鼠月經的進程。需要指出的是,PERK和eIF2α的mRNA的變化趨勢與其磷酸化蛋白的表達趨勢一致,而與總蛋白表達趨勢不符,說明這兩種蛋白的活性可能不在翻譯水平,而是在翻譯后水平上的快速磷酸化而調控的[18-20]。
綜上所述,孕酮撤退后12 h回植孕酮能有效阻斷月經發生的進程,可能是通過維持小鼠子宮內膜基質細胞中ERS誘導的自噬信號通路PERK/eIF2α/ATF4表達并抑制凋亡關鍵信號CHOP和Caspase12表達來實現的。

