野生茄子原生質體制備及電融合條件研究
郭歡歡 陳鈺輝楊錦坤 劉富中 張 映 連 勇
(中國農業科學院蔬菜花卉研究所,農業農村部園藝作物生物學與種質創制重點實驗室,北京 100081)
原生質體是指去除細胞壁后被細胞膜包圍的細胞,其應用研究主要通過原生質體融合即體細胞雜交創制新的植物種質。原生質體融合技術能夠克服有性雜交中只有親緣關系較近的物種間才能獲得雜交后代的局限性,轉移有性雜交方式中親本不能轉移的生物和非生物脅迫抗性,獲得包括植物種間、屬間及科間的體細胞雜種。原生質體融合技術已在茄屬、煙草屬、柑橘屬、禾本科等植物中廣泛開展(喻艷,2013;常勝合 等,2018)。
茄子栽培種和大多數茄子近緣野生種都屬于茄科茄屬一年生草本植物。自然界中,茄子栽培種一般抗逆性(生物逆境和非生物逆境)較差,而野生茄子表現出較好的抗逆性和抗病性(Rotino et al,2014),因此常用作砧木使用,常用的砧木材料為刺天茄(Solanum indicum)、水茄(S. torvum)及赤茄(S. mammosum)等。但由于近年來單一砧木品種使用年限較長及不同地區病害生理小種發生變異等原因導致砧木品種的抗病性下降,頻繁出現了嫁接苗發生大面積死秧現象(王爽 等,2013),因此需要創制出新的砧木資源。由于不同野生茄子品種抗病種類及抗病能力不同(張紅浩 等,2015),加上多數野生茄子間有性雜交不親和(Daunay,2008),制約了砧木資源的改良。利用原生質體進行體細胞雜交可以克服有性生殖的障礙,將不同抗病種類和抗病能力的野生材料融合成體細胞雜種植株,創制出新的野生砧木 材料。
研究人員通過原生質體融合技術分別獲得茄子栽培種和野生茄子S. sisymbriifolium、S. khasianum、 S. torvum、S. nigrum、S. aethiopicum 體 細胞雜交四倍體株系,并部分轉移了野生資源中的優良抗病 性(Gleddie et al.,1986;Guri & Sink,1988;Sihachakr et al.,1988,1989;Daunay et al.,1993;Jarl et al.,1999)。前人雖已建立了茄子原生質體分離及融合的基本方法,但不同基因型原生質體游離所需酶類和酶解時間等條件存在差異,對不同融合親本原生質體游離及融合條件仍需進一步探討。因此,本試驗以蒜芥茄(S. sisymbriifolium)和水茄(S. torvum)為融合親本,主要探討不同酶類濃度、酶解時間和電融合基本參數對原生質體游離及融合的影響,篩選出原生質體游離及電融合最佳條件,以期為親本均為野生茄子的原生質體游離及融合提供試驗基礎,并為創制茄子砧木種質資源奠定 基礎。
1 材料與方法
1.1 試驗材料
水茄(S. torvum)和蒜芥茄(S. sisymbriifolium)種子由中國農業科學院蔬菜花卉研究所茄子課題組提供。2017 年12 月于茄科實驗室組培室開始進行培養,原生質體游離材料為茄子試管苗嫩葉。
1.2 試驗方法
1.2.1 外植體獲得 挑取飽滿健康種子,在無菌操作臺中用70%的酒精浸泡30 s,10% NaClO3滅菌15 min,無菌水沖洗3 遍,吸干水分,然后接種于MS(3%蔗糖,0.75%瓊脂)培養基中,培養瓶置于14 h 光照/10 h 黑暗、光照強度2 200 lx、溫度25~27 ℃的組培室中培養。植株采用節間繼代培養,原生質體游離使用的茄子苗在MS(2%蔗糖,0.75%瓊脂)培養基中培養21 d,取上部嫩葉進行原生質體的游離純化。
1.2.2 酶解液濃度對原生質體游離的影響 在無菌操作臺中分別取水茄和蒜芥茄試管苗上部幼嫩真葉1~2 g,利用解剖刀將嫩葉切成1 mm 左右寬度,然后浸泡在酶液中,在(25±1)℃黑暗下酶解。纖維素酶(Onozuka R-10,Yakultv,Japan)設0.2%(m/V,下同)、0.3%、0.4% 3 個濃度梯度,離析酶(Macerozyme R-10,Yakultv,Japan) 設0.05%、0.1%、0.2% 3 個濃度梯度,9 個酶液組合,在不同酶液組合條件下對葉片原生質體游離情況進行顯微鏡觀察比較,每個酶液組合重復3 次觀測,選定最優酶解液。
1.2.3 酶解時間對原生質體游離的影響 選定最優酶解液后,測定不同酶解時間(9、10、11、12、13、14、15、16 h)對不同基因型茄子葉片原生質體產量的影響。每個酶解時間重復3 次,試驗數據采用SAS 9.4 軟件進行分析。通過比較不同酶解時間對原生質體產量的影響,確定最優酶解時間。
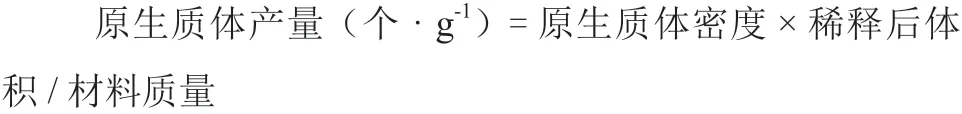
1.2.4 電融合參數對原生質體融合的影響 用電融合儀(ECM2001,USA)對游離純化后的原生質體進行融合。對基本電融合參數進行設定,其中交流電場強度分別為60、70、80、90、100、 110 V · cm-1,交流電場作用時間以大多數細胞成串為3~4 個為準,直流脈沖強度分別為1 200、1 250、1 300、1 350 V · cm-1,直流電場作用時間分別為40、45、50、55 μs,每次試驗在研究某一參數時,其他參數保持某個數值不變,通過顯微觀測細胞狀態,確定最適電融合參數。每個處理重復3 次。
2 結果與分析
2.1 酶解液濃度對原生質體游離的影響
試驗結果表明(表1),水茄和蒜芥茄葉片原生質體在0.3%纖維素酶+0.1%離析酶條件下鏡檢觀測到的單細胞數量最多,其余酶解液濃度組合顯微觀察存在葉片解離不完全、單細胞量少、細胞破碎等情況,不利于原生質體的游離。顯微鏡下觀測到在適宜的酶液濃度組合下,酶解充分,游離單細胞較多(圖1-A),放大觀測可見球體形狀規則的、透亮的完整細胞(圖1-B);酶液濃度不適易造成細胞破碎,顯微鏡下觀測可見細胞呈不規則形狀,有細胞碎片(圖1-C、D)。
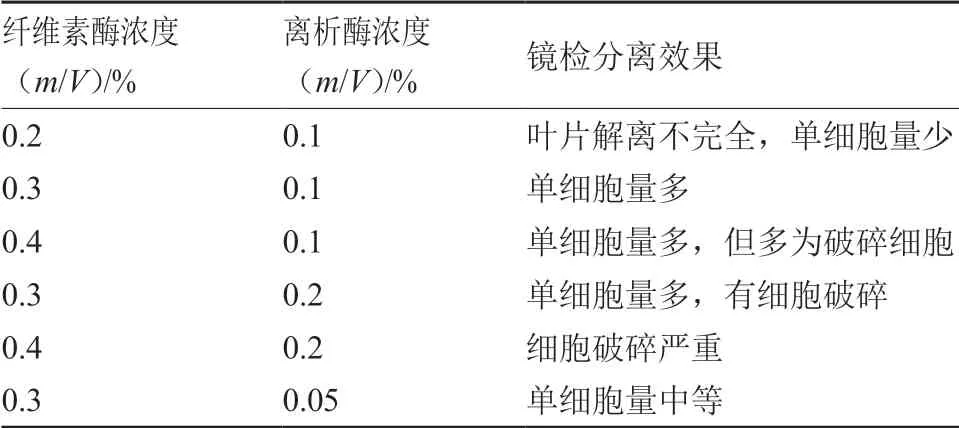
表1 部分酶解液組合下葉片原生質體游離效果觀測
2.2 酶解時間對原生質體游離的影響
在最優酶解液濃度0.3%纖維素酶+0.1%離析酶條件下,對不同酶解時間下原生質體產量進行比較。結果表明(表2),蒜芥茄在13~15 h 酶解時間下的原生質體產量較高,其中14 h 達到最大值15.06×106個 · g-1。水茄在11~13 h 酶解時間下的原生質體產量較高,其中13 h 達到最大值15.92×106個 · g-1。酶解時間過短或過長都會影響原生質體產量,酶解時間過短,酶解不充分,不利于原生質體游離,影響原生質體產量;酶解時間過長,原生質體脫壁完全,導致質膜受到損傷,從而使原生質體死亡數量增加。
2.3 電融合參數對原生質體融合的影響
顯微觀測表明,在交變電場作用下,雙親原生質體沿電場方向形成很多平行排列的串珠,交變電場越大,串珠形成越快;交變電場作用時間越長,串珠形成也加長(圖2-A)。然后施加直流脈沖電壓后,串珠迅速解體,形成了很多長短不一的包括由兩個原生質體形成的小串珠,部分小串珠很快融合在一起(圖2-B、C),直流脈沖電壓越大或作用時間越長,顯微觀測可見多核體多,原生質體破裂的多(圖2-D、E)。本試驗中確定基本電融合參數為交流電場強度80 V · cm-1,交流電場作用時間10 s,直流脈沖強度1 250 V · cm-1,直流電場作用時間 45 μs,次數1 次時,顯微鏡觀測大多數細胞成串為3~4 個,大多數為兩細胞之間發生融合,且細胞破碎少,融合效果好(圖2-B、C)。
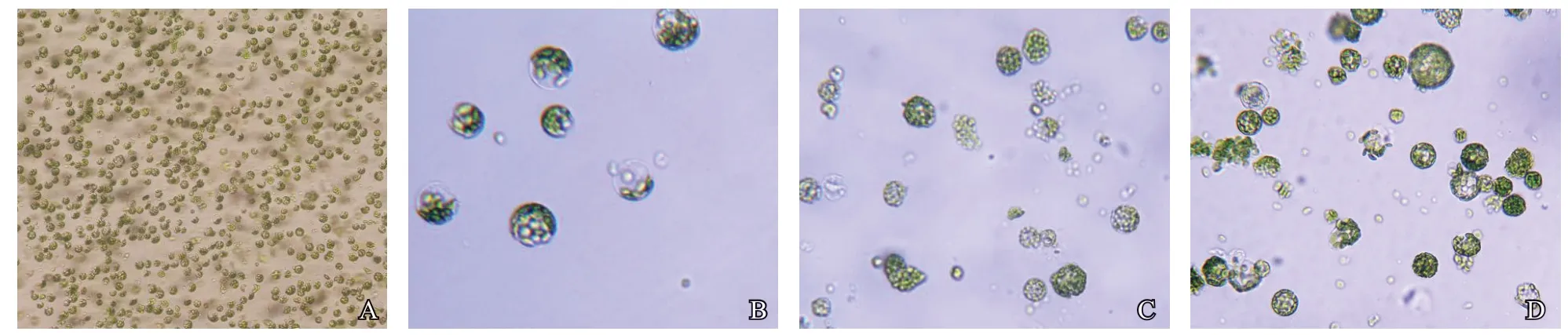
圖1 野生茄子葉片原生質體游離效果
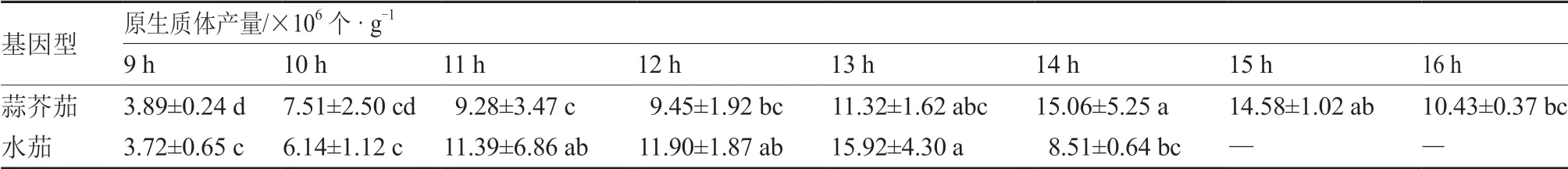
表2 酶解時間對不同基因型野生茄子葉片的原生質體產量的影響
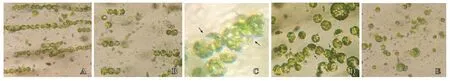
圖2 野生茄子原生質體在不同電融合參數條件下的融合效果
3 結論與討論
酶的種類、濃度是影響原生質體游離的重要因素。纖維素酶用于在植物原生質體中裂解細胞壁,離析酶用于從葉肉細胞中分離出單個細胞。酶濃度過低,會使細胞壁裂解不充分,游離不出原生質體;酶濃度過高會損害原生質體,導致其破碎、活性下降。前人研究顯示在喀西茄(S. khasianum)和癲茄(S. aculeatissimum)原生質體融合試驗中,其葉片原生質體游離使用0.8%(m/V,下同)纖維素酶R-10 和0.2%離析酶R-10(Stattmann et al.,1994);栽 培 茄(S. melongena L.)分別 與 水茄 (S. torvum)和南美紅茄(S. aethiopicum)進行原生質體融合時,其葉片原生質體游離使用1.5%纖 維 素 酶R-10 和0.5% 離 析 酶R-10(Sihachakr et al.,1989;Daunay et al.,1993);栽培茄和紫色非洲茄屬(S. marginatum)葉片原生質體游離使用0.1%纖維素酶R-10 和0.2%離析酶R-10(Borgato et al.,2007)。不同基因型的植物由于葉片組織結構上的差異,從而使得在原生質體分離去壁酶解過程中酶解條件存在一定差異(喻艷,2013)。本試驗中水茄和蒜芥茄葉片原生質體游離最適酶液濃度是0.3%纖維素酶R-10+0.1%離析酶R-10,在這個濃度下顯微鏡觀測到的單細胞數量最多。由此可見,對于不同基因型植物,即使是同一屬,其最適酶解濃度也不同,在進行原生質體游離時都需要研究確定最適酶解濃度。
酶解時間對植物原生質體產量有很大影響。酶解時間過短,不能達到較好的分離效果;時間過長,酶對已分離出的原生質體就會產生毒害作用。栽培茄(S. melongena L.)、水茄(S. torvum)和紫色非洲茄屬(S. marginatum)的酶解時間為16 h (Guri & Sink,1988;Borgato et al.,2007)。本試驗結果顯示,蒜芥茄(S. sisymbriifolium)最適酶解時間是14 h,原生質體產量達最大值15.06×106個 · g-1,水茄(S. torvum)最適酶解時間是13 h,原生質體產量達最大值15.92×106個 · g-1。本試驗結果和前人不同,說明不同基因型植物在相同酶種類和濃度條件下,獲得最大原生質體產量所需要的酶解時間不同,選擇合適的酶解時間才能獲得大量高活性原生質體。
原生質體電融合可分解為兩步,首先是交流電場使得原生質體3~4 個串在一起,然后給予直流脈沖使得串在一起的原生質體發生融合,交變電壓過高,無論直流脈沖電壓多么低,原生質體也會破裂,若交變電壓過低,無論脈沖電壓多么高,融合也很少發生,電融合參數影響融合效果(郭文武 等,1998;田國奎 等,2012)。不同基因型茄子原生質體電融合參數不同,研究表明,栽培茄(S. melongena L.)和水茄(S. torvum)或南美紅茄(S. aethiopicum)使用電融合參數為交流電場強度125 V · cm-1,作用時間15 s,直流脈沖強度1 200 V · cm-1,作用時間20 μs,次數2 次(Sihachakr et al.,1989;Daunay et al.,1993); 栽 培 茄(S. melongena L.)和紫色非洲茄屬(S. marginatum)使用電融合參數為交流電場強度125 V · cm-1,作用時間15 s,直流脈沖強度1 500~2 000 V · cm-1,作用時間50 μs,次數3 次(Borgato et al.,2007)。本試驗中,交流電場強度為80 V · cm-1,作用時間10 s,直流脈沖強度1 250 V · cm-1,作用時間 45 μs,次數1 次時,顯微鏡觀測到大多數細胞成串為3~4個,融合效果較好。與前人試驗所用電融合參數相比,本試驗所用電流強度和時間不同,說明不同基因型茄子在電融合時需要確定適當的電融合參數,參數的確定對能否獲得大部分兩細胞融合是非常必要的。

