3D腹腔鏡單吻合器法經肛門取出標本在超低位直腸癌保肛手術中的運用
杜 濤, 傅傳剛, 周主青, 紀 昉, 黃 賁
(同濟大學附屬東方醫院胃腸肛腸外科,上海 200120)
直腸癌中約1/3為低位直腸癌,即腫瘤下緣距離齒狀線的距離小于5cm。對于低位直腸癌保肛手術,目前多采用腹部小切口取標本、雙吻合器法吻合,尤其是在腹腔鏡直視手術下更易于操作[1]。然而,對于一些距離齒狀線2~3cm的超低位腫瘤或者瘤體巨大者,傳統的雙吻合器法往往難以順利實施,在骨盆狹小空間難以保證足夠的下切緣,如何進一步提高保肛率是臨床關注重點。3D腹腔鏡具有立體視野,借助前端可旋轉鏡頭使得腹腔內縫合等操作變得更加簡單。單吻合器法經直腸取標本即在直視下安全距離離斷直腸后經肛門取出標本,直腸遠端封閉采用腹腔鏡下手工縫合,最后以管型吻合器吻合。本研究對比分析同濟大學附屬東方醫院胃腸肛腸外科實施的122例行單吻合器和雙吻合器法吻合的超低位直腸癌手術療效。
1 資料與方法
1.1 一般資料
回顧分析我院胃腸肛腸外科2016年1月—2018年1月行腹腔鏡手術的112例超低位直腸癌。其中男性67例,女性45例,平均年齡(64.4±10.2)歲。所有手術均遵循TME原則,行3D腹腔鏡直腸前切除+末端回腸預防性造口術。其中,單吻合法組采用經肛門取出標本、手工縫合直腸殘端后端端吻合;雙吻合器法經腹部小切口取出標本、直線切割閉合器離斷直腸后端端吻合。術前影像評估為T4或淋巴結明顯轉移者行同步新輔助放化療(放療總劑量50Gy),8~10周后行手術治療。
1.2 方法
1.2.1 單吻合器法 全身麻醉成功后取頭低腳高截石位,于臍上緣置入10mm Trocar,分別右下腹置入12mm Trocar做主操作孔,左右上腹、左下腹5mm Trocar做輔助操作孔。采用右側中間入路,沿乙狀結腸右側白線縱行切開后腹膜,游離Toldt’s間隙至降結腸旁溝外側,腸系膜下動脈根部Hemolock閉合離斷。游離直腸后壁及兩側壁,直至腫瘤下方2cm。對于超低位直腸癌,經括約肌間溝分離至齒狀線上方。腸系膜下動脈根部水平離斷腸系膜下靜脈,裁剪乙狀結腸系膜,腫瘤近側約10cm處用直線切割閉合器離斷腸管。直腸遠端裸化腸管,緊貼腫瘤下緣以紗線條結扎腸管,肛門充分灌洗后,腫瘤遠端結扎線遠側約1cm處用超聲刀橫斷腸壁,切開腸壁前用紗條保護腸管,切開后以碘伏紗條充分消毒腸腔避免污染,取切緣組織送快速冰凍病理,若為陽性則改行Miles手術。
會陰組醫生充分擴肛至4指,經肛門插入帶齒Kock鉗,再經右下腹主操作Trocar內置入長約25cm 標本保護套,自肛門拖出保護建立無菌通道。經肛門置入吻合器釘砧后,將標本置入保護套一并拖出。倒刺線做荷包縫合封閉直腸殘端,近端剪開乙狀結腸閉合緣,置入抵釘座,并以血管夾及圈套器固定、收緊,經肛門置入管型吻合器吻合,見圖1。經腸腔充氣實驗證實吻合良好,將右下腹主操作孔延長至2cm,行末端回腸預防性雙腔造口,盆底放置雙套管。
1.1.2 雙吻合器法 游離直腸至盆底,腫瘤下方2cm 用直線切割閉合器離斷,下腹部切開長約5cm切口,腫瘤近端10cm離斷腸管,置入吻合器釘砧,經肛門置入管型吻合器吻合,同法行充氣實驗及末端回腸造口。
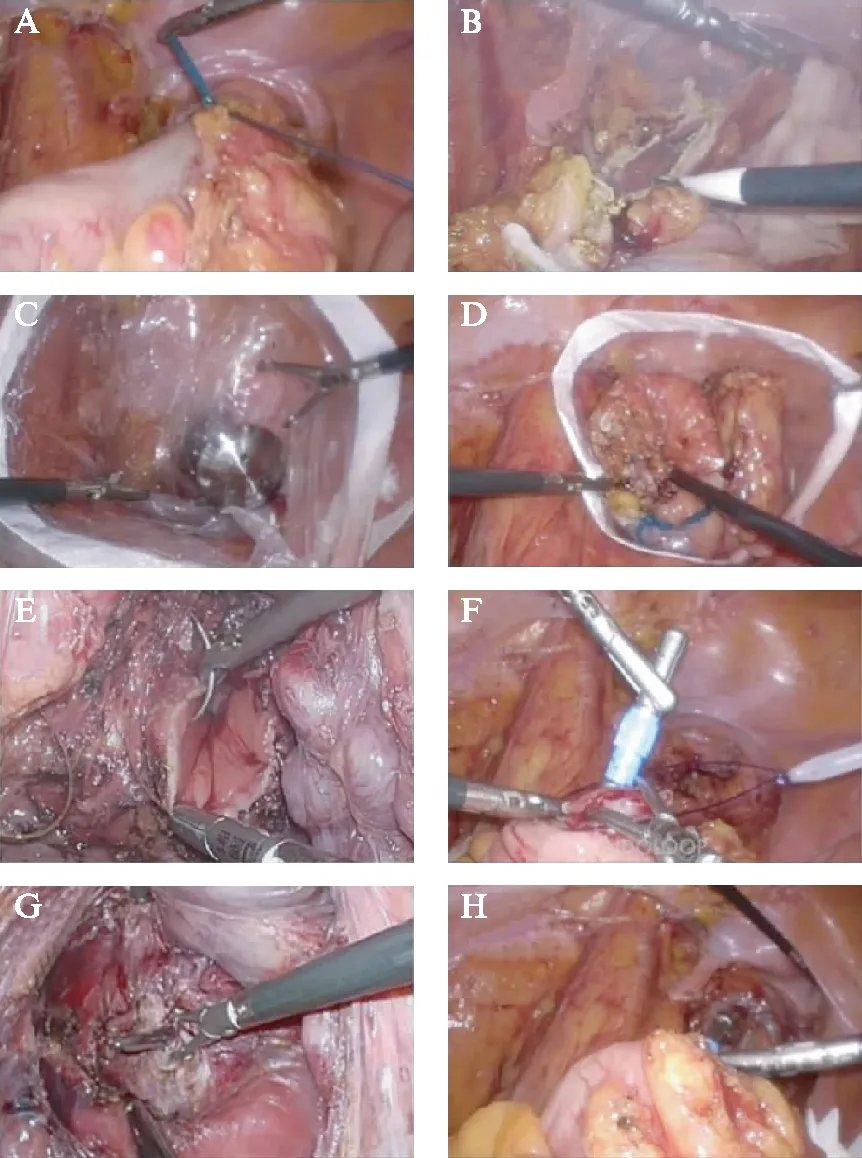
圖1 超低位直腸癌經直腸取標本前切除術單吻合器法重建Fig.1 Rectal reconstruction of transanal specimen extraction 3D-laparoscopic resection in extra-low rectal cancer using single stapling methodA: 腫瘤遠端結扎;B: 切開腸腔并消毒;C: 經肛門置入吻合器釘跕;D: 拖出標本;E: 縫合直腸殘端;F: 近段腸腔置入釘跕;G: 穿出釘砧;H: 端端吻合
1.3 觀察指標
統計所有手術病例的手術時間、出血量、術后住院時間、初次造口排氣時間、淋巴結檢出數、腫瘤下切緣長度、吻合口瘺發生率、術后6個月肛門Wexner失禁評分以及1年無病生存率。其中,造口袋初次充盈時間記為初次造口排氣時間,隨訪采用電話聯系或門診復診方式,術后隨訪時間為3~21個月。肛門、肛門Wexner失禁評分包括5項內容,每項0~4分,總分≤10分表明術后肛門功能較好,總分>10分表明術后肛門功能欠佳[2]。
1.4 統計學處理
2 結 果
2.1 一般資料比較
兩組患者在年齡、性別、術前合并癥、腹部手術史、腫瘤位置以及TNM分期等方面差異無統計學意義(P>0.05),見表1。
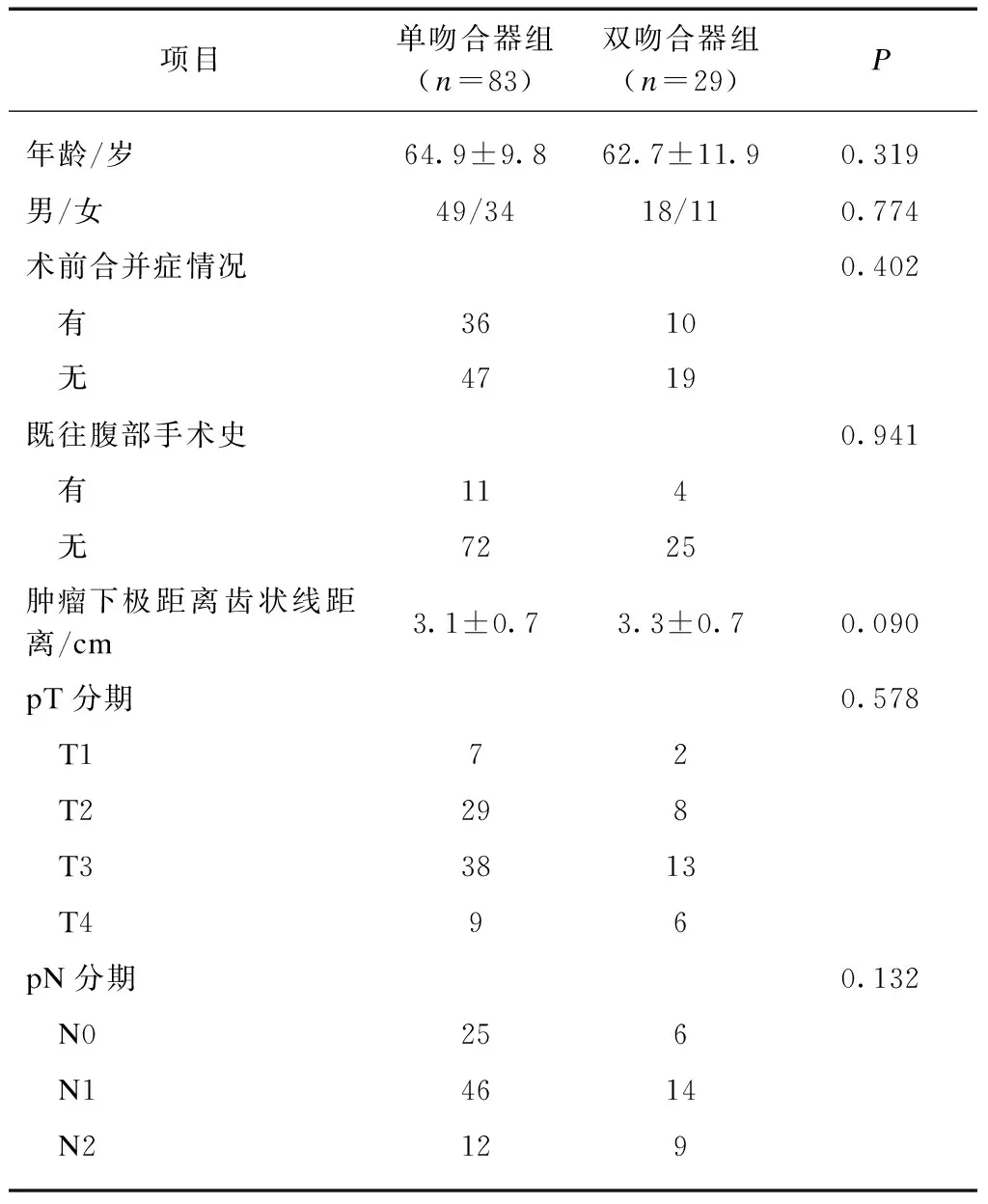
表1 兩組患者的臨床資料對比
2.2 兩組患者的手術學比較
單吻合器組和雙吻合器組的手術時間、出血量差異無統計學意義(P>0.05)。兩組患者初次造口排氣時間單吻合器組短于雙吻合器組,差異具有統計學意義(P<0.01)。兩組術后住院時間單吻合器組短于雙吻合器組(P<0.01),兩組吻合口瘺發生率差異有顯著性(P<0.05),兩組肛門Wexner失禁評分顯示肛門功能良好率差異無統計學意義(P>0.05),見表2。
2.3 兩組患者的腫瘤學比較
單吻合器組和雙吻合器組標本下切緣長度差異有統計學意義(P<0.01),腫瘤最長徑,術后淋巴結檢出數差異無統計學意義(P>0.05),1年DFS差異無統計學意義(P>0.05),見表3。

表2 兩組術后的手術學比較

表3 兩組術后的腫瘤學比較
3 討 論
隨著腹腔鏡技術的發展,越來越多的直腸癌采用腹腔鏡手術。大量的數據表明,腹腔鏡直腸癌根治術可以減少創傷、促進術后恢復并且不影響術后近期和遠期療效。隨著對微創理念的進一步深入,經自然腔道取出標本(natural orifice specimen extraction surgery, NOSES)的腹腔鏡直腸癌根治術近年來取得迅猛發展,具有創傷更小、恢復更快、不增加并發癥的優點[3-4]。
超低位直腸癌保肛手術的關鍵步驟是直腸殘端的處理以及吻合重建的方式。目前腹腔鏡直腸癌根治術大多數采取雙吻合器法進行吻合,即腹腔內以直線切割閉合器離斷直腸遠端、近端放置釘砧、最后經肛門以管型吻合器吻合。雙吻合器具有許多優點: 易于操作、直腸遠端閉合無污染、直腸殘端無皺褶和重疊,此外兩端腸腔口徑不一致時也易于吻合。大量研究表明,雙吻合器吻合安全有效,并顯著降低吻合口瘺發生率[5-6]。Akiyoshi等[7]回顧性分析363例行腹腔鏡前切除術雙吻合器法吻合的患者資料,其中吻合口瘺發生率僅為3.6%(13/363),多因素方差分析表明腫瘤位置及是否放置引流是吻合瘺發生的獨立預測因素[7]。然而雙吻合器法在臨床應用中也有一定的局限性: 對于距離齒狀線2~3cm的腫瘤或者瘤體較大者,因盆腔空間狹小,難以伸入直線切割閉合器至盆底,或者勉強離斷后難以保證下切緣安全距離,部分患者不得不改行Miles手術。傳統的單吻合器法也存在不足之處,即2D視野下在狹小的盆底間隙很難滿意縫合直腸殘端,由此導致吻合口瘺發生率增加。
近年來,國內外對腫瘤下切緣的概念也有了新的認識。Targarona等[8]認為直腸癌僅有向上引流的淋巴結阻塞時才下向擴散,并且約94%的患者向遠端擴散<2cm。Bujko等[9]對17個研究進行Meta分析,結果表明切緣<1cm組的復發率僅比切緣>1cm組高出1%。Nelson等[10]、鄭民華[11]認為在嚴格遵守TME操作、保持直腸系膜完整的情況下,齒狀線上1cm的T1-T2直腸癌和齒狀線上2cm的T3-T4患者進行保肛手術是安全的。以上文獻表明,對于腫瘤較小的超低位直腸癌的下切緣距離指標可以更加放寬。因此,結合3D腹腔鏡以及NOSES手術的優勢,本研究對超低位直腸癌以及瘤體巨大者實施了單吻合器法經直腸取標本手術。該法具有以下優點: 首先,在直視下離斷直腸,能更加精準的把握下切緣;其次,3D腹腔鏡下直腸殘端更容易縫合,吻合更方便,并可有效去除雙吻合器法導致的“貓耳征”,從而減少吻合口瘺的發生。再次,標本經直腸取出,沒有了腹部輔助切口,術后疼痛感更輕、腸道功能恢復更快。所有病例均行預防性造口,即使少數患者出現吻合口瘺,經過腹腔沖洗等保守治療均能治愈,且不影響再次還納手術。本研究表明,與傳統雙吻合器法手術相比,單吻合器法經肛門取出標本的腹腔鏡直腸癌根治術可以促進患者恢復、減少吻合口瘺發生率并具有更長的下切緣長度,而兩組在淋巴結檢出數、肛門功能評分以及1年無病生存率等方面無顯著差異,這表明單吻合器法經肛門取出標本的腹腔鏡直腸癌根治術是安全可行的。
本研究為回顧性研究,沒有更長期的隨訪數據,也缺乏對術后肛門功能的深入對比研究,有一定局限性。但單吻合器法經肛門取出標本的腹腔鏡直腸癌根治術可作為低位直腸癌保肛的一種選擇術式。

