我院制劑室建設的做法和經驗
李 昂,陳大如,王立敏,孫燕燕,張晨皓,陳宇洲
[1.天津市兒童醫院,天津 300134; 2.津潤(天津)藥業有限公司,天津 300402; 3.天津中醫藥大學,天津 300193]
近年來,隨著國家醫改政策的不斷推進,公立醫療機構取消藥品加成,醫療機構盈虧平衡能力降低。醫院制劑因其療效確切、定價靈活等優勢越來越受到各級醫療單位的重視[1]。本院制劑室建成于本世紀初,與現行的法律法規對醫療機構制劑的要求存在一定的差距[2]。本文對本院新制劑室的建設情況進行分析,討論制劑室建設和改造應注意的關鍵點,旨在為醫療機構制劑的發展提供一定的參考建議。
1 原有制劑室的現狀和問題
本院現有制劑品種43個,劑型14個,包括中西藥內服及外用制劑。原制劑室于2006年建設,生產面積約1 800 m2(潔凈區面積1 500 m2,一般區面積300 m2),庫房面積300 m2,藥檢室200 m2。存在廠區設計布局不合理、原輔料與成品混用庫房、設施老舊、軟件管理欠缺等情況,難以達到現行法律、法規要求,嚴重制約了本院制劑的發展。
2 新制劑室的建設情況
2018年6月—2019年3月,本院與津潤(天津)藥業有限公司強強合作,共同為本院建設新制劑室。新制劑室坐落在天津新技術產業園區北辰科技工業園津潤(天津)藥業有限公司廠院內。廠區外東側為外環線綠化隔離帶,西側為博科林藥品包裝技術有限公司、南側為地天泰工業園、北側是天津職業大學等,周圍無污染源,屬于適合生產藥品的區域。
制劑車間及倉儲區域均位于聯合廠房內,配套公用設施位于聯合廠房及北側區域,藥檢室位于辦公樓3樓。廠區內生產、行政、生活和輔助區總體布局合理,沒有互相妨礙之處。人流從南側大門進入廠區,物流從東側大門進入廠區,有效地防止了對藥品生產的污染。
新制劑室建筑面積3 944 m2,生產面積2 536 m2(其中潔凈區面積2 026 m2,一般區面積510 m2),庫房面積980 m2,藥檢室428 m2。新制劑室的建設參照2010版《藥品生產質量管理規范》(2010版GMP)標準建設,達到天津市《醫療機構制劑許可證》驗收標準,現將建設過程及體會報道如下。
2.1硬件建設 參照《藥品生產質量管理規范》(2010版)、《醫療機構制劑管理規范》(2001版)、《天津市醫療機構制劑室監督檢查規范(試行)》(2016版)、《醫藥潔凈工業廠房設計規范》(GB50457-2008)、《中藥藥品廠工程技術規范》(GB51029-2014)對制劑室進行設計及建設。
2.1.1車間設計布局 在整體車間設計上,主要考慮現有劑型、產能要求及預計未來5~10年的醫院制劑發展要求,經過與天津市醫藥設計院多次協商,確定了最終的設計方案。
醫療機構制劑具有品種繁多、產量相對小、中藥與西藥制劑、口服與外用制劑共存的特點。傳統醫院制劑室的建設一般按中、西藥分為“中藥車間”及“西藥車間”。按照《天津市醫療機構制劑室監督檢查規范(試行)》中第二十八條規定:“制劑室應按制劑工序合理布局,人、物流分開,一般區和潔凈區分開;內服制劑與外用制劑分開;無菌制劑與其他制劑分開;中藥制劑與西藥制劑分開;配制、分裝與貼簽包裝分開”。以上要求旨在最大限度地降低制劑配制過程中污染、交叉污染以及混淆、差錯等風險。
結合兒童制劑的特點,并與相關專業人員對車間布局設計圖進行風險分析,認為口服、外用制劑之間產生的污染、交叉污染以及混淆、差錯等風險要大于中藥制劑與西藥制劑之間的風險。所以最終確定制劑車間分為“內服制劑車間”及“外用制劑車間”,并在各車間內使中藥制劑與西藥制劑區域相對分開。
車間布局除中藥制劑與西藥制劑相對獨立外,同時生產區與輔助區、固體制劑與液體制劑也相對獨立,最大限度地降低制劑配制過程中的質量風險。
2.1.2潔凈生產區的建設 潔凈生產區的建設結合本院制劑產品的實際生產情況,如產能要求、設備大小、人員數量進行建設。墻體彩鋼板材質、地面采用PVC卷材。依據GB50016-2014《建筑設計防火規范》(2018年版),本院部分制劑品種生產過程中使用了“火災危險性甲、乙類物質”,如乙醇、升華硫、苯酚等。結合使用此類物質的工序及單批次用量,最終對部分操作間進行了防爆設計,如下挖1.2 m的防爆實心墻體、輕質泄爆屋頂,安裝可燃氣體探測器,防靜電接地的設計,燈具、開關以及設備的電動機及其控制按鈕選用防爆型等。
2.1.3一般生產區(中藥提取、粉碎車間)的建設 中藥提取、濃縮采用了密閉系統進行操作,并在線清潔,有效防止污染和交叉污染,有良好的排風、水蒸氣控制等設施。中藥飲片粉碎設置了專用操作間,有獨立的通風、除塵設施(設置有排風、除塵機組),滿足了環保要求。人員、物料進出及生產操作均參照潔凈區管理。
2.1.4庫區的建設 新制劑室建設獨立、分開的原輔料庫、中藥飲片庫、包裝材料庫、危險品庫及成品庫房。所有庫房均安裝有溫度調控設施,使之符合常溫庫及陰涼庫的溫濕度要求。為了防止原輔料、包裝材料取樣時造成污染及交叉污染,在庫區設有專門的取樣間。該取樣間采用獨立空調系統、D級凈化,有專用人流、物流通道。
2.1.5藥檢室的建設 新建的藥檢室利用津潤(天津)藥業原有化驗室改建而成,藥檢室面積為500 m2(含70.2 m2C級微生物檢測室凈化間),劃分微生物實驗室、培養室、理化室、留樣室、標化室、精密儀器室、天平室、電熱設備室、試劑儲備室,對原輔料、內包裝材料、中間產品、待包裝產品、成品等按照《中國藥典》2015年版、《天津市醫療機構制劑規范》2016年版、注冊標準進行檢測和穩定性考察,與目前新制劑室的配制規模相適應。
2.2質量管理體系的建立
2.2.1制劑室組織機構的建設 重新建立新制劑室的組織機構圖(見圖1),對制劑室的部分職責重新進行了劃分,增加了質量管理組織中QA的職能,保障制劑配制全過程的監督和控制,提高制劑室整個質量管理水平和制劑產品的質量。
2.2.2制劑室文件的建立 按照《天津市醫療機構制劑室監督檢查規范(試行)》(2016年版)的要求,制劑室應制定對制劑配制全過程實施有效管理的質量管理體系文件。本院制劑室文件分為管理文件、操作規程、技術標準和記錄文件,所有文件的制定按照制劑配制全過程的實際管理情況和實際操作流程,確保質量管理體系能夠有效運行。管理文件共起草了93個,包括文件管理、機構與人員管理、設備管理、廠房設施管理、物資管理、衛生管理、配制管理、質量保證管理和質量控制管理;操作規程起草了197個,包括崗位職責、環境監測、取樣方法、檢驗方法、儀器操作、設備操作、清潔、維護等操作規程;技術標準起草了206個,包括制劑、中藥材、物料質量標準和工藝規程。
2.2.3驗證體系的建立與實施 根據《天津市醫療機構制劑室監督檢查規范(試行)》(2016年版)的要求,新制劑室驗收需要完成配制環境、工藝用水和主要設施設備的驗證。本院新制劑室的驗證參考《藥品生產質量管理規范》(2010年版)中的要求,對使用的純化水系統、潔凈廠房和空調凈化系統、藥用壓縮空氣系統及生產用關鍵設備進行了驗證。驗證中分別從設計確認、安裝確認、運行確認和性能確認四個方面對新制劑室配制環境、工藝用水等設計、安裝、操作和性能進行了全面的確認,以確保本院制劑產品的配制環境符合國家法規要求,制劑產品使用的工藝用水、工藝用氣滿足相關規定。另外,制劑配制過程中使用到的設備也進行了安裝、運行及性能的確認,以確保其符合工藝要求,從而為制劑產品的配制及質量提供了有力保證。
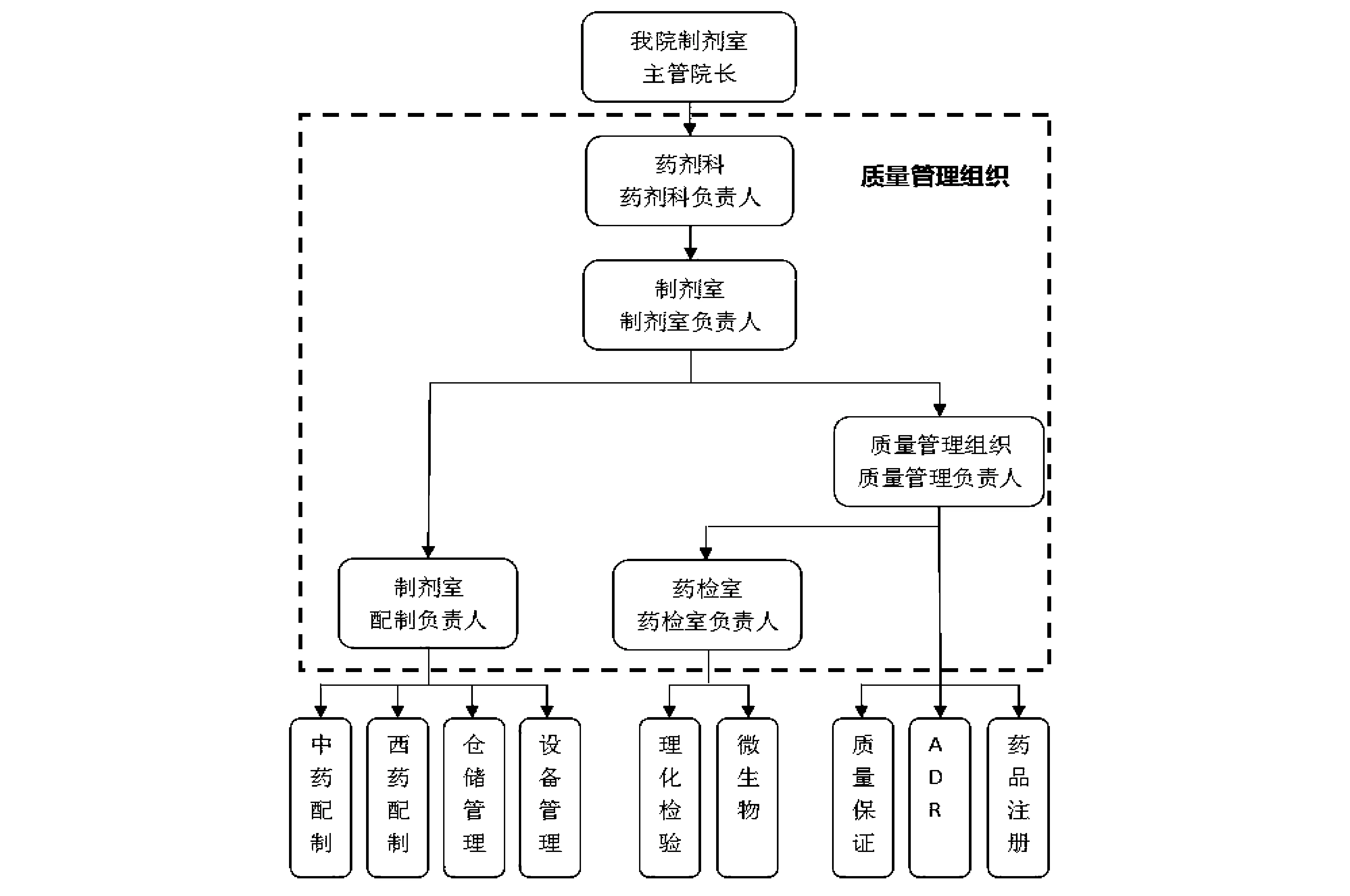
圖1 制劑室組織機構圖
2.2.4人員培訓管理 在新制劑室建設過程中,按照《培訓教育管理規程》中的要求,制定2019年度制劑室培訓計劃,組織員工進行《天津市醫療機構制劑室監督檢查規范(試行)》(2016年版)、驗證基礎知識、新制劑室管理文件以及各崗位的崗位職責和崗位SOP等相關內容的培訓。
制劑室的建設要具有前瞻性,從設備選型、生產區域的預留,均要考慮未來5~10年的發展趨勢[3]。制劑室硬件改造的同時需要升級軟件系統,如根據設備的更新,同時完成新的工藝規程和生產記錄,主要設備設施的運行、維修記錄等。歐美發達國家沒有類似我國醫療機構制劑的藥品形式,我國醫院制劑室多為20世紀90年代大力發展醫院制劑時建成[4]。而隨著制藥技術和設備的升級,對制劑室工作人員的要求也越來越高,加強新技術、知識、法規的繼續教育,發現現有不足,并進行針對性的改進,實現醫院制劑的可持續發展。

