擬行體外受精-胚胎移植的卵巢低反應患者黃體期應用HMG、FSH超促排卵效果對比觀察
張冕,李敏,王藹明
(中國人民解放軍總醫院第六醫學中心,北京100048)
近年,女性生育年齡延后,不孕不育發病率逐年升高,體外受精-胚胎移植(IVF-ET)輔助生殖技術助孕率逐年升高。卵巢低反應(POR)是卵巢對促性腺激素(Gn)反應不良的病理狀態,主要表現為卵巢刺激周期發育的卵泡少、血清雌激素峰值低、Gn用量多、周期取消率高、獲卵數少及臨床妊娠率低[1,2]。目前,各種超促排卵(COH)方案廣泛應用于臨床各類生殖不孕的患者,促性腺激素釋放激素激動劑(GnRH-a)長方案、超長方案等方案因效果顯著而作為超促排卵的經典方案常規使用。目前臨床尚未有公認的對POR患者最優超促排卵方法以提高妊娠率。黃體期促排是近年研究的熱門方案之一,可使高齡、卵巢儲備功能低下者獲得更多成熟卵子。絕經期促性腺激素(HMG)或含促卵泡素(FSH)均為常用的超促排卵藥物。目前黃體期應用HMG、FSH進行促排對于POR患者IVF-ET的臨床效果相關報道較少。我們分別采用HMG、FSH對擬行IVF-ET的POR患者進行黃體期超促排卵,比較其促排效果及患者妊娠結局。
1 資料與方法
1.1 臨床資料 選擇2014年1月~2017年5月在我院輔助生殖醫學中心擬行IVF/ICSI-ET助孕的POR患者125例。依照博洛尼亞標準[1]制定納入標準為:①年齡≥40歲或存在其他引起POR的高危因素;②POR史(常規卵巢刺激方案獲卵數≤3個);③卵巢儲備功能降低(DOR),如AFC<5~7個或AMH<0.5~1.1 ng/mL。至少符合以上3點中的2點即可診斷為POR。排除標準:①子宮發育異常;②重度宮腔黏連;③多囊卵巢綜合征;④合并糖尿病、胰島素抵抗、甲功異常等代謝異常性疾病;⑤結核病史;⑥染色體異常等。125例隨機分為A組85例、B組40例。A 組年齡(38.86±4.82)歲,不孕(3.72±3.18)年,BMI(23.15±3.19)kg/m2,竇卵泡數(4.08±2.21)個,血清基礎FSH(12.01±7.04)mIU/mL,血清基礎LH(4.32±2.74)mIU/mL、血清基礎P(0.42±1.15)ng/mL、血清基礎E2(63.13±81.90)pg/mL;B組年齡(40.40±4.32)歲,不孕(4.93±4.30)年,BMI(22.4±3.70)kg/m2,竇卵泡數(3.93±2.60)個,FSH(13.40±6.02)mIU/mL,血清基礎LH(4.93±2.84)mIU/mL、血清基礎P(0.73±0.46)ng/mL、血清基礎E2(49.60±26.18)pg/mL;兩組一般資料具有可比性。本研究經倫理委員會批準同意,納入者均簽署知情同意書。
1.2 POR患者黃體期應用HMG、FSH的方法及促排效果觀察 A組85例共進行85個周期HMG超促排卵,自然周期陰道超聲可見黃體的當日或次日開始應用人HMG,起始劑量150~300 IU/天,陰道超聲監測卵泡發育情況,個體化調整用藥劑量,當至少1~2個卵泡直徑≥17~18 mm時,停用HMG,給予絨毛膜促性腺激素(HCG)5 000~10 000 IU,誘導排卵。
B組40例共進行40個周期FSH超促排卵,自然周期陰道超聲可見黃體的當日或次日開始用FSH,起始劑量為150~300 IU/d,陰道超聲監測卵泡發育情況,個體化調整用藥劑量,當至少1~2個卵泡直徑≥17~18 mm時,停用FSH,予HCG 5 000~10 000 IU,誘導排卵。
促排周期中HCG注射日抽取兩組靜脈血,使用IMMULITE2000全自動免疫分析儀(德國,西門子),應用化學發光免疫方法檢測兩組血清性激素(FSH、LH、P、E2),觀察并記錄兩組HCG注射日≥10 mm的卵泡數、Gn用藥總量、Gn用藥天數。
1.3 IVF-ET方法及妊娠結局觀察 兩組均于HCG注射日32~36 h后在超聲監測下穿刺取卵,抽吸所有直徑≥10 mm卵泡,取卵后根據精液質量情況,采用IVF或ICSI或IVF+ICSI,72 h后觀察胚胎發育情況,通過評估卵裂球的數目、形態、大小及胚胎碎片量,劃分胚胎級別,1、2級為優質胚胎,3級為有效胚胎,1、2、3級胚胎均為可利用胚胎,所有可利用胚胎行玻璃化冷凍,予之后的自然周期(NC)/激素替代(HRT)周期/促排周期行凍融胚胎移植(FET)。觀察并計算兩組獲卵率、正常受精率、Day3優胚率、妊娠率、臨床妊娠率、流產率。ET后常規黃體支持,移植后10天行血HCG檢測,若為陽性,則繼續黃體支持。移植4周后行陰道超聲檢查,宮腔內有原始心管搏動確診為臨床妊娠。獲卵率=成熟卵數/HCG日獲卵數×100%;正常受精率=正常受精數/成熟卵數×100%;Day3優胚率=Day3優質胚胎數/正常受精數×100%;妊娠率=妊娠周期數/移植周期數×100%;連續臨床妊娠≥12周記為臨床妊娠,臨床妊娠率=臨床妊娠數/移植周期數×100%;妊娠12周以內自然流產及胎停記為流產,流產率=流產數/移植周期數×100%。
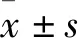
2 結果
2.1 兩組促排效果比較 結果見表1。由表1可見,兩組HCG日血清FSH、LH、P、E2水平及≥10 mm卵泡數、Gn用藥總量、Gn用藥天數間比較差異均無統計學意義(P均>0.05)。
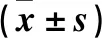
表1 兩組HCG日血清FSH、LH、P、E2水平及≥10mm卵泡數、Gn用藥總量、Gn用藥天數
2.2 兩組妊娠結局比較 兩組獲卵率、正常受精率、Day3優胚率、妊娠率、臨床妊娠率、流產率 結果見表2。兩組獲卵率、正常受精率、Day3優胚率、妊娠率、臨床妊娠率、流產率比較差異均無統計數學意義(P均>0.05)。
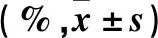
表2 兩組獲卵率、正常受精率、Day3優胚率、妊娠率、臨床妊娠率、流產率
3 討論
目前,POR患者卵巢儲備功能降低、卵子質量下降[3]、促排周期發育的卵泡少、對藥物反應差、血E2峰值低、使之獲卵數少、成胚率低、周期取消率高。POR的原因可能與年齡、遺傳因素、自身免疫性疾病、醫源性因素(如卵巢手術史、放化療等)及特發性因素有關,有報道指出年齡是影響妊娠結局的獨立影響因素[4]。對該類患者,促排周期中有卵泡生長發育顯得尤為珍貴。雖然POR相關的促排方案有數百篇報道[5~8],但目前尚無足夠證據明確POR的最佳治療方法。
最新的卵巢動力學理論是黃體期促排的基礎。卵泡的募集最早出現于前次月經周期的黃體晚期,而不僅僅出現在卵泡期,但黃體期高雌孕激素水平使FSH受抑制,導致卵泡閉鎖,因此提高黃體期FSH水平,能使黃體期出現卵泡募集并繼續發育,獲取成熟卵泡。Kuang等[9,10]利用外源性FSH在黃體期對卵巢反應正常患者行促排治療,獲得了較滿意的妊娠率,也證實了此觀點。黃體期促排最早應用于癌癥、卵巢手術放化療等急需短時間內爭取寶貴卵泡、保存生育力的患者,后逐漸運用于生殖不孕患者常規促排周期中。對POR患者而言,因卵巢儲備功能極度低下或估計下周期未必有竇卵泡者,即使卵巢內有1~2個直徑≤12 mm的小卵泡,也值得繼續行黃體期促排[16]。Kuang等[17]研究發現,在黃體期促排過程中,無早LH峰出現,并可縮短促排時間,簡化促排方案,且可獲得具有發育潛能的優質胚胎,取卵后無患者出現過度刺激,在隨后的解凍移植周期可獲得較滿意的臨床妊娠結局,可見黃體的存在和高水平的孕酮不影響卵泡發育和卵子質量。
在自然周期中,FSH的作用促使卵泡生長,LH影響卵泡膜細胞和顆粒細胞,FSH、LH協同作用,共同促進甾體激素的合成,從而促進卵泡生長、優勢卵泡選擇和卵母細胞成熟。早期卵泡顆粒細胞缺乏LH受體,因此早卵泡期LH主要作用于卵泡膜細胞,合成雄激素,顆粒細胞在FSH作用下將雄激素轉換成雌激素[13],通過一系列反饋機制誘導單個優勢卵泡的選擇。有研究[14]指出,卵泡的募集及早、中期發育主要依賴FSH的作用,LH可能作用于中晚卵泡期,影響卵泡的發育及成熟。在傳統的IVF促排方案中,為了獲取更多卵泡,阻止不成熟LH峰,內源性LH通過垂體降調節受到限制。有學者[8]認為,高的內源性LH水平對卵泡或胚胎質量和臨床結局是負面影響。促排藥物HMG和FSH最主要的區別是HMG中含有外源性的LH。另有報道[15]認為,體內LH水平過低,與獲卵數、受精率等降低、流產率增加有關。另有研究[21]認為,只需要1%的LH受體被占用即可維持正常的激素水平,垂體降調下逃逸的內源性LH足以維持卵泡的正常生長及成熟,即垂體降調后沒必要添加外源性LH。本研究得知,應用HMG或FSH行IVF-ET的助孕效果及臨床結局無統計學差異。然而,本研究中因POR患者單次促排周期尚不能獲得足夠數量胚胎,黃體期促排所獲胚胎常與其他周期所獲胚胎一起移植,本研究中HMG組共解凍移植57個周期,單獨HMG促排周期獲卵移植者41個周期,HMG促排周期獲卵與其他周期獲卵一起移植16個周期,單獨HMG促排周期獲卵移植未孕者34個周期,單獨HMG促排周期獲卵移植胎停流產者5個周期,單獨HMG促排周期獲卵移植臨床妊娠者4個周期。FSH組共解凍移植19個周期,其中單獨FSH周期促排獲卵解凍移植14個周期,FSH周期促排與其他周期獲卵一起移植5個周期,單獨FSH周期促排獲卵解凍移植后未孕者8個周期,單獨FSH周期促排獲卵移植胎停及流產者4個周期,單獨FSH周期促排獲卵移植臨床妊娠者2個周期。兩組臨床妊娠結局比較無明顯差異,但因周期數較少,統計結果可能存在偏倚。
綜上所述,POR患者黃體期應用HMG、FSH進行超促排卵后IVF-ET中的臨床效果相似,但本研究病例數有限,尚有待進一步擴大樣本量再次研究。

