基質細胞衍生因子-1基因轉染對人胃癌細胞株SGC7901增殖、耐藥的影響及其機制
劉小慧,賀曼曼,張偉,李靜,牛廣旭,馮運章
(邯鄲市中心醫院,河北邯鄲 056001)
胃癌是起源于胃黏膜上皮的惡性腫瘤[1,2]。新輔助化療、轉化治療或術后輔助化療均能改善部分患者總體生存期[3]。奧沙利鉑以DNA為作用靶點,是目前臨床胃癌化療的一線藥物,但其耐藥是影響胃癌患者預后的重要因素[4]。基質細胞衍生因子-1(SDF-1)是一類炎性趨化因子,與其受體 CXCR-4廣泛地表達于多種細胞和組織中,參與免疫、循環系及中樞神經系統發育等重要生理過程,同時還參與腫瘤細胞生長、侵襲、轉移、耐藥等病理過程[5,6]。目前有研究[6~8]報道,SDF-1高表達與大腸癌細胞、白血病、肺癌細胞的化療耐藥密切相關。但關于SDF-1對胃癌細胞耐藥的影響鮮有報道。胃癌耐藥機制涉及多方面,而上皮—間質轉化(EMT)[9]及細胞自噬[4]均是耐藥的重要機制。2018年2~7月,我們觀察了SDF-1過表達對人胃癌細胞株SGC7901增殖、耐藥的影響,并探討其可能作用機制。
1 材料與方法
1.1 細胞、試劑及儀器 人胃癌細胞株SGC7901由河北省人民醫院科研中心保存并惠贈,常規使用10%胎牛血清、RPMI-1640培養基培養,置于5% CO2、37 ℃恒培箱培養,常規換液傳代。轉染試劑盒Lipofectamine-2000、TRIzol Reagent(美國 Invitrogen 公司);cDNA 合成試劑盒(美國Fermentas公司);MTT試劑盒(南京KGA公司)。實驗相關PCR引物由上海生物工程有限公司合成;真核表達載體pcDNA3.1-SDF-1由上海吉瑪制藥有限公司合成并測序驗證。
1.2 SGC7901 細胞分組及pcDNA3.1-SDF-1轉染 取對數生長期 SGC7901 細胞分為實驗組、陰性對照組、空白對照組, 按1×105的密度接種于6孔板培養,融合度達約80%時實驗組、陰性對照組分別轉染pcDNA3.1-SDF-1質粒、pcDNA3.1質粒(空白質粒),將稀釋質粒與Lipofectamine 2000混合均勻加入培養孔,室溫孵育20 min,所有操作均嚴格按說明書操作。空白對照組不做任何處理。
1.3 三組細胞 SDF-1 mRNA及蛋白檢測 ①采用RT-PCR法檢測三組細胞SDF-1 mRNA。質粒轉染48 h時,按2×107收集對數生長期三組細胞,TRIzol法提取細胞總RNA,按試劑盒說明書將RNA逆轉錄為cDNA,配置25 μL 反應體系擴增目的基因。引物序列為SDF-1(270 bp)上游引物5′-GGGTACC-ATGCAGCTTGTTG-3′;下游引物5′-GAGATCTCTAG-GCGCCCTGG-3′。GAPDH(258 bp)上游引物5′- AGAAGGCTGGGGCTCATTTG-3′;下游引物5′-AGGGGCCATCCACAGTCTTC-3′。RT-PCR反應條件:預變性94 ℃ 5 min→94 ℃變性30 s→(SDF-1,55 ℃;GAPDH,58 ℃)退火60 s→72 ℃延伸1 min,擴增30個循環。以GAPDH為內參,以2-ΔΔCt代表CG5844基因的相對表達量。實驗重復5次,取平均值。②采用Western bloting法檢測細胞SDF-1蛋白。質粒轉染48 h時分別收集各組2×107個細胞提取蛋白,BCA法測定蛋白濃度,50 μg蛋白上樣,經SDS-PAGE電泳分離,轉PVDF膜。洗膜后用紅外熒光掃描成像系統掃描,以GAPDH作為內參測算SDF-1蛋白相對表達強度。實驗重復5次,取平均值。
1.4 三組細胞增殖情況觀察 采用MTT法。 取對數生長期三組細胞接種于96孔板,按5×103/mL調整每孔細胞密度,質粒轉染24、48、72、96 h時,加入5 mg/mL的MTT溶液20 μL作用4 h棄去培養基,加入150 μL的DMSO搖勻,酶標儀測各孔570 nm波長光密度OD值,以OD值代表各組細胞增殖能力。實驗重復5次,取平均值。
1.5 三組細胞對奧沙利鉑的耐藥性觀察 MTT法檢測細胞對奧沙利鉑的耐藥性。質粒轉染48 h時各取三組對數生長期細胞約2×104個,培養于96孔板,培養24 h后分別按照奧沙利鉑(1、2.5、5、10、20、40、80 μg/mL)濃度梯度加藥,每種濃度設3個復孔,培養48 h時每孔加入5 mg/mL的MTT溶液20 μL,37 ℃培養4 h,棄上清, 加150 μL 的DMSO搖勻,酶標儀測各孔570 nm波長光密度OD值,測算各組細胞增殖抑制率,SPSS軟件進一步測算奧沙利鉑對各組細胞的IC50值。實驗重復5次,取平均值。
1.6 三組細胞凋亡情況觀察 采用流式細胞儀。質粒轉染48 h時分別取三組對數生長期細胞,加入10 μg/mL奧沙利鉑處理細胞48 h,收集細胞,采用Annexin V-FITC/PI雙染法,加入5 μL Annexin V-FITC和5 μL的 PI混合均勻,所有操作均嚴格按照說明書進行。采用流式細胞儀測算三組凋亡細胞百分率。實驗重復5次,取平均值。
1.7 三組細胞EMT相關蛋白上皮型鈣黏蛋白(E-cadherin)、神經型鈣黏蛋白(N-cadherin)及皮型蛋白(Vimentin)檢測 采用Western blotting法。質粒轉染48 h時取三組細胞,所有操作同“1.3”。使用Image J軟件對熒光強度進行定量分析,以GAPDH作為內參測算E-cadherin、N-cadherin及Vimentin蛋白相對表達強度。實驗重復5次,取平均值。將空白對照組及實驗組SGC7901細胞收集接種至24孔板,常規培養,倒置顯微鏡動態觀察細胞形態變化。
1.8 三組細胞微管相關蛋白1輕鏈3Ⅱ(LC3-Ⅱ)、白噬相關因子(Beclin 1)蛋白檢測 采用Western bloting法。質粒轉染48 h時取三組細胞,具體步驟同“1.3”。實驗重復5次,取平均值。 透射電鏡觀察細胞自噬現象:用奧沙利鉑(10 μg/mL)分別處理空白對照組及實驗組細胞24 h后,收集1×106個細胞,2.5%戊二醛及1%鋨酸順序固定2h,按丙酮梯度脫水,然后包埋、固定、制超薄切片,用5%醋酸鈾和檸檬酸鉛染色,透射電鏡觀察細胞自噬現象。
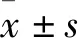
2 結果
2.1 三組細胞SDF-1 mRNA及蛋白相對表達量比較 質粒轉染48 h時實驗組、空白對照組、陰性對照組細胞SDF-1 mRNA相對表達量分別為2.139±0.170、0.753±0.065、0.764±0.064,與空白對照組、陰性對照組比較,實驗組細胞SDF-1 mRNA相對表達量升高(P均<0.05);培養48 h時實驗組、空白對照組、陰性對照組細胞SDF-1 蛋白相對表達量分別為3.557±0.234、1.255±0.081、1.309±0.094,與空白對照組、陰性對照組比較,實驗組細胞SDF-1 mRNA相對表達量升高(P均<0.05)。
2.2 三組細胞OD值比較 培養24、48、72 、96 h時三組細胞OD值比較見表1。與空白對照組、陰性對照組比較,培養24、48、72、96 h實驗組細胞OD值均升高(P均<0.05)。
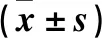
表1 培養24、48、72、96 h時三組細胞OD值比較
2.3 奧沙利鉑對三組細胞的IC50值比較 不同濃度奧沙利鉑作用下三組細胞增殖抑制率比較見表2。 隨著奧沙利鉑濃度的遞增,三組細胞的增殖抑制率均呈遞增趨勢(P均<0.05)。相同奧沙利鉑濃度下,實驗組細胞增殖抑制率均明顯低于空白及陰性對照組(P均<0.05)。奧沙利鉑對實驗組、空白對照組、陰性對照組細胞的IC50值分別為28.039±3.011、10.403±1.253、10.612±1.044,與空白對照組、陰性對照組比較,奧沙利鉑對實驗組細胞的IC50值升高(P均<0.05)。
2.4 三組細胞凋亡率比較 質粒轉染48 h時實驗組、空白對照組、陰性對照組細胞凋亡率分別為39.10%±2.26%、53.90%±3.19%、51.30%±3.37%,與空白對照組、陰性對照組比較,實驗組細胞凋亡率降低(P均<0.05)。
2.5 三組細胞E-cadherin、N-cadherin及Vimentin相對表達量比較 倒置顯微鏡下動態觀察細胞形態變化,空白對照組細胞聚集生長,細胞間連接相對緊密,細胞多呈圓形、橢圓形或扁梭形。而隨著培養時間延長,實驗組細胞聚集或成團生長現象逐漸消失,細胞呈現分散生長趨勢,形態逐漸不規則,細胞變細變長,狀如長梭形、長條形、三角形等,部分細胞可見細長偽足出現。
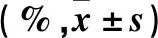
表2 不同濃度奧沙利鉑作用下三組細胞增殖抑制率比較
質粒轉染48 h時實驗組、空白對照組、陰性對照組細胞E-cadhein蛋白相對表達量分別為0.351±0.022、0.482±0.039、0.473±0.035,與空白對照組、陰性對照組比較,實驗組細胞E-cadhein蛋白相對表達量降低(P均<0.05);實驗組、空白對照組、陰性對照組細胞N-cadhein蛋白相對表達量分別為0.555±0.032、0.314±0.026、0.327±0.025,與空白對照組、陰性對照組比較,實驗組細胞N-cadhein蛋白相對表達量升高(P均<0.05);實驗組、空白對照組、陰性對照組細胞 Vimentin蛋白表達量相對表達量分別為0.842±0.064、0.621±0.054、0.619±0.051,與空白對照組、陰性對照組比較,實驗組細胞Vimentin蛋白表達量相對表達量升高(P均<0.05)。
2.6 三組細胞LC3-Ⅱ、Beclin 1蛋白相對表達量比較 奧沙利鉑作用24 h后透射電鏡下觀察,空白對照組及實驗組細胞均觀察到細胞自噬、自噬性死亡現象,但與空白對照組比較,實驗組細胞自噬現象更更多,自噬溶酶體數目也明顯增多,同時也能夠觀察到自噬溶酶體內容物降解后遺留的多量空泡、髓樣體。
質粒轉染48 h時實驗組、空白對照組、陰性對照組細胞 LC3-Ⅱ蛋白表達量相對表達量分別為0.720±0.052、0.424±0.029、0.615±0.049,Beclin 1蛋白表達量相對表達量分別為1.114±0.126、0.433±0.031、0.633±0.055,與空白對照組、陰性對照組比較,實驗組細胞LC3-Ⅱ、Beclin 1蛋白表達量相對表達量升高(P均<0.05)。
3 討論
SDF-1基因位于人10號染色體長臂上,全長約267 bp,編碼89個氨基酸殘基[10]。SDF-1與其受體CXCR4、CXCR7在多種組織和細胞中廣泛表達,與腫瘤細胞增殖、凋亡、侵襲、轉移、耐藥均密切相關[6,10]。目前許多研究已證實SDF-1在胃癌細胞[10]、宮頸癌細胞[11]、惡性顱咽管瘤[12]、甲狀腺乳頭狀癌[13]等諸多腫瘤的增殖侵襲轉移中發揮重要作用,而其機制與PI3K/Akt[10,12]、NF-κB[13]信號通路激活有關。本研究成功建立SDF-1過表達胃癌細胞,MTT結果表明實驗組細胞增殖活力明顯高于空白及陰性對照組,表明SDF過表達能夠明顯促進胃癌細胞增殖。
腫瘤多藥耐藥是化療主要障礙,如何克服腫瘤耐藥是全球研究熱點。研究[7]報道SDF-1能夠通過誘導ERK磷酸化,上調抗凋亡蛋白Bcl-xL表達進而降低ALL細胞株SUP-B15對阿霉素的敏感性。腫瘤相關成纖維細胞通過分泌SDF-1激活CXCR4,從而提高Bcl-xL的表達來增強肺癌A549細胞對順鉑的耐藥性[8]。本研究結果表明SDF-1過表達能夠明顯增加胃癌SGC7901細胞對奧沙利鉑的耐藥性,其耐藥倍數較空白及陰性對照組分別增加約2.7、2.6倍。
EMT是指上皮細胞向間質細胞轉化的病理過程,這一過程涉及上皮標志物E-cadherin表達下調以及間皮標志物N-cadherin、Vimentin表達上調[14]。目前研究[9]已表明EMT不僅參與腫瘤細胞侵襲轉移過程,也是許多腫瘤細胞耐藥的一種新的重要機制。腫瘤細胞在產生獲得性耐藥的過程中有間質化趨勢,而具有間質分化狀態的腫瘤細胞也常表現為原發性耐藥的特點。研究[6,13,15]表明,SDF-1對腫瘤細胞EMT具有正向促進作用。因此本實驗推測SDF-1介導耐藥可能與EMT有關。為驗證上述推論,本實驗對EMT相關重要蛋白進行檢測,結果表明與對照組相比,實驗組E-cadherin蛋白表達下調而N-cadherin、Vimentin表達上調。對細胞形態學的動態觀察也發現實驗組細胞在生長過程中形態逐漸變得不規則,細胞分散生長,變細變長,細胞形態多見長梭形、長條形、三角形,部分細胞可見細長偽足形成。文俏程等[16]等認為細胞上述形態改變即屬于EMT現象。由此本實驗認為SDF-1有可能通過促進EMT進程介導胃癌細胞對奧沙利鉑耐藥。
自噬是真核生物廣泛存在的高度保守代謝調控過程,細胞通過溶酶體降解自身受損細胞器和大分子物質以維持細胞代謝平衡和內環境穩態[17]。但細胞自噬是一把雙刃劍:一方面機體出現感染、缺氧等應激刺激時,自噬能保護細胞存活;另一方面如果應激持續時間過久,則會出現細胞自噬性死亡[18]。研究表明SDF-1/CXCR4軸能夠通過上調miR-125b的表達增強細胞自噬從而介導大腸癌細胞對5-氟尿嘧啶耐藥[6],抑制SDF-1表達能夠降低宮頸癌Hela細胞對放療的抵抗性,誘導其凋亡[19]。由此可見在多數腫瘤細胞中自噬是腫瘤細胞對周圍惡劣微環境的一種適應性變化,能夠保護腫瘤細胞抵抗化療、放療、靶向治療等誘導的凋亡,是腫瘤發生耐藥的機制之一[4]。為驗證上述推論,本研究結果表明實驗組細胞凋亡率明顯低于空白及陰性對照組,透射電鏡下觀察也發現實驗組細胞自噬溶酶體明顯高于空白對照組,這意味著SDF-1過表達可能通過誘導胃癌細胞保護性自噬進而抑制細胞凋亡,從而參與胃癌細胞對奧沙利鉑的耐藥性產生。目前對自噬現象的觀察主要通過透射電鏡觀察細胞形態及檢測自噬相關蛋白的表達。LC3是自噬標志物,存在兩種形式:LC3-Ⅰ和LC3-Ⅱ,自噬發生時LC3-Ⅰ甘氨酸殘基能夠與自噬泡內膜磷脂酰乙醇胺結合轉變為LC3-Ⅱ,LC3-Ⅱ含量可反映細胞自噬活性[4,18,20]。Beclin 1蛋白也是自噬必需的分子,與相應受體PI3K3C 結合成Beclin 1/PI3K3C復合物激活細胞自噬調節通路,參與細胞自噬過程[20]。本研究實驗組LC3-Ⅱ、Beclin 1蛋白表達明顯增加,證實SDF-1過表達誘導了胃癌細胞自噬以抵御化療損傷。因此,SDF-1過表達可能部分通過增加胃癌細胞自噬、抑制其凋亡進而參與對奧沙利鉑的獲得性耐藥。研究[21]發現抑制PI3K/Akt/mTOR信號通路能夠促進胃癌細胞發生保護性自噬,而SDF-1能夠對PI3K/Akt通路進行調控。
綜上所述,SDF-1過表達能夠促進SGC7901細胞的增殖,可顯著提高SGC7901細胞對奧沙利鉑的耐藥性,其機制可能與其促進EMT進程以及誘導胃癌細胞自噬增加進而抑制細胞凋亡有關。

