子宮腺肌病小鼠子宮內膜基底/功能層上皮細胞、間質細胞、平滑肌細胞中ROCK1蛋白表達觀察
陶婭玲,朱亮亮,鄒嘉樂,杜威,付先蕓
(1三峽大學人民醫院,湖北宜昌443000;2三峽大學醫學院)
子宮腺肌病(adenomyosis AM)是指子宮內膜向肌層良性浸潤并在其中彌漫性生長。AM的主要病理特征是在子宮肌層中出現了異位的內膜和腺體,伴有其周圍的肌層細胞肥大和增生。年齡>40歲的女性AM發病率高達24.4%[1]。AM患者常常伴隨有月經過多(50%)、痛經(30%)和子宮出血(20%)[2],嚴重影響女性的生活質量。AM是一種良性疾病,但它與癌癥有一些共同特點,如侵襲性和轉移性。腫瘤細胞的遷移、侵襲均需要細胞骨架的重新排列。ras同源基因家族(Rho)蛋白屬于小G蛋白超家族的亞家族成員,到目前為止已發現20多個Rho家族成員,在細胞骨架重組調控方面起重要作用。進一步研究[3]發現,Rho/與Rho相關的蛋白絲氨酸/蘇氨酸激酶(ROCK1)通路參與調控腫瘤細胞骨架的重組。但目前關于Rho/ROCK1信號通路在子宮內膜異位癥及AM發生中的具體作用機制相關研究較少。2018年7~10月,我們觀察了AM小鼠子宮組織及子宮內膜基底層(NJ)/內膜功能層(NG)上皮細胞、間質細胞、平滑肌細胞中ROCK1的表達變化,探討其與內膜侵襲能力的相關性。
1 材料與方法
1.1 動物、試劑及儀器 將出生日設為第1 天,出生2 d的雌性ICR小鼠38只,清潔級,飼養溫度18 ℃~24 ℃,明暗周期12 h,出生21日由母鼠哺乳飼養,22 日齡起與母鼠分籠,自由攝食飲水。ICR小鼠購買自北京維通利華實驗動物技術有限公司,生產許可證號SCXK(京)2016-00061.2。Rho試劑、ROCK1試劑均購于英國Abcam公司(ab40673,ab45171);GAPDH試劑購于中國武漢Servicebio公司(GB12002)。SDS-PAGE電泳儀(廠家Bio-Red,型號Bestell-Nr 40-800),恒溫搖床(廠家LAB,型號LAB-LINE),冷凍高速離心機(廠家Sigma,型號Sigma 1-15K)。
1.2 動物分組及AM造模方法 取38只小鼠,通過隨機區組設計產生隨機序列分為空白組8只,模型組30只。模型組采用初生小鼠枸櫞酸他莫昔芬灌胃法制作AM模型:取第2 天小鼠 滴喂5 μL/g 花生油/卵磷脂/煉乳混合液(體積比為2∶0.2∶3)+2.7 μmol /kg 枸櫞酸他莫昔芬,1次/d,連續滴喂3 d。空白組小鼠不做任何處理,正常飼養。母鼠哺育小鼠期間模型組死亡3只,飼養過程中模型組死亡1只。最后納入統計模型組26只,空白組8只。
1.3 小鼠子宮組織內膜浸潤程度觀察 飼養兩組小鼠至12周齡,引頸處死后取子宮組織,石蠟包埋、切片,HE染色,光鏡下觀察兩組小鼠子宮組織內膜浸潤程度。根據浸潤情況分為4度。0度:無明顯浸潤;1度:輕度浸潤,間質或上皮細胞浸潤至NJ界面下,未超過淺肌層內1/2;2度:中度浸潤,間質及上皮細胞浸潤至淺肌層外1/2;3度:重度浸潤,間質及上皮細胞浸潤至深肌層或漿膜下。
1.4 小鼠子宮組織Rho、ROCK1蛋白檢測 采用Western blotting法。取兩組子宮組織,提取子宮總蛋白,總蛋白定量,PVDF 膜蒸餾水漂洗并封閉加入一抗,洗膜,加入二抗,洗膜,室溫孵育,所有操作均嚴格按照試劑盒說明書進行,以目的條帶的灰度值代表Rho、ROCK1蛋白的相對表達量,實驗重復3次,取平均值。
1.5 小鼠子宮NJ平滑肌細胞、NJ上皮細胞、NJ間質細胞、NG上皮細胞、NG間質細胞ROCK1蛋白檢測 采用免疫組化法檢測兩組小鼠子宮NJ平滑肌細胞、NJ上皮細胞、NJ間質細胞、NG上皮細胞、NG間質細胞ROCK1蛋白。取兩組子宮組織,石蠟切片脫蠟處理,3%H2O2室溫孵育,蒸餾水沖洗,PBS 浸泡,封閉,加一抗 孵育,PBS沖洗,滴加二抗,孵育,PBS 沖洗,滴加適量的辣根酶工作液,孵育,顯色,PBS沖洗,自來水充分沖洗,復染,脫水,透明,封片。利用 BI-2000系統,在光鏡下( 10×20倍)選取相同部位相同視野照相分析,計算每個視野陽性染色的平均光密度OD值。重復3 次,取平均值。
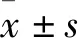
2 結果
2.1 兩組小鼠子宮組織內膜浸潤程度比較 空白組子宮組織無內膜浸潤,模型組AM病灶輕度、中度、重度浸潤分別為8、12、6例。
2.2 兩組小鼠子宮組織Rho、ROCK1蛋白相對表達量比較 模型組、空白組子宮組織Rho相對表達量分別為0.442±0.094、0.109±0.073,二者比較,P<0.01;模型組、空白組子宮組織ROCK1相對表達量分別為1.554±0.079、0.079±0.006,二者比較,P<0.01。
2.3 兩組小鼠子宮NJ平滑肌細胞、NJ上皮細胞、NJ間質細胞、NG上皮細胞、NG間質細胞ROCK1蛋白表達比較 結果見表1。
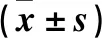
表1 兩組小鼠子宮NJ平滑肌細胞、NJ上皮細胞、NJ間質細胞、NG上皮細胞、NG間質細胞ROCK1蛋白OD值比較
注:與空白組比較,*P<0.05;與模型組NJ上皮細胞、NJ間質細胞比較,#P<0.05;與模型組NJ上皮細胞比較,&P<0.05。
2.4 不同浸潤深度的AM小鼠NJ平滑肌細胞、NJ上皮細胞、NJ間質細胞、NG上皮細胞、NG間質細胞ROCK1蛋白OD值比較 結果見表2。
2.5 AM小鼠子宮NJ上皮細胞、NJ間質細胞、NG上皮細胞、NG間質細胞ROCK1蛋白表達相關性 AM小鼠子宮NJ上皮細胞、NG上皮細胞ROCK1蛋白表達呈正相關(r=0.913,P<0.05);AM小鼠子宮NJ上皮細胞、NJ間質細胞ROCK1蛋白表達呈正相關(r=0.893,P<0.05);AM小鼠子宮NG上皮細胞、NG間質細胞ROCK1蛋白表達呈正相關(r=0.866,P<0.05);AM小鼠子宮NG間質細胞、NJ間質細胞ROCK1蛋白表達呈正相關(r=0.897,P<0.05)。
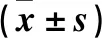
表2 不同浸潤深度的AM小鼠NJ平滑肌細胞、NJ上皮細胞、NJ間質細胞、NG上皮細胞、NG間質細胞ROCK1蛋白OD值比較
注:與無浸潤比較,*P<0.05;與重度浸潤比較,#P<0.05。
3 討論
目前常規內分泌治療及手術治療AM不良反應較大,尤其不適合有生育要求的女性。AM具有侵襲性、轉移性等特點。現有研究已證實,腫瘤細胞的遷移和侵襲需要細胞骨架的重新排列。參與細胞骨架結構形成的肌動蛋白絲、微管和中間絲,如應力纖維和假足,可促進腫瘤細胞的侵襲和轉移能力的提高。Rho和ROCK1信號通路參與了細胞骨架的調控[4]。ROCK1可提升細胞骨架中肌球蛋白輕鏈(myosin light chain,MLC)的磷酸化水平,增加肌動-肌球蛋白的收縮力,為細胞遷移提供持續運動的動力,促使細胞的遷移能力提高。ROCK1通路參與了從靜態到遷移細胞行為的轉變,ROCK1信號調控細胞骨架影響腫瘤遷移細胞骨架的機制已在卵巢癌[3]、乳腺癌[5]、胰腺癌[6]、肺腺癌細胞[7]等腫瘤細胞中得以證實。本實驗結果顯示,AM小鼠子宮組織Rho與ROCK1的表達水平升高,與現有的研究結果一致[8]。進一步研究表明,不同部位的ROCK1表達在輕度浸潤組、中度浸潤組及重度浸潤組間存在顯著差異。研究[9]亦證實,ROCK1在中重度痛經AM患者中顯著升高,該結果表明ROCK1的高表達可通過調節細胞骨架、增強細胞遷移能力從而顯著增強AM的浸潤能力,導致相關臨床癥狀發生。
子宮內膜異位癥、AM起源于基底層的子宮內膜,大部分研究關注基底層子宮內膜的特性,子宮腺肌病患者功能層和基底層子宮內膜在激素表達及其受體表達方面確證存在明顯的生物學差異[10]。但現有研究[11]也逐漸認識到,AM的侵襲性并不是由單一的基底層細胞遷移機制驅動的,而是由組織損傷和修復機制的介入及細胞化生造成的上皮-間質轉變(epithelial-mesenchy mal transition, EMT)兩個過程的時間依賴組合驅動。同時,本實驗表明,不同組別ROCK1的表達變化并不局限在基底層,基底層內膜及功能層內膜并無無顯著差異,該結果證實,內膜侵襲能力的形成不僅發生在基底層,功能層內膜的功能異常也參與其中,考慮遠離基底層的功能層子宮內膜會出現周期性的內膜剝脫與修復過程。因此,ROCK1上調的發生機制部分可能與內膜功能層組織持續損傷與修復機制的異常有關。
EMT是指上皮細胞在特定的生理和病理情況下向間質細胞轉分化的現象。在EMT過程中,上皮細胞失去細胞極性,喪失細胞間緊密連接和粘附連接,獲得了浸潤性和游走遷移能力,變成了具有間質細胞功能和特性的細胞。EMT在腫瘤中賦予細胞遷移、浸潤的能力。而AM的內膜細胞的侵入過程與這一過程非常相似,EMT現在已經被證實通過促進侵襲和纖維發生參與了子宮內膜異位癥的發展[12]。人結直腸癌HCT116細胞中,Rho鳥嘌呤核苷酸交換因子以一種依賴EMT狀態的方式上調,并通過激活Rho/ROCK1通路促進細胞遷移[13]。本實驗結果表明無論在NJ層或內膜功能層,ROCK1的表達上皮細胞顯著高于間質細胞,間質細胞與上皮細胞表達具有顯著相關性。該結果證實,上皮及間質細胞在調節細胞骨架重排列、從而導致內膜侵襲能力的異常增強中有相似的作用,推測與AM發生機制中存在EMT[14]、上皮細胞與間質細胞具有部分同源性有關。
綜上所述,AM小鼠子宮組織Rho、ROCK1高表達,子宮NJ、NG不同細胞ROCK1蛋白均呈高表達。子宮不同部位上皮細胞ROCK1蛋白的表達與間質表達呈正相關,ROCK1蛋白高表達與AM的侵襲能力相關。Rho/ROCK1通路與AM侵襲能力相關,AM的發生機制并不僅僅局限于內膜基底層,同時與內膜功能層的損傷與修復機制的異常介入有關。AM發生時,上皮細胞、間質細胞及平滑肌細胞內ROCK1的表達同步上調,可能與因EMT而產生的細胞同源性有關,尚待進一步的研究。

