XIAP在H2O2誘導牙周膜細胞凋亡的機制研究
魏謀達,張 寧,邢澤峰,尹曉偉,李志斌,段銀鐘
(1.南京牙博士口腔醫院,江蘇 南京 210005;2.空軍軍醫大學 口腔醫學院,陜西 西安 710032)
牙周膜成纖維細胞是常見的牙周膜細胞(Periodontal ligament,PDLC),其死亡方式主要有3種:細胞自噬、細胞壞死以及細胞凋亡[1]。H2O2是口腔臨床治療藥物,不僅具有治療作用,還可誘發組織的氧化應激反應,導致牙周膜細胞凋亡。因此,研究H2O2誘導凋亡機制非常重要,這樣才能有效地防止細胞非正常死亡。
連鎖凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)是凋亡抑制蛋白家族中最強的內源性抑制因子,可通過不同的信號轉導通路及調控相關凋亡蛋白酶的表達產生抗凋亡作用[2]。XIAP 的抑制活性在于氨基端的BIRD(baculovirus IAP repeats domain,BIRD)功能域及其之間的連接區域,以及羧基端的環狀鋅指結構[3]。有研究表明,XIAP能直接結合并抑制caspase-3、7、9[4-5]。XIAP除抑制caspase 外,還受多種因子的調節。有研究表明,Akt在體外或體內都可以作用于XIAP;另外,XIAP的自我泛素化也被Akt 抑制。因此可認為XIAP 是Akt的下游靶標,是Akt效應通路主要介質[6]。c-Jun N-terminal kinase (JNK),glycogen synthase kinase-3β(GSK3β)以及 protein kinase B (Akt) 3種激酶在細胞凋亡中均起重要作用。但前兩者與XIAP的關系目前尚不清楚。
因此,在本研究中我們探討XIAP在H2O2誘導PDLC凋亡中的作用,研究XIAP與 Akt、JNK2以及GSK3β之間的關系,為牙周驗證的預防和治療及組織的修復重建提供理論依據。
1 材料與方法
1.1 儀器 CO2恒溫培養箱(Heal Force,德國);Asinvert 200倒置相差顯微鏡(Nikon,日本);超凈化工作臺(Thermo Forma,美國);高速低溫離心機(Backman,美國);流式細胞儀(BD,美國);酶標儀、恒壓電泳儀、Western-blot 轉印儀、微量蛋白轉移印跡分析儀(Bio-Rad,美國)。
1.2 試劑 宿主菌 DH5α為本實驗室保存。質粒載體pWPI和pLVTHM(Addgene美國);高保真 PrimeSTAR?HS DNAPolymerase、DL2000 marker、T4DNA 連接酶、dNTP 及XbaI等各種限制性內切酶(TaKaRa,日本);PCR 產物膠回收試劑盒、質粒小提取及純化試劑盒(上海生工,中國);PRIM-1640、高糖DMEM、胎牛血清(GIBCO,美國);高效真核轉染試劑(JetPei polyplus,法國);Anti-XIAP抗體(BD,美國);Anti-GAPDH、Anti-β-actin、Anti-PTEN、Anti-JNK2、Anti-Akt、Anti-pAkt、FITC-Goat Anti-Mouse 一抗、FITC-Goat Anti-Mouse 二抗(Sigma,美國);Anti-GSK3β(abnova,中國臺灣);c-jun、AP-1(Abcam,美國);HRP標記的兔抗小鼠二抗、HRP 標記的羊抗兔二抗(康為世紀,中國);SDS-PAGE試劑盒(碧云天,國產);BCA 蛋白定量試劑盒(Thermo Forma,美國);Annexiv/PI 凋亡檢測試劑盒(BD,美國)。
1.3 方法
1.3.1 PDLCs的原代培養 將新拔除的離體牙放入預冷的含100 U/mL青霉素和100 U/mL 鏈霉素的α-MEM培養基中,送至實驗室培養。本實驗經第四軍醫大學口腔醫學院倫理委員會審批。原代培養方法根據文獻采用組織塊-酶消化聯合培養技術[7],顯微鏡下觀察細胞的生長、形態及排列情況并照相記錄。
1.3.2 Western blot檢測XIAP、Caspase-3、Caspase-8、PTEN的表達 未經 H2O2處理的PDLC細胞作為對照組。PDLC經125或250 μM H2O2處理48、72 h后,收集細胞,加入預冷的細胞裂解液,冰上放置15~30 min,細胞充分裂解12 000 rpm離心。電壓濃縮膠60 V,分離膠80 V進行SDS-PAGE電泳,半干法轉膜。NC膜用1%脫脂奶粉室溫封閉2 h,加入XIAP、Caspase-3、Caspase-8、PTEN(均為1∶1 000)等一抗,4 ℃過夜,次日加入二抗,室溫下振搖1~1.5 h。加入底物顯色液,室溫避光顯色,膠片曝光采集圖像。
1.3.3 XIAP基因過表達和沉默PDLC細胞株的建立 以感染倍數(multiplicity of infection,MOI)100 進行腺病毒轉染。感染前細胞生長24 h,吸出培養基,用無血清無抗生素α-MEM洗滌 2 次;確定所需病毒顆粒量(=細胞數×MOI),用無血清無抗生素α-MEM稀釋病毒液,盡量減少α-MEM體積,能覆蓋細胞表面即可;輕輕傾斜和搖晃培養器皿,使病毒液均勻分布,置于37 ℃孵箱中孵育2 h,每隔15 min輕輕傾斜轉動培養器皿,促進感染;2 h后,補加適當體積的完全培養基,繼續孵育22 h(共感染24 h);更換培養基,繼續孵育。過表達和基因沉默后,以PDLC細胞作為對照組,Western blot檢測 XIAP 蛋白的表達,以確定轉染效果。流式細胞儀檢測轉染效率達 80%。
1.3.4 過表達及沉默XIAP后,流式細胞儀器檢測細胞凋亡 轉染XIAP 48 h后加入250 μM H2O2作用72 h,胰酶消化,1 000 rpm離心5 min,去除上清液,預冷PBS清洗2次。加 400 μL 結合緩沖液,重懸細胞,加入Annexin-V-FITC 5 μL,放置于4℃冰箱中避光孵育15 min。加入碘化丙錠(PI)10 μL,避光孵育5 min,上流式細胞儀檢測。
1.3.5 過表達及沉默XIAP后對Akt、p-Akt、JNK2、GSK3β表達的影響 培養24 h后進行細胞轉染,繼續培養48 h后加入濃度為 250 μM的H2O2在 37 ℃5 % CO2及飽和濕度條件下繼續培養48 h,Western blot檢測相關蛋白表達。
1.3.6 過表達XIAP后免疫熒光檢測Akt、p-Akt 濃度為 1x106/mL 的細胞懸液,接種到在鋪有蓋玻片的 24 孔細胞培養板,至 60%~80%時進行轉染重組質粒 DNA,培養24 h后用250 μM的H2O2刺激,然后培養48 h。PBS 洗1次,4%多聚甲醛固定20~30 min。加入50 mM NH4Cl,放置10 min。0.1%~0.2% Triton-100 透化4 min。5%BSA 封閉20~30 min。分別加入Akt(1∶200)、p-Akt(1∶400) (0.5%BSA 稀釋),室溫孵育2 h。加二抗(0.5%BSA 稀釋),室溫避光孵育 60 min。滴一滴封片液于載玻片上。指甲油封住蓋玻片四周,避光置于 4℃或免疫熒光顯微鏡下觀察結果。
1.3.7 激光共聚焦顯微鏡測定c-jun、Ap-1在細胞中的定位和表達 濃度為1×106/mL 的細胞懸液,接種到在鋪有蓋玻片的 24 孔細胞培養板,至60%~80%時進行轉染重組質粒 DNA,培養24 h后用250 μM的H2O2刺激,然后培養48 h。PBS 洗1次,4%多聚甲醛固定20~30 min。加入50 mM NH4Cl,放置10 min。0.1%~0.2% Triton-100 透化4 min。5%BSA 封閉20~30 min。分加入c-jun、Ap-1(均為1∶400,0.5%BSA 稀釋),室溫孵育2 h。加二抗(0.5%BSA 稀釋),室溫避光孵育 60 min。滴一滴封片液于載玻片上。指甲油封住蓋玻片4周,避光置于 4℃或激光共聚焦顯微鏡下觀察結果。
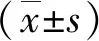
2 結果
2.1 牙周膜細胞形態和鑒別 多數細胞具有 2 到 3 個細胞核,細胞排列較為規律,呈束狀,或者漩渦狀并表現為放射性狀態(見圖1A)。對傳代后的第 3代細胞進行 HE 染色,細胞多呈現出多角形,細胞質能夠被伊紅染色,細胞核則嗜堿性,多數為規則的圓形或者橢圓,處于細胞的中心位置(圖1B)。免疫組化結果表明抗波形蛋白染色陽性,抗角蛋白染色陰性染色,堿性磷酸酶染色陽性(見圖1C-E),符合牙周膜細胞的生物特性。

圖1 牙周膜細胞形態及鑒定
2.2 H2O2對XIAP、Caspase-3、Caspase-8、PTEN表達的影響 250 μM H2O2刺激PDLC細胞72 h后, XIAP蛋白表達量顯著下調 (P<0.05)(見圖2A)。 Caspase-3、Caspase-8和PTEN蛋白表達隨H2O2濃度及作用時間增加逐漸增加,具有統計學顯著性差異(見圖2B)。

A:XIAP蛋白的表達;B:Caspase-3、Caspase-8和PTEN蛋白的表達;與24h-0比較*:P<0.05,**:P<0.01。 圖2 不同劑量H2O2處理后,XIAP、Casepase-3、Casepase-8及PTEN的表達
2.3 過表達及沉默對XIAP表達的影響 過表達組XIAP蛋白表達顯著上調,而沉默組XIAP蛋白表達顯著下調(見圖3),表明過表達和沉默載體構建成功。

圖3 過表達和沉默XIAP對XIAP蛋白的影響
2.4 過表達及沉默對H2O2誘導PDLC凋亡的影響 采用PI-FITC雙染檢測細胞凋亡(見圖4)。Control為對照組,細胞凋亡率為2.48%;250為250 μM H2O2作用PDLC細胞72 h,細胞凋亡率為22.05%;XIAP為250 μM H2O2作用過表達XIAP細胞組72 h,細胞凋亡率為8.05%,相比250細胞存活率增加。沉默XIAP后,細胞凋亡率為27.91%。

圖4 過表達及沉默XIAP對細胞凋亡的影響
2.5 過表達及沉默XIAP對Akt、p-Akt、JNK2、GSK3β表達的影響 過表達XIAP后,250 μM H2O2作用72 h,與給予PDLC細胞250μM H2O2作用72 h后比較(250),Akt、p-Akt、JNK2和GSK3β蛋白表達有所恢復甚至超過對照組,Akt、JNK2和GSK3β為極顯著差異(P<0.001),p-Akt為顯著性差異(P<0.05)。但沉默XIAP后,與對照組(control)比較,Akt、JNK2和GSK3β蛋白表達均顯著下降,Akt、p-Akt、JNK2為極顯著差異(P<0.001),GSK3β為顯著性差異(P<0.05)。

*:P<0.05,**:P<0.01,***:P<0.001。 圖5 過表達和沉默XIAP對 AKT、p-Akt、JNK2及GSK3β表達的影響
2.6 免疫熒光檢測過表達 XIAP對Akt及p-Akt的影響 經250 μM H2O2處理72 h后,與對照組比較,紅色和綠色熒光變弱,而紫色熒光變化不大,說明H2O2處理組細胞內Akt、p-Akt和GFP蛋白均有所減少。與對照組相比,XIAP過表達組Akt、p-Akt和GFP蛋白表達均增加。說明正常狀態下,XIAP可能和Akt及p-Akt相互作用(見圖6)。
2.7 激光共聚焦顯微鏡檢測過表達 XIAP對c-jun、Ap-1的影響 與對照組比較,過表達XIAP組熒光強度均增強,說明c-jun及AP-1蛋白表達增加(見圖7)。

圖6 免疫熒光檢測AKT,p-Akt(400×)

圖7 過表達 XIAP對GSK3β信號通路的影響
3 討論
50μM H2O2作用48 h后,XIAP蛋白表達無顯著性變化(P>0.05),作用72 h后,XIAP蛋白顯著降低(P<0.05);隨著H2O2濃度和作用時間增加,XIAP 蛋白的表達受到抑制,Caspase-3、Caspase-8和PTEN顯著增加促進細胞凋亡[8]。說明 XIAP 蛋白的表達與細胞凋亡成負相關,與Takahashi等[9]的結論一致。
本研究中,我們采用流式細胞術檢測沉默和過表達XIAP對細胞凋亡的影響。與對照組比較,250μM H2O2作用正常細胞組72 h后凋亡率顯著上升;過表達XIAP給予250μM H2O2作用72 h后,細胞凋亡率顯著下降。此外,沉默XIAP后,細胞凋亡率顯著上升。有研究表明,目前已證明 XIAP 在人體的多種組織中表達,在正常組織中低水平表達,而在多種惡性腫瘤中表達明顯升高[10-11]。說明過表達 XIAP能夠增強細胞的抗逆作用,同時引導細胞的無限增殖;沉默XIAP后,某些癌癥細胞的死亡受體或者細胞毒性藥物能夠很好的誘導細胞凋亡[12],說明XIAP蛋白在調節細胞凋亡具有非常重要的意義。
有關XIAP抗凋亡的機理的研究較少,尚沒有XIAP蛋白的相關報道,另外,XIAP在氧化損傷所致細胞凋亡中的作用以及其與Akt/JNK/AP-1細胞通路間的關系并不明確。本研究中,我們通過Western blot檢測過表達和沉默XIAP對Akt及p-Akt的影響。結果表明,過表達XIAP能夠對AKT的表達起到極顯著性的修復作用(P<0.001),同時也能對p-Akt的表達進行恢復,并超過自然狀態下內源性p-Akt的量,以上結果表明,適當調控XIAP和p-Akt蛋白,也許可以逆轉Akt誘導細胞凋亡。
XIAP是JNK信號通路一個重要的抑制蛋白,有實驗表明TGF 處理后,XIAP基因產物上調,同時導致JNK信號通路關閉[13]。本研究中,過表達XIAP后,250μM H2O2作用72 h,與給予PDLC細胞250μM H2O2作用72 h后比較(250),JNK2的表達顯著增加(P<0.05);沉默XIAP后,與對照組比較,JNK2蛋白表達顯著下降。此外,激光共聚焦顯微鏡證實過表達XIAP后,細胞中的C-jun以及AP-1和AKT蛋白的表達均增加。該結果說明XIAP能夠調節并控制JNK2蛋白表達水平,從而抑制細胞凋亡。
在后續的研究中,我們可以將XIAP在保護細胞遭受如H2O2等強氧化劑作用的與其他蛋白的耦合作為一個突破口,這樣就可能找到XIAP是通過哪些通路分別與JNK,GSK以及Akt信號通路共同調控細胞的存活,這將會是我們對牙周再生領域的一次積極探索。

