房顫患者血清CICP、PICP、BNP、AngⅡ水平與心功能的相關性
李彥明,何瑞利,鐘曉鳴,張 蕾,程冠昌
(河南大學淮河醫院心血管內科,河南開封 475000)
心房顫動也稱房顫,是臨床常見的心律失常疾病,是由心房主導的折返環誘發的房律紊亂[1]。房顫是引起心血管疾病患者殘疾或死亡的重要原因。房顫的發病機制尚不明確,但根據蔣埜等[2]的研究表明,心房纖維狀是引發房顫的重要原因。根據不同的發作特點,可將房顫分為陣發性、持續性和永久性房顫。細胞外基質(ECM)進行重構是心肌重構的實質,心肌膠原是細胞外基質的主要成分。為維持和調節細胞外基質的結構,在心肌組織的成纖維細胞中存在組織型基質金屬蛋白酶抑制因子-1(TIMP-1)和基質金屬蛋白酶-1(MMP-1)的表達[3]。本研究通過測定房顫患者體內血清的膠原代謝產物水平,探討代謝產物水平與心功能的關系,現報道如下。
1 資料與方法
1.1一般資料 選取2016年3月至2017年5月本院120例房顫患者作為房顫組,60例竇性心律患者作為對照組。房顫組男64例、女56例,年齡43~79歲,平均(58.2±12.6)歲,體質量指數(BMI)為(23.1±2.2)kg/m2,其中持續性心房顫動患者70例、陣發性房顫患者50例,伴有心衰患者58例;患者收縮壓/舒張壓(126.3±11.0)/(71.4±10.0)mm Hg,吸煙33例。對照組男33例、女27例,年齡37~78歲,平均(56.0±14.3)歲, BMI(22.8±2.4)kg/m2,收縮壓/舒張壓(125.0±9.7)/(72.3±8.6)mm Hg,吸煙15例。兩組的年齡、性別、BMI、血壓、吸煙率比較,差異均無統計學意義(P>0.05)。
1.2納入及排除標準
1.2.1納入標準 (1)房顫患者的診斷參考NICE《房顫診療指南》2014中文版中的標準;(2)患者年齡小于或等于79歲;(3)心衰患者的診斷參考紐約心臟病協會(NYHA)制定的診斷標準;(4)對照組為竇性心律的健康體檢對象;(5)獲得研究對象的知情同意。
1.2.2排除標準 患者有(1)影響肝、腎功能的疾病;(2)惡性腫瘤;(3)凝血系統疾病;(4)甲狀腺疾病;(5)伴有急慢性炎癥、感染性疾病;(6)新瓣膜疾病、心肌炎、先天性心臟病患者;(7)代謝疾病、結締組織疾病、免疫系統疾病。
1.3方法 取房顫患者清晨空腹肘部靜脈血8 mL,置入非抗凝試管中,室溫下靜置15 min待自然凝固,置于離心機內4 000 r/min離心15 min(室溫),取分離血清置于-80 ℃環境中保存備用。利用酶聯免疫吸附試驗(ELISA)檢測設備,根據操作說明分別對CICP、PICP、BNP、AngⅡ進行檢測。全部過程使用電化學發光設備盒。利用超聲心動圖檢測房顫組的左房內徑、左室射血分數。
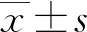
2 結 果
2.1血清CICP、PICP、BNP、AngⅡ水平比較 房顫組血清CICP、PICP、BNP、AngⅡ水平顯著高于對照組,差異均具有統計學意義(P<0.05),見表1。
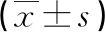
表1 兩組研究對象的血清CICP、PICP、BNP、AngⅡ水平比較
2.2伴有心衰的房顫患者與心功能正常的房顫患者心功能指標比較 伴有心衰的房顫患者的左房內徑顯著高于心功能正常組(P<0.05),左室射血分數顯著低于心功能正常組(P<0.05),見表2。
2.3伴有心衰的房顫患者與心功能正常的房顫患者血清CICP、PICP、BNP、AngⅡ水平比較 伴有心衰的房顫患者的血清CICP、PICP、BNP水平顯著高于心功能正常組(P<0.05),血清AngⅡ水平與心功能正常組比較差異無統計學意義(P>0.05),見表3。
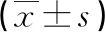
表2 合并心衰的房顫患者與心功能正常的房顫患者心功能指標比較
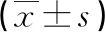
表3 伴有心衰的房顫患者與心功能正常的房顫患者血清CICP、PICP、BNP、AngⅡ水平比較
2.4相關性分析結果 伴有心衰的房顫組患者的血清CICP、PICP、BNP水平與患者左房內徑呈顯著的正相關系(P<0.05),與患者左室射血分數呈顯著的負相關關系(P<0.05);血清AngⅡ水平與伴有心衰的房顫組患者的左房內徑、左室射血分數相關性不顯著(P>0.05),見表4。
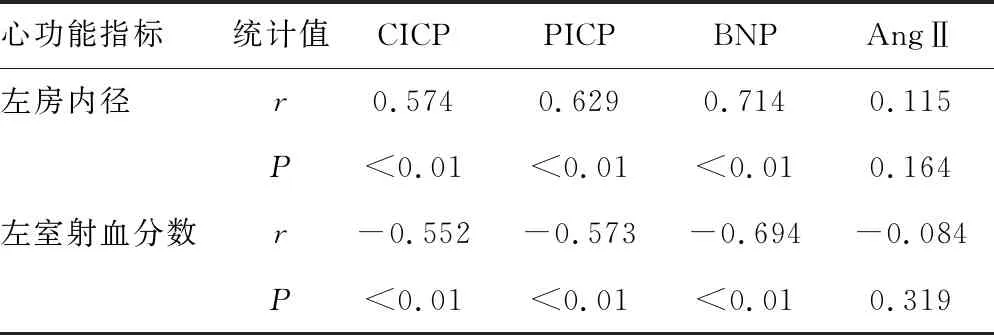
表4 相關性分析結果
3 討 論
房顫是臨床比較常見的心律失常,主要是由心房主導的小折返環造成的房律紊亂[4]。臨床研究根據房顫不同發作特點進行分類,心房顫動是由于多重折返小波引起間歇性快速而不規則的心房節律,是起搏點在心房的異位性心動過速。其中1周內可自行終止的屬于陣發性房顫,1周以上或者需要藥物干預方能終止的為持續性房顫。心房重構是近年臨床研究的房顫的主要發生機制,心房重構包括心房電重構、結構重構和離子重構3種[5]。寧偉明等[6-8]研究認為,白細胞介素-6和腫瘤壞死因子-α對房顫具有維持作用。但炎性反應以及心房電重構尚未完全解釋持續性房顫的主要機制。班向陽等[9-10]研究表明,心房重構能夠對向異性傳導產生促進激動作用,增加心肌細胞之間耦聯的異質性,縮短波長產生的阻滯,促進折返機制的產生,為房顫產生奠定基礎。心房結構進行重構主要表現為心房纖維化,心房纖維化的主要實質是細胞外基質內部產生的膠原纖維水平升高,造成產量堆積現象,膠原水平過高或膠原內部成分發生改變。
MMP-1可降解膠原蛋白Ⅰ生成ICTP,因此認為ICTP是Ⅰ型膠原蛋白降解的重要標志物[11-12]。TIMP-1是MMP-1的特異性抑制因子,能抑制MMP-1活性,降低膠原蛋白降解量,促進心房纖維化[13]。Ⅰ型膠原的伸展性較強,若Ⅰ型膠原表達水平增加會促進心房增大,可容納的折返子波增多,從而導致房顫發生和維持。
Ⅰ型膠原蛋白在細胞外基質中比例較大,其水平增加可導致心房纖維化現象明顯。黎潔雯等[14-15]研究表明,Ⅰ型膠原蛋白的合成伴隨CICP、PICP、BNP的釋放,并且認為這3種成分的水平是心房纖維化的重要標志。這與本研究結果中,伴有心衰的房顫患者血清CICP、PICP、BNP水平比心臟功能正常患者血清水平高,提示心衰患者心房纖維化與CICP、PICP、BNP的水平可能具有一定的相關性,房顫患者細胞外基質內合成與降解的平衡遭到破壞,心房纖維化與房顫的產生機制關系密切。在本研究中,CICP、PICP、BNP水平與患者左心房內徑呈正相關,與左心室射血分數呈負相關,提示房顫患者左心房的內徑增大,左心室射血分數降低,房顫維持時間長,左心房內徑和左心室射血分數變化越明顯。提示可能CICP、PICP、BNP因膠原蛋白被MMP-1降解水平升高,心肌纖維化嚴重。而在全部研究分析中,兩組患者血清AngⅡ水平與心房纖維化、房室內徑大小及射血分數皆無明顯差異,可能原因為炎癥因子對AngⅡ的促進作用較小,其在血管中水平變化不大。
綜上所述,房顫患者的血清CICP、PICP、BNP水平是心房纖維化的重要標志物,3者水平升高可促進心房纖維化,導致心衰,而血清AngⅡ水平在心衰患者中無明顯意義,本研究結果提示通過檢測CICP、PICP、BNP,在臨床預測房顫患者心房纖維化及心衰的嚴重程度有一定的價值。

