DPMAS序貫血漿置換治療乙型肝炎病毒相關慢加急性肝衰竭的短期療效
農村立,郭 塹,韋秋芳,黃金麗,彭雪寒
(廣西醫科大學第四附屬醫院/柳州市工人醫院感染性疾病科,廣西柳州 545005)
慢加急性肝衰竭是在慢性肝病基礎上短期內發生急性或亞急性肝功能失代償的臨床癥候群,是我國最為常見的肝衰竭臨床類型,主要病因是乙型肝炎病毒(hepatitis B virus,HBV)感染[1]。慢加急性肝衰竭病死率可高達60%~70%,且近年來有逐漸升高的趨勢[2-3]。慢加急性肝衰竭一旦確診,在采用內科綜合治療的基礎上,應早期進行人工肝治療,并根據病情發展情況進行肝移植[1]。本研究對比觀察了雙重血漿分子吸附系統(double plasma molecular adsorb system,DPMAS)序貫血漿置換(plasma exchange,PE)和單純PE兩種非生物型人工肝治療方法在12周內的短期療效,現報道如下。
1 資料與方法
1.1一般資料 以2015年1月至2017年12月在廣西醫科大學第四附屬醫院住院治療的乙型肝炎病毒相關慢加急性肝衰竭患者為研究對象。所有患者均為HBV感染者,診斷符合2012年《肝衰竭診療指南》[1],排除合并其他肝炎病毒感染及合并人類免疫缺陷病毒感染者,排除膽汁性、酒精性肝病及自身免疫性肝病,排除藥物中毒導致的肝衰竭,排除肝臟腫瘤或接受肝移植患者,排除伴有腎臟基礎疾病引起的腎功能不全或長期抗凝治療的患者。所有患者住院期間均接受相類似的抗病毒、護肝、對癥支持等內科綜合治療。本研究由本院倫理委員會審核通過且所有患者均簽署知情同意書。
1.2分組方法 利用隨機數字表法將患者分為觀察組和對照組。觀察組人工肝治療采用DPMAS序貫PE技術,即采用先行PE后行DPMAS的方案;對照組采用PE方案。
1.3設備與耗材 偉力WLXGX-8888;MPS05血漿分離器(意大利貝爾克),HA330-Ⅱ樹脂血液灌流器(珠海健帆),BS330血漿膽紅素吸附柱(珠海健帆),雙腔深靜脈導管(益心達),一次性體外循環血液管路(天益好)。
1.4方法 PE方法:術前按血漿置換模式連接管路,肝素化預沖洗管路方法同前,治療前常規使用地塞米松5 mg靜脈注射、10%葡萄糖酸鈣20 mL加入5%葡萄糖氯化鈉250 mL中靜脈滴注,預防過敏;置換液采用新鮮冰凍血漿;術中血流速度100~150 mL/min,血漿分離速度20~30 mL/min。每次血漿置換量為 2 000~2 500 mL;治療結束后用硫酸魚精蛋白注射液對抗肝素,劑量為肝素總量的一半(最多不超過50 mg),每次治療時間為120~180 min,治療間隔3~5 d,根據病情決定治療次數。
DPMAS序貫PE方法:術前按血漿置換模式連接管路,血漿置換量1 000~2 000 mL,操作方法同PE。DPMAS序貫治療前需要預先用0.9%生理鹽水1 000 mL進行預沖,排盡管路及柱體內氣體,再用500 mL肝素鈉生理鹽水(含肝素鈉20 mg)進行肝素化預沖,10~30 min達到肝素化后將整個管路密閉;選擇肝素鈉10~20 mg作為抗凝劑,并根據病情及凝血功能調整用量;術中血流速度100~120 mL/min,控制血漿分離速度20~30 mL/min,吸附時間一般為120~180 min或血漿處理量3 600~5 400 mL;治療結束用硫酸魚精蛋白注射液對抗肝素,劑量為肝素總量的一半(最多不超過50 mg);治療間隔3~5 d,根據患者病情決定治療次數。
1.5觀察指標和隨訪 以人工肝治療前1天作為隨訪起點,收集所有患者的臨床資料,包括性別、年齡、隨訪起點后的住院時間、人工肝治療次數、血漿用量、血清總膽紅素(TBIL)、清蛋白(ALB)、丙氨酸氨基轉移酶(ALT)、凝血酶原時間國際標準化比值(INR)等;以患者隨防12周內生存或死亡為隨訪終點。終點判斷標準:住院期間患者病情惡化、放棄搶救治療出院或死亡判斷為死亡病例;患者12周后返院復診為生存病例;對于未復診者,電話隨訪確定患者生存或死亡。
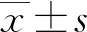
2 結 果
2.1一般資料 共64例符合入選要求的病例進入研究,男55例(85.9%),女9例(14.1%),年齡24~66歲,平均(39.30±8.65)歲。其中觀察組(DPMAS+PE)33例,對照組(PE)31例,所有患者人工肝治療前臨床資料和血清生化指標見表1。
2.2人工肝治療后的臨床資料 64例患者經人工肝治療并完成12周隨訪,觀察組(DPMAS+PE)生存者27例,對照組(PE)生存者25例,兩組生存率比較差異無統計學意義(81.82%vs. 80.64%,χ2=0.184,P=0.831)。兩組患者隨訪期間人工肝治療次數、血漿用量和住院時間,見表2。
2.3人工肝治療對生存患者血清生化學指標的影響 隨訪12周,55例生存患者治療前后臨床資料和血清生化指標,見表3。其中存活患者中,觀察組的平均血清總膽紅素在2周、4周的隨訪觀察中分別下降了49.84%和52.07%,較對照組的29.74%和46.08%更有優勢;同時,4周內對照組蛋白丟失和INR增加的情況也較對照組明顯。兩組患者血清總膽紅素變化趨勢,見圖1;血清清蛋白時間變化趨勢,見圖2;血清INR比較變化趨勢,見圖3。

表1 64例患者人工肝治療前臨床資料和血清生化學指標

表2 64例患者人工肝治療后的臨床資料

表3 55例生存患者治療前后血清生化指標比較

續表3 55例生存患者治療前后血清生化指標比較

圖2 患者血清清蛋白變化趨勢

圖3 患者血清INR變化趨勢
3 討 論
單純PE技術雖然具有技術簡單,醫療成本相對較低的特點,但在臨床用血日益緊張的形式下,單純PE的人工肝臨床應用正逐漸受到限制。DPMAS技術的出現,很大程度上緩解了人工肝技術對于患者外源血漿的需求壓力。在人工肝治療中,將分離出的血漿依次送入BS330膽紅素吸附柱、HA330-Ⅱ型血液灌流器后再回入患者體內,這種全新的組合方式,利用了廣譜吸附劑和特異性吸附劑,使得DPMAS不僅能夠吸附膽紅素,還能清除炎癥介質,又彌補了特異性吸附膽紅素的不足,因此理論上DPMAS技術不需要外源血漿亦可開展[4-6]。但在治療HBV相關慢加急性肝衰竭的實際臨床應用中,發現其臨床療效往往不如PE[7-9],因此DPMAS聯合PE是人工肝治療中平衡血漿用量和臨床療效的捷徑[10-12]。
本研究發現,85.9%的患者采用DPMAS序貫PE技術或單純PE治療后肝功能均獲得較好改善,12周內隨訪兩組的生存率差異無統計學意義(t=0.184,P=0.831),提示在治療乙型肝炎病毒相關慢加急性肝衰竭中,短期內DPMAS序貫PE相對于單純PE技術而言并未使得患者獲得更高的生存收益,但大部分患者治療后肝功能改善。但在4周內的隨訪觀察中,DPMAS序貫PE技術的血清膽紅素清除效率和下降趨勢較單純PE技術更為明顯,觀察組的平均血清總膽紅素在2周、4周的隨訪觀察中分別下降了49.84%和52.07%,較對照組的29.74%和46.08%更有優勢,可見采用DPMAS序貫PE技術使得在減少人工肝治療次數和縮短住院時間上均優于單純PE技術。
本研究也發現,在人工肝治療期間(4周內),DPMAS序貫PE對于血漿清蛋白和凝血功能的影響相對于單純PE治療更為明顯,但結束人工肝治療后,隨著病情的改善,低蛋白血癥和凝血功能異常均能得到恢復。分析原因,考慮與人工肝治療中選用的血漿分離器未能很好分離血漿中清蛋白和術后肝素化中和不充分相關,提示雖然聯合PE能一定程度彌補單純DPMAS無法補充凝血因子、清蛋白的不足,但畢竟血漿內此類相關成分含量較少,對低蛋白血癥和凝血異常的改善有限。因此在人工肝治療期間,應重視DPMAS序貫PE有清蛋白丟失及PT延長的不良反應,選擇能有效分離血漿清蛋白的選擇性血漿分離器,并及時給予對癥治療有助于減少血漿清蛋白丟失和PT延長的不良反應。另外,實踐中發現采用DPMAS序貫PE方法,只需一臺人工肝機即可完成全部治療操作,節約了血液管路耗材,不僅為患者節約了治療費用,而且減少了更換血路所帶來的醫療風險和并發癥,更有助于提高患者的臨床療效和保障醫療安全。
本研究標明,DPMAS序貫PE不僅可以有效降低血清膽紅素水平,清除肝衰竭毒素,改善肝功能,還具有減少血漿用量,減少人工肝治療次數和縮短住院時間的臨床優勢,是治療乙型肝炎病毒相關慢加急性肝衰竭一種行之有效的治療手段。

