馬兜鈴酸體內(nèi)代謝及致毒過程研究進展*
馬虹瑩,吳敬敬,葛廣波,楊 凌**
(1.上海中醫(yī)藥大學(xué)交叉科學(xué)研究院 上海 201203;2.大連醫(yī)科大學(xué)藥學(xué)院 大連 116044)
馬兜鈴科中藥材包括馬兜鈴屬、細辛屬、馬蹄香屬廣泛應(yīng)用于中成藥制劑。但其馬兜鈴酸(Aristolochic acids,AAs)成分卻有多重潛在毒副作用。長期食用或服用含AAs的食物、中藥易使腎間質(zhì)纖維化,引起急、慢性腎小管間質(zhì)病變,造成不可逆腎損傷[1]。作為導(dǎo)致急性/慢性腎衰竭的原因之一,AAs被認為是巴爾干地區(qū)腎病的罪魁禍?zhǔn)譡2,3]。現(xiàn)由AAs引起的腎間質(zhì)性腎病和上皮惡性腫瘤統(tǒng)稱為馬兜鈴酸腎病(aristolochic acid nephropathy,ANN),滿足以下標(biāo)準(zhǔn)中的兩條以上均屬AAN患者:①腎臟組織學(xué)顯示間質(zhì)纖維化與皮質(zhì)激素梯度;②有AAs的草藥產(chǎn)品的消費史;③有AADNA加和物的存在(或具體p53基因的A:T→T:A的突變)[4]。此外,研究發(fā)現(xiàn)AAs可在無腎損傷的情況下誘導(dǎo)腫瘤生成,說明AAs的腎損傷和致癌作用是分離的。人腎小管上皮細胞AAs積累可通過促進線粒體的通透性轉(zhuǎn)變直接引發(fā)腎損傷。AAs代謝中間產(chǎn)物馬兜鈴內(nèi)酰胺氮離子能與DNA堿基環(huán)外氨基親電結(jié)合,促使基因突變,從而誘發(fā)腫瘤[5]。由此發(fā)現(xiàn)AAs的致毒過程并非單一。
1 馬兜鈴酸I致毒過程概述
“馬兜鈴酸腎病”(AAN)是用來將包括任何形式的,由于攝入AAs而引起的間質(zhì)性腎病。雖然大多數(shù)國家都禁止含有AAs的產(chǎn)品,但AAs在世界各地的傳統(tǒng)草藥治療中仍然存在。其主要毒性成分馬兜鈴酸I(Aristolochic acid I,AAI)可直接損傷腎小管上皮細胞,尤其近端腎小管上皮細胞,導(dǎo)致細胞壞死或凋亡。其活性代謝產(chǎn)物會形成AAI-DNA加合物,這種脫氧核糖加和物會引起患者體內(nèi)腫瘤抑制基因p53的突變[6],導(dǎo)致AAN和上尿路上皮癌消化道中的結(jié)腸腺癌和肝細胞癌。
1.1 馬兜鈴酸I依賴性腎損傷
AAI對腎小管上皮細胞的損傷,主要呈現(xiàn)淋巴細胞的浸潤,大量間質(zhì)細胞纖維化,腎小管萎縮,病變特征由表面皮層向深層進展。其中近端腎小管上皮細胞(Proximal tubule epithelial cells,PTEC)為AAI的主要靶細胞。但不同劑量AAI損傷腎小管、導(dǎo)致間質(zhì)纖維化的機制并不相同:大劑量AAI在人腎小管上皮細胞中可以通過激活線粒體的滲透性直接引起急性腎小管上皮細胞壞死;長期小劑量攝入AAI(累積劑量大)則通過刺激人腎小管上皮細胞分泌(轉(zhuǎn)化生長因子β,TGF-β)[10],促進腎小管上皮細胞向肌成纖維細胞的分化,導(dǎo)致腎小管損傷和腎間質(zhì)纖維化。此外,實驗證實有機陰離子轉(zhuǎn)運蛋白(Organic anion transporters,OATs)對AAI在PTE的積累至關(guān)重要,在AAN小鼠模型中丙磺舒(一種促進尿酸排泄藥物可以抑制OATs)的參與,可限制AAI的累積,預(yù)防急性腎小管壞死[11]。
1.2 馬兜鈴酸I介導(dǎo)的致癌過程
AAI作為為基因毒性的致癌物,其作用與生成DNA加合物發(fā)腫瘤相關(guān)基因的突變和活化有關(guān)。研究發(fā)現(xiàn)經(jīng)AAI誘導(dǎo)的大鼠和小鼠體內(nèi)的DNA加和物以dA-AAI為主,它會引起AT→TA特征型突變。這類基因突變高頻率發(fā)生于經(jīng)AA誘導(dǎo)的大鼠腫瘤組織的61位密碼子的腺嘌呤基因上,是嚙齒動物的AAI致癌過程中的關(guān)鍵病變。同樣,AT→TA的基因突變發(fā)生于AAN患者的腫瘤抑制基因P53(Tumor suppressor gene p53,TP53)和在無限增殖Hupki(人類TP53敲入)成纖維細胞中[12]。在AAN患者的腎小管上皮細胞中可以通過定量AAI-DNA加和物來反應(yīng)AAI的暴露量。上述DNA加和物(圖1),尤其是dA-AAI已分別在馬兜鈴酸腎病和巴爾干地方性腎病患者泌尿道上皮組織中檢測到[7,8]。目前AAI-DNA加合物已成為檢測AAN的標(biāo)志物[5,9]。在臺灣等馬兜鈴植物應(yīng)用較廣的地區(qū),發(fā)現(xiàn)AA的暴露量與臺灣泌尿上皮癌的發(fā)生率呈正相關(guān)[13]。
通過微陣列研究發(fā)現(xiàn)[14],在人尿路上皮細胞癌中除TP53外,原癌基因MYC也會受到AAI暴露量的影響,可能與AAN相關(guān)的泌尿上皮腫瘤的發(fā)生發(fā)展過程相關(guān)。然而,這些基因尚未在AAN臨床樣本中發(fā)現(xiàn),仍需進一步研究探索。
2 馬兜鈴酸I的體內(nèi)代謝處置過程
AAI進入人體后,將經(jīng)歷代謝外排和活化產(chǎn)毒兩種生物轉(zhuǎn)化路徑。因此了解AAI在體內(nèi)的具體代謝轉(zhuǎn)化路徑,將為AAN的治療起到重要的作用[14]。具有基因毒性的AAI-DNA加和物的結(jié)構(gòu)形成需要一個帶有非定域正電荷的還原性環(huán)氮鎓離子。因此,AAI的硝化反應(yīng)是AAI誘導(dǎo)毒性的關(guān)鍵步驟。體外研究發(fā)現(xiàn),在人和大鼠的肝臟或者腎細胞漿亞細胞組分中,有以下幾種酶會對AAI的活化造成影響,首先是醌氧化還原酶醌氧化還原酶((NAD(P)H:quinone oxidoreductase 1,NQO1),其次是肝微粒體中細胞色素P450酶1A1/2[15]和腎微粒體中的CYP還原酶細胞色素P450氧化還原酶(CytochromeP450oxidoreductase,POR))16]。此外,高表達于泌尿組織的環(huán)加氧酶(Cyclooxygenase,COX)也對AAI具有生物活化效果。
2.1 胞質(zhì)酶的活化:醌氧化還原酶(NQOI)
肝或腎細胞質(zhì)中的NQOI會催化AAI產(chǎn)生還原性環(huán)氮鎓離子而形成AAI-DNA加合物。AAI也通過誘導(dǎo)NQOI腎活性加快自身代謝,進而增加體內(nèi)的基因毒性[17]。雙香豆素,一種NQO1抑制劑[18],在體外實驗中會使NQO1催化生成的AAI-DNA加和物減少近99%,證實了NQO1對AAI-DNA加和物形成的重要性。此外,利用大鼠印記實驗研究NQO1的組織分布發(fā)現(xiàn),在肝和腎中NQO1的表達量會因AAI和AAII的誘導(dǎo)而上升,但在肺中并無此現(xiàn)象[19,20]。
2.2 微粒體酶對AAI的生物轉(zhuǎn)化
由于在實驗動物尿液和糞便排出物中均檢測到了AAIa,且形成的DNA加和物中并沒有AAIa的存在,且AAIa給藥小鼠體內(nèi)觀察不到腎皮質(zhì)的顯著組織學(xué)變化,DNA加和物的生成量低于AAI給藥小鼠的兩個數(shù)量級。由此AAI在經(jīng)CYP1A1/2去甲基化生成AAIa的過程被認為是AAI的解毒過程[21]。
同時微粒體酶CYP1A1/2和細胞色素P450氧化還原酶(CytochromeP450oxidoreductase,POR)可通過簡單的硝基還原活化AAI[22]。體外重組人源酶和相關(guān)分析中發(fā)現(xiàn),α-硫辛酸(POR抑制劑),并不會降低人肝微粒體中AAI-DNA加和物的生成[23]。相反,CYP1A1/2和CYP1A2抑制劑α-萘黃酮和呋拉茶堿對AAI-DNA加和物生成的過程有顯著抑制效果[24,25]。說明在人肝微粒體中,AAI主要通過CYP1A1/2進行還原,POR起作用較小[22]。在人肝臟中,由于CYP1A1表達水平相對較低,因此對AAI的活化作用要比CYP1A2小。然而,人腎臟中CYP1A1對AAI的活化具有重要作用,一方面由于該酶在腎臟中表達,另一方面,AAI對該酶具有誘導(dǎo)效果[25]。
此外,人腎臟中CYP3A5酶也能夠活化AAI,但其活化能力要低于CYP1A1和1A2[26]。人腎臟微粒體中前列腺素H合成酶、環(huán)加氧酶(Cyclooxygenase,COX)也能催化AAI-DNA加合物的形成,且COX活化AA的效率與COX-1有關(guān)。采用動力學(xué)方法研究NQO1和CYP1A1/1A2對AAI的活化能力強弱,發(fā)現(xiàn)NQO1與AAI有更好的親和力,經(jīng)NQO1催化生成AAI-DNA加和物產(chǎn)量最高時 AAI的濃度 K0.5為 17 μM[27]。與CYP1A1/2,POR和COX-1酶相比,AAI可很好的結(jié)合于的活性位點,催化形成AAI-DNA加合物所需AAI濃度最小;以催化AAI-DNA加合物形成時的NADPH表達水平作為參考,胞質(zhì)中NADPH表達水平比微粒體中高兩倍(表1)。以上結(jié)論說明,NQO1在體內(nèi)催化AAI致毒中占據(jù)著關(guān)鍵地位。
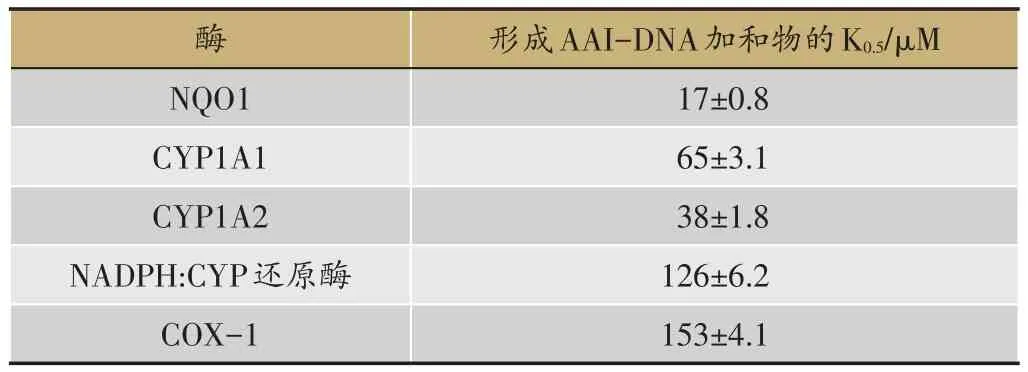
表1 NQO1,CYP1A1/2,NADPH:CYP還原酶和COX-1對AA1活化過程的貢獻[27]
2.3 馬兜鈴酸的代謝激活路徑
活化產(chǎn)毒過程中,AAI具有致突變性和致癌性。AAI在體內(nèi)首先被可被細胞質(zhì)中的NQO1和/或CYP1A1/2將硝基還原為氨基后,通過分子內(nèi)環(huán)化脫水生成有毒的內(nèi)酰胺代謝產(chǎn)物(N-hydroxyaristolactam I,N-OHALI),該物質(zhì)可進一步轉(zhuǎn)化為具有親電子性的帶有移位正電荷的ALI正氮離子(aristolactam I ion)[28]。該化合物為同分異構(gòu)體可在C7位置與DNA發(fā)生共價結(jié)合生成AAI-DNA加合物,分別為dA-AAI和dG-AAI(圖1)[29,30]。這類脫氧核糖加和物具有器官特異性,以腎組織最多,可在動物和人體內(nèi)蓄積,并在他們的整個生存期中持續(xù)存在。這種DNA加合物,可促進基因腺嘌呤(A)與胸腺嘧啶(T)的突變轉(zhuǎn)換,即AT→TA,使腫瘤抑制基因P53突變失去正常功能,從而使細胞增殖增強、分化異常,最終導(dǎo)致腫瘤的發(fā)生[31]。有研究認為AA代謝活化形成DNA加和物的過程并不是AA誘導(dǎo)惡性損傷的唯一方式,它所引起的DNA損傷會導(dǎo)致蛋白質(zhì)轉(zhuǎn)錄水平的細胞特異性轉(zhuǎn)變,這也會造成相應(yīng)的生理損傷[32-35]。

圖1 馬兜鈴酸I(AAI)的活化與解毒途徑
在嚙齒動物尿液和糞便中發(fā)現(xiàn)大部分的AAI代謝物多以(葡萄糖醛酸、醋酸鹽和硫酸酯類)軛合物形式存在。在腎臟灌注大鼠模型中發(fā)現(xiàn),AAI在腎臟組織中可代謝為AAIa,AAIa-硫酸鹽結(jié)合物,ALIa,ALI和ALIa O-葡萄糖醛酸結(jié)合物。其中AAIa是經(jīng)CYP1A催化氧化脫甲基后,再經(jīng)尿苷二磷酸葡萄糖醛酸基轉(zhuǎn)移酶(UGT)或/和磷酸轉(zhuǎn)移酶(SULT)催化以游離或結(jié)合物的形式被排出體外。而ALIa可通過兩種代謝途徑生成,一種途徑是ALI去甲基,另一種途徑是將AAI的脫甲基化到AAIa后還原為ALIa。實驗證實經(jīng)ALI給藥的Wistar大鼠體內(nèi),DNA加和物的產(chǎn)量會降低近50倍,說明不但ALI的代謝產(chǎn)物ALIa無毒,其自身也是無毒產(chǎn)物產(chǎn)物[5]。
3 轉(zhuǎn)運體在馬兜鈴酸腎毒性中的作用
除了代謝酶作用,AAN中AAI毒性選擇性的表現(xiàn)在近端腎小管上皮細胞(proximal tubular epithelial cells,PTEC),提示存在某種特定的分子機制,可導(dǎo)致毒素的積聚于這些細胞。現(xiàn)研究發(fā)現(xiàn)有機陰離子轉(zhuǎn)運家族(Organic anion transporter,OATs)在AAI致毒過程中發(fā)揮了重要作用[14]。OATs分布廣泛、具有多種選擇性,可以運輸多種有機陰離子。在人類腎臟中,OAT1、OAT2和OAT3均位于腎上皮細胞基底外側(cè)膜,介導(dǎo)從血液到細胞質(zhì)的物質(zhì)運輸。其中OAT1和OAT3主要表達與腎臟,而OAT2主要表達與肝,少量表達與腎。表達與腎臟的OAT4分布于腎近端腎小管上皮細胞(Proximal Tubular Epithelial,PTEC)的細胞膜中,作為一種不對稱的有機陰離子交換器,在陰離子吸收過程中發(fā)揮作用,可同時排泄多種陰離子藥物和外源化合物。
而AA的陰離子性質(zhì)恰好易與該蛋白結(jié)合,實驗發(fā)現(xiàn)Hek293細胞人OAT1,3和4的表達,會造成AAI的累積,而在羧苯磺丙胺(OATs典型抑制劑)的作用下AAI的積累量會降低[14],實驗已證實:AA給藥老鼠,經(jīng)羧苯磺丙胺治療后,會顯著減少AAI-DNA加和物的形成減少腎小管壞死,淋巴細胞浸潤,管狀萎縮和纖維化。此外,AAI是人和小鼠OAT1和OAT3的高傾合性底物,與人OAT4的結(jié)合能力較弱。推測AAI在PTEC中通過OAT1和OAT3的流入比通過OAT4流出要多,也就解釋了在PTEC中有毒的AAI積累。雖然,OATs對AAN發(fā)病機制的潛在影響目前還不清楚。但可考慮將抑制OATs作為AAN的潛在安全治療途徑。
為了進一步研究器官-器官間的交互作用,Chang[36]等人利用微流控器官芯片,研究肝代謝是否會改變AAI誘導(dǎo)的腎毒性。細胞毒性實驗證明,與直接注入AAI于腎器官芯片相較,經(jīng)肝器官芯片代謝后的AAI會造成更嚴(yán)峻的腎細胞死亡。說明經(jīng)肝代謝后AAI造成的腎損傷會顯著增強,即肝臟代謝AAI所引起的整體效果是生物激活而非解毒。當(dāng)用NQO1的抑制劑雙香豆素(10 μM)共培養(yǎng)肝細胞后,會降低由AAI誘導(dǎo)的肝損傷近39%[36],但將雙香豆素直接浸泡于腎器官芯片,對AAI的毒性并無明顯效果,得出NQO1在腎臟中直接激活A(yù)A-I產(chǎn)毒屬次要作用,說明人肝細胞內(nèi)NQO1通過形成N-OH-ALI對AAI的腎毒性非常 重要。
相比而言,硫酸鹽共軛ALI代謝物(N-OSO3-ALI)對人體腎臟細胞有直接的毒性,這一作用并不會由肝臟代謝改變。經(jīng)微流控器官芯片構(gòu)建的生物系統(tǒng)中研究發(fā)現(xiàn)AAI的硫酸鹽共軛ALI的代謝物(N-OH-ALI)是經(jīng)肝臟轉(zhuǎn)移到腎臟的有毒物質(zhì)。其中,N-OH-ALI無毒性,而N-OH-ALI經(jīng)SULTs形成結(jié)合性代謝產(chǎn)物NOH-ALI為AAI的腎毒性代謝產(chǎn)物。人類SULT1A1和SULT1B1對于激活A(yù)A-I和N-OH-ALI[37,38]至關(guān)重要。且N-OH-ALI,是一種不穩(wěn)定的化合物,在水介質(zhì)中有大約40分鐘的半衰期,很容易形成DNA加和物。OATs的抑制劑羧苯磺丙胺可減弱N-OSO3-ALI的腎毒性,是因為N-OSO3-ALI為水溶性不能直接擴散通過細胞膜,必須通過膜運輸才可引發(fā)腎毒性。動物和體外實驗均證實有機陰離子轉(zhuǎn)運蛋白(OATs)參與AAI器官選擇毒性和腎消除。此外,N-OSO3-ALI可由肝膜轉(zhuǎn)運蛋白MRP3(Multidrug resistance proteins 3)和MRP4(Multidrug resistance proteins 4),從肝臟的肝細胞轉(zhuǎn)移到血液中。基于器官芯片的研究可以得出肝臟代謝酶從整體上增加了AAI的腎臟毒性。人肝NQO1和SULT協(xié)同代謝AAI形成高腎毒性產(chǎn)物N-OSO3-ALI,然后通過MPRs轉(zhuǎn)運體轉(zhuǎn)運出肝臟進入血液,后通過OATs重吸收進入腎臟造成腎損傷(圖2)。

圖2 轉(zhuǎn)運蛋白在AAI致毒過程中的作用
4 馬兜鈴酸腎病的易感機制
AAI腎毒性不僅是中草藥使用面臨的問題,也是巴爾干地方性腎病(Balkan endemic nephropathy,BEN)的重要致病因素之一。其中的A:T→T:A TP53基因基因突變?yōu)轳R兜鈴酸的特征型突變[39]。遺傳背景及個體病理生理狀況在AA腎毒性易感機制中具有重要作用。因此了解馬兜鈴酸腎病發(fā)生和易感機制,對于預(yù)防和干預(yù)AAN具有重要意義。
4.1 AAI生物轉(zhuǎn)化代謝酶的遺傳多態(tài)性
據(jù)研究,臺灣有超過一半以上的上泌尿道癌(upper urinary track carcinomas,UTUC)病人腎皮質(zhì)中均有馬兜鈴酸DNA加和物的存在,進一步證實馬兜鈴酸DNA加和物可作為馬兜鈴酸腎病的標(biāo)志物[40]。雖然,TP53是UTUC患者的特異突變類型,可證明AAI會引起UTUC,但AAI相關(guān)的UTUC疾病中只存在將近25%的TP53突變(A:T→T:AT),所以將TP53作為UTUC標(biāo)志物仍具有一定的局限性。研究還發(fā)現(xiàn):AAI致H-ras基因突變作用發(fā)生在5/6腎切除慢性腎衰竭大鼠,而接受AAI的正常大鼠則未發(fā)生。提示遺傳背景及個體病理生理狀況在AAI腎毒性易感機制中具有重要作用。在以上AAI代謝酶中,據(jù)報道人NQO1的基因多態(tài)性對BEN患者至關(guān)重要。NQO1*2(C609T)型NQO1可促進BEN患者上尿路移行細胞惡性腫瘤發(fā)展。并且在BEN高風(fēng)險患者體內(nèi)會發(fā)現(xiàn)CYP3A5*1等位基因G6989[41]。
CYP1A2也有高度遺傳多態(tài)性,編碼基因位于第15號染色體,有7個外顯子和6個內(nèi)含子,由其轉(zhuǎn)錄的mRNA總長31210 bp,至少存在4個功能基團核苷酸多態(tài)性,主要在肝臟中表達,個體間表達變異程度可達40倍。CYP1A2的個體間差異為2.96-73倍。這種基因差異,引起了個體對AA的不同耐受程度。AAN的易感性除了個體差異,在AAI的偏好和氧化的速率上人類/大鼠CYP1A1和1A2還存在明顯的種屬差異。其中人類CYP1A1比人CYP1A2對AAI O-去甲基化更有效。
4.2 個體組織氧含量(CYP1A1/2)
由于CYP1A1/2同時參與AAI的活化產(chǎn)毒和代謝解毒過程,人體組織氧濃度會影響AAI在還原活化和氧化解毒兩條代謝路徑中相對分配比例。利用分子對接,將小分子AAI柔性對接到蛋白質(zhì)大分子CYP1A1和CYP1A2的活性位點發(fā)現(xiàn),在厭氧條件下,CYP1A1和CYP1A2可以連接AAI作為配體;在富氧情況下,AAI應(yīng)為CYP1A1和CYP1A2的經(jīng)典底物,這里需要一分子氧來幫助AAI的甲氧基團去甲基化生成AAIa[42]。說明除CYP1A1和CYP1A2的體內(nèi)分布,組織中的氧含量會影響體內(nèi)CYP代謝酶參與的AAI硝基還原活化和氧化解毒的平衡[43]。此外,小分子AAI相對CYP1A1和CYP1A2催化位點的移動的情況同樣會影響AAI的代謝。
4.3 藥物藥物相互作用
藥物之間的協(xié)同與競爭效應(yīng),及藥物藥物相互作用也會影響AAI的腎毒性。藥物間可通過競爭代謝酶和轉(zhuǎn)運蛋白,增加腎臟對低濃度藥物或毒素損傷的易感性,也是AA可能易感因素之一。
5 小分子熒光探針揭示馬兜鈴酸代謝酶活性的潛在價值
遺傳背景及個體病理生理狀況在AAI腎毒性易感機制中具有重要作用,代謝酶的活性會直接影響AAI在個體內(nèi)的轉(zhuǎn)化路徑和致毒劑量,因此對活體中代謝酶活性的測定會對馬兜鈴酸的臨床使用具有指導(dǎo)性的意義。而受環(huán)境因素、遺傳因素和疾病等影響,大分子蛋白在組織分布和個體表達存在很大差異,均會會影響AAI在人體的代謝行為的差異。因此,我們需要可以靈敏的、特異的反映代謝酶活性的評價手段。目前的免疫組化方法和蛋白質(zhì)組學(xué)技術(shù),不但耗時耗財,更為重要的是,這些方法只能評價代謝酶的蛋白含量,無法評價其 催化活性,而代謝酶的催化活性才與其代謝能力直接相關(guān)。
而小分子探針底物具有選擇性高、靈敏度好、操作簡單等優(yōu)勢,借助于熒光成像技術(shù)研究者能夠?qū)罴毎?活體中各種,如離子、有機小分子、生物大分子等目標(biāo)物進行定位,可從分布、含量、活性等諸多領(lǐng)域原位以及實時觀測。現(xiàn)已有CYP1A小分子熒光探針底物NCMN[44]和UGT1A1熒光探針NCHN[45]等已被證實可測定混合體系中目標(biāo)酶的代謝活性,且擁有良好的檢測靈敏度和選擇性。而這些熒光探針的在精準(zhǔn)醫(yī)療中的推廣和應(yīng)用,可幫助解決對有毒中藥馬兜鈴酸的醫(yī)學(xué)使用誤區(qū),因人而治,從而制定出配伍嚴(yán)謹(jǐn)?shù)姆剿広吚芎Γ_到治療作用。
6 研究展望
馬兜鈴酸雖具有腎毒性和致癌毒性。由于部分含馬兜鈴酸藥物的不可替代性,仍有較多人群因服用AA制劑導(dǎo)致AAN。近年來國內(nèi)外學(xué)者臨床觀察均發(fā)現(xiàn)AAN患者個體間易感性存在顯著差異。隨著實驗技術(shù)手段的提高,已找出參與AAI活化的關(guān)鍵代謝酶NQO1和CYP1A和轉(zhuǎn)運體OATs,但仍有大量未知區(qū)域,如II相代謝酶UGT等在AAI體內(nèi)代謝的具體參與狀況等。近來藥物代謝酶特異性熒光探針的研發(fā)和微流控-器官芯片的發(fā)展,無疑為AAs體內(nèi)代謝過程和作用機制的研究帶來更便捷和有力手段。通過探針底物與酶反應(yīng)后代謝產(chǎn)物熒光值得強弱,直觀反應(yīng)代謝酶的生物活性;器官芯片的成熟,將幫助我們消減種屬差異。以上技術(shù)手段應(yīng)用于馬兜鈴酸致病機制的研究,將幫助我們深入認識馬兜鈴酸體內(nèi)代謝及致毒過程,為馬兜鈴酸的中藥復(fù)方配伍提供建議,為馬兜鈴酸腎病提供新的治療途徑。

