新輔助同步放化療和單純化療在Ⅲ期食管胃結合部腺癌治療中的應用對比觀察
曹銘富,彭濤,王國強,蘇卓彬,張育,高強,畢仁杰,李曙光
(1河北北方學院研究生院,河北張家口075000;2河北北方學院附屬第一醫院;3張家口市第一醫院)
食管胃結合部腺癌(AEG)是指發生于食管遠端與胃近端區域內的腺癌。多數學者認為AEG在生物學行為及預后方面有別于真正意義上的食管癌及胃癌。近年來研究顯示,遠端胃癌的發病率在世界范圍內呈下降趨勢,而AEG發病率逐年上升[1]。研究表明,按Siewert分型,亞洲國家AEG患者Siewert Ⅱ、Ⅲ型發病率明顯高于Ⅰ型[2]。2018年正式啟用的第8版TNM分期中,將Siewert Ⅲ型歸為胃癌分期[3,4]。AEG的治療仍以手術為主,早期AEG患者行標準根治性切除術可達到徹底治愈。由于AEG早期無明顯臨床癥狀,相當一部分AEG患者在就診時已處于進展期,單純手術效果不佳,術后易復發和轉移,5年生存率低[5]。手術能否達到R0切除直接影響患者的預后和生存期[6]。對進展期AEG行輔助放化療有助于提高R0切除率,但目前胃食管腫瘤最常見的化療方案均以氟尿嘧啶和順鉑為基礎,關于紫杉類治療的報道較少。有學者研究認為,紫杉醇用于肺癌、乳腺癌、宮頸癌的化療效果更好,不良反應更小[7]。本研究觀察了新輔助同步放化療(紫杉醇聯合卡鉑單周方案)和單純化療在Ⅲ期AEG治療中的應用效果,探索Ⅲ期AEG的臨床治療優選方案。
1 資料與方法
1.1 臨床資料 選擇河北北方學院附屬第一醫院胃腸腫瘤外科2014年12月~2018年8月收治的AEG患者進入研究。納入標準:①胃鏡活組織檢查確診為AEG腺癌;②根據超聲內鏡及螺旋CT檢查等確定分期為Ⅲ期;③體力評分KPS≥70分;④年齡≤75歲;⑤無化療及手術禁忌證;⑥無其他心肺疾患;⑦簽署知情同意書。排除標準:①拒絕臨床研究的患者;②妊娠或哺乳期婦女;③合并有其他惡性疾病或有惡性疾病史。剔除標準:①自動退出或拒絕治療;②發生化療藥物嚴重過敏反應者;③治療過程中出現了急性不可控的情況,不能繼續治療的患者;④治療期間發現腫瘤明顯進展的患者。共納入60例患者,男41例、女19例,年齡(60.6±7.1)歲,BMI (22.7±3.9)kg/m2。采用隨機數字表法分為觀察組和對照組,每組30例。本研究經醫院倫理委員會審批通過,治療方式的選擇已告知患者及家屬,簽署知情同意書。觀察組1例因在化療7周后出現病灶處穿孔行急診手術而剔除本研究。兩組患者的年齡分布、性別構成、BMI、KPS、臨床分期、分化程度及病理類型等臨床資料差異均無統計學意義。
1.2 治療方法 觀察組術前進行新輔助同步放化療,化療方案為紫杉醇聯合卡鉑單周方案:紫杉醇80 mg/m2,卡鉑1.5 mg/(mL·min),每周1次,共9周。同時常規在每次化療前使用地塞米松、苯海拉明、雷尼替丁及標準止吐劑。在第2周開始同步放療:直線加速器6 MV X射線,CT定位,三維適形調強放療,放療劑量為40 Gy/20 F/4周。新輔助同步放化療療程結束后休息4~6周行賁門癌根治術(D2)。治療前所有進流質飲食困難者均行鼻腸管腸內營養,待可進半流質飲食時拔除鼻腸管。術后根據體表面積單藥口服替吉奧輔助化療[8]。對照組未行輔助放療,余治療方法與觀察組一致。
1.3 療效評價及不良反應觀察 ①手術情況:計算R0切除率、術后病理淋巴結陽性率、手術病死率及手術相關并發癥發生率(出血、吻合口漏、吻合口狹窄、腹腔及胸腔感染、腸梗阻等);②新輔助治療的不良反應:包括血液學不良反應和非血液不良反應;③依據美國國家癌癥研究所實體瘤療效評價標準[9]評價新輔助治療療效,分為完全緩解(CR)、部分緩解(PR)、穩定(SD)和進展(PD),計算有效率(RR,CR+PR/總例數)和疾病控制率(DCR,CR+PR+SD/總例數);④新輔助治療后降期情況:新輔助治療后采用第8版胃癌ypTNM分期標準,觀察治療前后患者具體T分期、N分期變化情況,計算降期率;⑤觀察新輔助治療過程中患者進食狀態的變化。
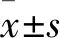
2 結果
2.1 兩組治療效果比較
2.1.1 手術情況 觀察組23例行全胃切除、6例行近端胃大部分切除,對照組分別為20、10例。觀察組清掃淋巴結數目為(20.1±3.2)個,淋巴結陽性數為(4.17±2.04)個,對照組分別為(21.2±3.9)、(5.10±2.55)個。觀察組、對照組R0切除率分別為93.10%(27/29)、73.33%(22/30)。觀察組淋巴結陽性數少于對照組,R0切除率高于對照組(P均<0.05)。兩組手術方式和淋巴結清掃數目差異無統計學意義。
2.1.2 病理學降期情況 新輔助治療后觀察組分期Ⅰ期7例(24.13%)、Ⅱ期19例(65.52%)、Ⅲ期3例(10.35%),對照組Ⅰ期2例(6.67%)、Ⅱ期18例(60.00%)、Ⅲ期10例(33.33%)。觀察組降期率(89.7%,26/29)高于對照組(66.7%,20/30),P<0.05。
2.1.3 新輔助治療療效評價 觀察組CR 5例(17.2%)、PR 21例(72.4%)、SD 3例(10.3%)、PD 0例,RR為89.6%,DCR為100%;對照組CR 2例(6.7%)、PR 18例(60.0%)、SD 10例(33.3%)、PD 0例,RR為66.7%,DCR為100%。觀察組RR高于與對照組(P<0.05)。
2.1.4 治療過程中進食狀態變化 觀察組、對照組治療3周后各有2例患者可正常飲食;治療6周后分別為12、8例;治療9周后分別為25、18例;治療12周后觀察組27例可正常進食、2例進半流質飲食,對照組26例可正常進食、4例可半流質飲食。兩組均未發生流質飲食困難癥。詳見表1。
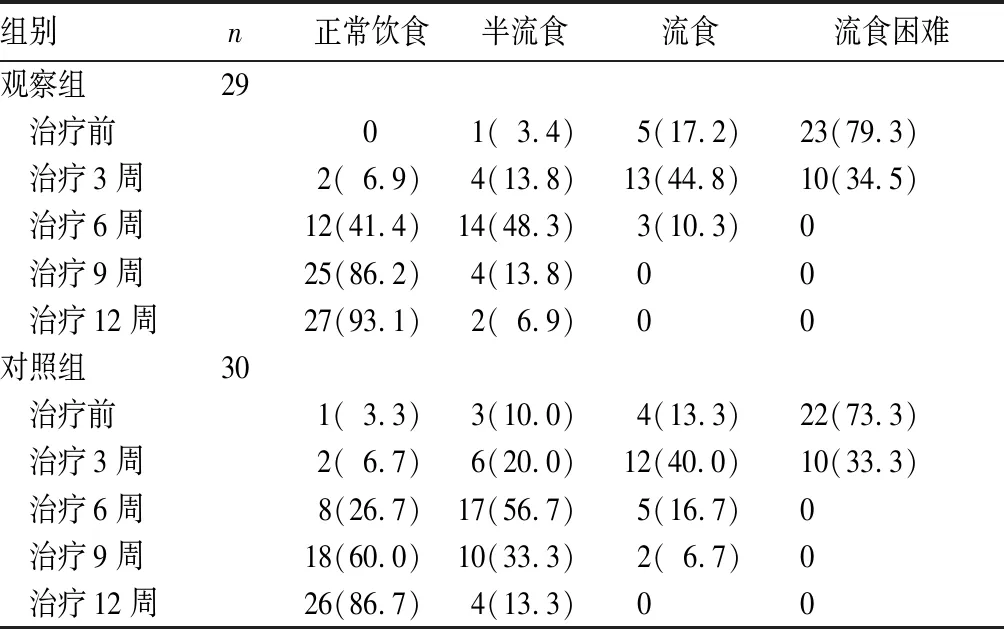
表1 觀察組與對照組治療過程中進食狀態變化情況[例(%)]
2.2 兩組不良反應發生情況比較 觀察組主要不良反應為白細胞減少20例(69.0%)、血紅蛋白減少10例(34.5%)、血小板減少6例(20.7%)、肝功能異常8例(27.6%)、食欲減退10例(34.5%)、黏膜炎5例(17.2%)、惡心5例(17.2%)、嘔吐4例(13.8%)、脫發29例(100%),其中3~4級白細胞降低發生率為13.7%、脫發44.8%。對照組白細胞減少22例(73.3%)、血紅蛋白減少9例(30.0%)、血小板減少8例(26.7%)、肝功能異常10例(33.3%)、食欲減退7例(23.3%)、黏膜炎2例(6.7%)、惡心3例(10.0%)、嘔吐4例(13.8%)、脫發30例(100%),其中3~4級白細胞降低發生率為20.0%、脫發40.0%。所有患者不良反應經對癥處理后癥狀均緩解或消失,兩組不良反應發生情況差異無統計學意義。
3 討論
隨著人們就診意識及檢查手段的進步,AEG的早期診斷率較前有所提高,但進展期惡化患者占比仍超過90%[10~12]。臨床上針對進展期賁門癌的治療方法主要為根治性手術切除輔以術后化療,但患者預后不理想。手術能否達到R0切除直接影響患者預后,腫瘤原發病灶的部位、腫瘤浸潤情況及淋巴結轉移數亦為影響預后的重要因素。因此,如何提高AEG手術R0切除率已成為當前臨床工作者的研究熱點。
臨床研究證實,單純化療對進展期AEG患者效果欠佳,因無法有效控制腫瘤細胞轉移,對患者的遠期生存幫助有限。新輔助化療聯合同步放療能有效提高腫瘤患者手術R0切除率,改善預后。其理論基礎[13]為:①新輔助化療可使腫瘤降期,提高手術切除率,降低圍手術期腫瘤微病灶的活性,進而減少腫瘤細胞轉移、種植,同時還可觀察腫瘤細胞對化療藥的敏感性。②新輔助放療對胃食管結合部腺體組織有一定敏感性,放療可有效殺死和抑制腫瘤細胞,減少腫瘤負荷及亞臨床病灶轉移;放療可破壞腫瘤周圍血管及神經,使其纖維化,減少疼痛及術中出血,提高腫瘤可切除率;放化療聯合還可提高放療敏感性,發揮協同殺滅腫瘤細胞的作用。因此,新輔助治療已經成為中晚期AEG患者綜合治療中的重要部分。目前,臨床報道較多的AEG新輔助化療方案以氟尿嘧啶和順鉑為基礎藥物,以紫杉類為基礎藥物的新輔助化療方案報道少見。荷蘭的一項研究[14]結果顯示,AEG患者術前行新輔助化療(紫杉醇+卡鉑)聯合同步放療后,中位生存時間為43.2個月,比單純手術組(27.1個月)明顯延長,肯定了術前新輔助同步放化療給AEG患者遠期生存帶來的獲益和安全性。該項研究中,AEG患者僅占入組患者的24%,且兼有Ⅰ、Ⅱ、Ⅲ期AEG患者。與上述研究相比,本研究對入組對象的選擇更加嚴格,僅納入Ⅲ期AEG患者,研究結果將更加可靠。
AEG患者術前新輔助放療的療效和安全性均已得到研究證實,但各項研究中具體的放療介入時間及劑量存在一定差異,仍未形成規范化的放療方案。Stahl等[15]收治了119例AEG患者,發現新輔助單純化療組與新輔助同步放化療組的R0切除率都為70%,但新輔助同步放化療組在病理學完全緩解率(16%、2%)和淋巴結轉移率(37%、64%)方面較新輔助單純化療組更具優勢,這將直接影響患者的遠期生存率。本研究中,觀察組R0切除率和降期率均高于對照組,淋巴結陽性轉移數少于對照組,進食梗阻癥狀緩解時間短于對照組,上述結果均充分體現新輔助同步放化療方案在AEG綜合治療中的重要作用。
多項研究已證實紫杉醇聯合鉑類藥物的化療方案治療多種腫瘤具有耐受性好、嚴重不良反應發生率低的優點,較氟尿嘧啶類為基礎的化療方案可以更好地延長生存期[16~18]。大多數化療藥物都會抑制白細胞再生,因此,化療過程中應按需給予集落刺激因子對癥處理。另外,每次用藥前常規給予地塞米松、苯海拉明、雷尼替丁及標準止吐劑、抑酸劑等輔助用藥有助于預防紫杉醇化療引起的過敏、病灶處穿孔及胃腸道反應,臨床效果較好。本研究觀察組中有1例在新輔助治療7周后出現病灶處穿孔,行急診手術并從觀察組中退出。分析原因可能是產生放化療協同效應,對病灶局部腫瘤細胞殺傷速度較快,病灶處組織黏膜未能及時修復,加上胃酸的腐蝕作用,引起穿孔。穿孔除引起腹膜炎外,還可導致腫瘤細胞向腹腔擴散種植,影響遠期療效[19]。因此,為了避免新輔助治療引起穿孔,治療同時可給予抑酸及促進胃黏膜修復治療。
綜上所述,新輔助同步放化療(紫杉醇聯合卡鉑單周方案)治療Ⅲ期AEG R0切除率和治療有效率均高于單純新輔助化療,治療后腫瘤降期更明顯,且不增加不良反應發生率。新輔助同步放化療方案更值得臨床推廣。

