整合素連接激酶在缺氧晶狀體上皮細胞中的表達變化及其對細胞上皮-間充質轉化的影響
朱艷,朱玉廣,曹智,滕興波,孫海霞,劉憲金,楊偉舟
(濰坊醫學院附屬醫院,山東濰坊261053)
后囊膜混濁(PCO)是現代白內障手術后常見的并發癥之一,影響患者視功能恢復,可造成嚴重的視力損害[1]。白內障手術后殘存的晶狀體上皮細胞(HLECs)發生上皮-間充質轉化(EMT)是PCO形成的病理基礎[2]。整合素連接激酶(ILK)是一種絲氨酸/蘇氨酸細胞內蛋白激酶,ILK參與整合素、缺氧誘導因子1(HIF-1)等多條細胞內外信號轉導通路,ILK活化后可調節細胞凋亡、黏附、增殖、分化及血管生成等多種生物學過程[3~5]。另外,ILK也是一種低氧反應因子,在細胞缺氧時表達增高[6,7]。本課題組前期研究發現,ILK參與TGF-β2誘導的HLECs EMT[8]。最近研究表明,缺氧可誘導HLECs發生EMT[9]。然而,對于缺氧條件下ILK是否參與HLECs的EMT目前尚不清楚。2018年1~6月,本研究建立HLECs缺氧模型,觀察ILK在缺氧HLECs中的表達變化及其對細胞EMT的影響,從新的視角探索HLECs EMT早期發生機制,尋找早期干預EMT的有效方法。
1 材料與方法
1.1 細胞與主要實驗材料 人永生化晶狀體上皮細胞HLEC-B3(美國ATCC公司),兔抗人ILK單克隆抗體、兔抗人α-平滑肌肌動蛋白(α-SMA)單克隆抗體(美國Sigma公司),兔抗人纖維連接蛋白(FN)單克隆抗體(美國Santa Cruz公司),羊抗兔IgG(美國Abcam公司),DMEM細胞培養液、胎牛血清(美國GIBCO公司),CoCl2(美國Sigma公司),TRIzol試劑(美國Invitrogen公司),ILK抑制劑QLT0267(加拿大QLT公司),PCR引物(上海生工公司)。
1.2 HLECs缺氧模型構建及ILK檢測 取液氮保存的HLEC-B3細胞系,在37 ℃水浴箱中快速解凍,細胞懸液轉移到離心管,滴加DMEM培養液,吹打混勻后離心,棄上清液,加入含雙抗抗生素的DMEM培養液(20%胎牛血清),吹打混勻,在37 ℃、5% CO2培養箱中單層貼壁培養。每3~4 d換DMEM培養液1次,胰蛋白酶消化傳代。取處于對數生長期的HLECs,胰蛋白酶消化,以10×106/L接種于96孔板,每孔100 μL,繼續培養24 h后去培養液,分別加入0、25、50、100、200、400 μmol/L的CoCl2,每個CoCl2濃度設置3個復孔。在37 ℃、5% CO2培養箱中孵育24 h后,采用CCK-8法測算細胞存活率,最終選擇100 μmol/L的CoCl2進入下一步實驗。在HLECs培養瓶中加入含100 μmol/L CoCl2的DMEM培養液分別培養0、6、12、24、48 h后收集細胞,細胞裂解法提取總蛋白,BCA法測定樣本蛋白濃度并配平,取變性蛋白20 g/孔加入凝膠加樣孔進行電泳,轉PVDF膜,脫脂奶粉封閉;TBST 37 ℃封閉1 h,加入相應一抗(兔抗人ILK單克隆抗體,1∶500)4 ℃孵育過夜;次日TBST洗膜,加二抗IgG(1∶1 000)室溫孵育2 h;TBST洗膜,按照ECL試劑盒說明操作,室溫下曝光、顯影并定影;采用UVP凝膠成像系統分析目的蛋白條帶灰度值,以β-actin為內參,以目的蛋白條帶灰度值與β-actin條帶灰度值的比值表示目的蛋白相對表達量。
1.3 ILK表達變化對缺氧HLECs中EMT相關蛋白表達的影響觀察
1.3.1 HLECs分組及處理 將HLECs分為CoCl2組、ILK抑制劑組、對照組。CoCl2組加入含100 μmol/L CoCl2的培養基;ILK抑制劑組用ILK特異性抑制劑QLT0267(10 nmol/L)預處理1 h后,再加入含100 μmol/L CoCl2的培養基;對照組加入無血清培養基。三組繼續培養24 h后,進行后續實驗。
1.3.2 α-SMA、FN蛋白檢測 采用Western blotting法檢測三組細胞中的α-SMA、FN蛋白。具體方法參考“1.2”。
1.3.3 α-SMA、FN mRNA檢測 收集三組細胞,TRIzol提取細胞總RNA,紫外分光光度計檢測RNA純度。將RNA逆轉錄成cDNA,進行熒光定量PCR反應,以人β-actin基因作為內參。α-SMA基因上游引物序列為5′-CTGACAGAGGCACCACTGAA-3′,下游引物序列為5′-CATCTCCAGAGTCCAGCACA-3′。FN基因上游引物序列為5′-GAGAATAAGCTGTACCATCGCAA-3′,下游引物序列為GGGCGAGTAGGAGCAGTTG-3′。人β-actin基因上游引物序列為5′-CTTACAGATCATGTTTGAGACCTTCAA-3′,下游引物序列為5′-CTCAGGGCAGCGGAACC-3′。反應條件為93 ℃ 3 min;93 ℃ 30 s,55 ℃ 45 s,72 ℃ 45 s,共40個循環。測得目的基因和β-actin基因的循環閾值,根據標準曲線換算目的基因與β-actin基因的拷貝數,以二者比值表示目的基因的相對表達量。
2 結果
2.1 不同缺氧時間HLECs中ILK蛋白表達變化 缺氧0、6、12、24、48 h時HLECs中ILK蛋白相對表達量分別為0.382±0.018、0.515±0.023、0.807±0.044、0.951±0.048、0.256±0.019。缺氧6、12、24、48 h時ILK蛋白相對表達量均增高,其中缺氧12、24 h時ILK蛋白相對表達量高于缺氧6、48 h時(P均<0.05)。見圖1。
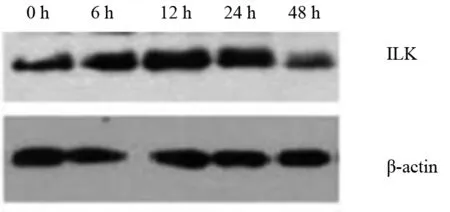
圖1 缺氧不同時間HLECs中ILK蛋白表達情況(Western blotting法)
2.2 各組HLECs中α-SMA、FN蛋白表達比較 CoCl2組、ILK抑制劑組及對照組α-SMA蛋白相對表達量分別為0.671±0.032、0.428±0.025、0.091±0.014;FN蛋白相對表達量分別為1.125±0.133、0.420±0.029、0.136±0.012。CoCl2組細胞中α-SMA、FN蛋白相對表達量高于對照組,ILK抑制劑組細胞中α-SMA、FN蛋白相對表達量低于CoCl2組(P均<0.01)。見圖2。
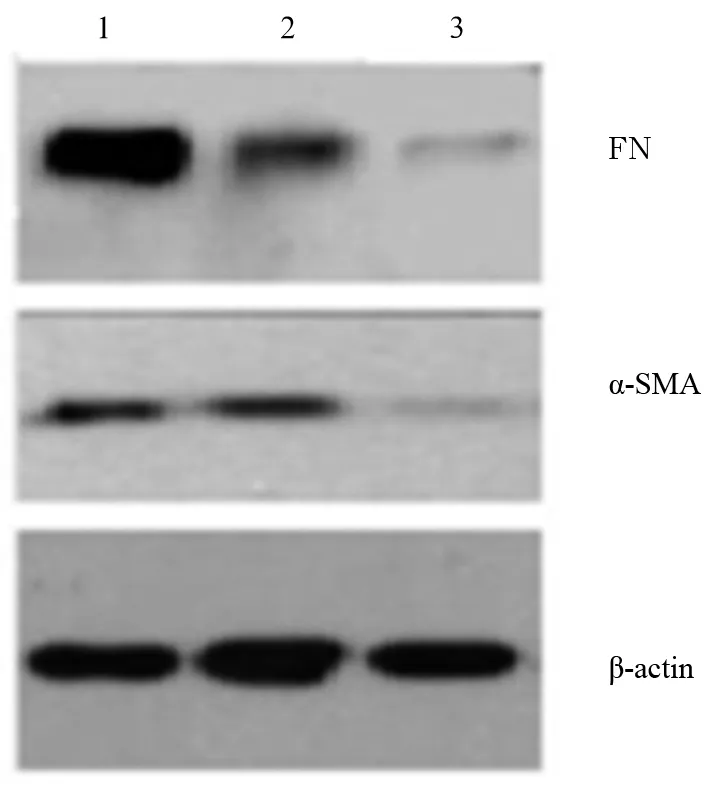
注:1為CoCl2組;2為ILK抑制劑組;3為對照組。
2.3 各組HLECs中α-SMA、FN mRNA表達比較 CoCl2組、ILK抑制劑組及對照組α-SMA mRNA相對表達量分別為1.851±0.038、0.672±0.019、0.053±0.013;FN mRNA相對表達量分別為2.036±0.042、0.892±0.027、0.157±0.016。CoCl2組細胞中α-SMA、FN mRNA相對表達量高于對照組,ILK抑制劑組細胞中α-SMA、FN mRNA相對表達量低于CoCl2組(P均<0.01)。
3 討論
白內障是我國最常見的致盲性眼病,目前治療白內障的手術方案為超聲乳化術聯合后房人工晶體植入[10]。白內障術后PCO影響部分患者視功能的恢復。對于高端人工晶體植入術,PCO是白內障術后視覺干擾的主要因素之一[11,12]。白內障手術過程中保留了晶狀體囊袋,囊內殘存的HLECs增生、分化是手術后PCO發生的主要原因[2],HLECs的EMT是PCO形成的主要病理基礎。
ILK是一種與細胞外基質及細胞信號通道有關的絲氨酸/蘇氨酸細胞內蛋白激酶,與細胞內多種活性蛋白關系密切。ILK參與整合素、HIF-1等多條細胞內外信號轉導通路。ILK活化后對下游的效應蛋白進行磷酸化從而發揮效應,參與細胞的生長、分化、遷移和腫瘤生成等過程[3]。同時,ILK也是一種低氧反應性因子,低氧可誘導ILK表達,激活多條與低氧應激等有關的信號通路,影響細胞多種生物學功能[6]。
不同于人體內的其他細胞,晶狀體及其上皮細胞存在于缺氧環境中[13]。建立HLECs缺氧模型可模擬體內HLECs的微環境[9,14]。CoCl2通過其CO2+替代血紅素的Fe2+與氧進行結合,使干預細胞處在缺氧狀態。在常氧狀態下,CoCl2還可激活細胞內HIF-1α誘導的信號通路,發揮類似缺氧的效應[15]。因而CoCl2常被用于制備細胞缺氧模型。本研究選擇100 μmol/L的CoCl2作用于HLECs,成功制作了HLECs缺氧模型。檢測不同缺氧時間HLECs中的ILK,結果發現,在缺氧6 h時ILK表達明顯升高,隨缺氧時間延長,ILK表達逐漸增強并在缺氧24 h時達到最高,缺氧48 h時ILK表達下降。以上結果說明短時間的缺氧可誘導ILK表達增加,長時間缺氧可造成HLECs的損傷,使ILK表達下降,據此我們選擇缺氧24 h的HLECs進行后續實驗。
為了觀察ILK的表達變化對HLECs EMT的影響,我們選擇ILK特異性抑制劑QLT0267進行進一步的研究[16]。本研究結果顯示,與對照組比較,CoCl2組α-SMA、FN蛋白及其mRNA的表達均明顯增強;與CoCl2組比較,ILK抑制劑組α-SMA、FN蛋白及其mRNA的表達明顯減弱。這提示QLT0267通過特異性抑制ILK,抑制了HLECs中EMT早期標志蛋白的表達,影響了EMT過程,從另一方面證實ILK在缺氧誘導的HLECs EMT中發揮重要作用。同前期研究[8]結果類似,QLT0267也部分抑制了CoCl2誘導的HLECs EMT,但并沒有全部阻斷EMT過程,說明可能有其他通路參與了CoCl2誘導的HLECs EMT過程。我們認為,在HLECs EMT過程中,可能存在復雜的細胞信號調控通路,而ILK及其信號通路可能只是其中的一個關鍵節點。
在很多細胞系或腫瘤細胞中,缺氧可同時誘導ILK和HIF-1α的表達,參與細胞EMT或腫瘤進展。在某些細胞中,ILK可調控HIF-1α的表達[17,18]。而在少數細胞中,HIF-1α可以調控ILK的表達[19]。推測可能存在ILK-HIF-1α調節反饋回路[20],在缺氧期間維持高水平的HIF-1α表達。缺氧不僅可以誘導HLECs中ILK的表達,同樣可以激活HIF-1。對于HLECs中ILK與HIF-1的調控關系尚未見報道,這需要我們進一步深入研究,以闡明HLECs EMT的分子機制,干預HLECs EMT,預防PCO的發生。

