CRY2過表達對肝癌細胞增殖及生物鐘基因、蛋白表達的影響
許靜,孫誠誼,喻超,何曉曉,楊盛力
(1貴州醫科大學,貴陽550000;2貴州醫科大學肝膽胰脾重點實驗室;3華中科技大學同濟醫學院附屬梨園醫院)
生物鐘是參與協調機體各種組織器官晝夜節律的一種內源性調控系統,與人體各項生理活動密切相關[1~3]。生物鐘的基本分子機制主要由一系列核心元件組成的轉錄、翻譯負反饋環構成,包括PER1-3、CRY1-2、CLOCK、BMAL1、TIMELESS、NPAS2、NR1D1、DEC1、DEC2和RORA等。目前研究[4~7]表明,生物鐘調控系統紊亂與多種腫瘤的發生發展密切相關,其機制可能是生物鐘對腫瘤細胞的增殖、侵襲及耐藥等惡性生物學行為有一定影響。CRY2在人骨肉瘤、乳腺癌、大腸癌等多種實體腫瘤中表達上調,且其高表達可促進腫瘤細胞惡性生物學行為[8,9]。本課題組前期研究發現,生物鐘基因在肝細胞癌中的表達具有顯著差異,對肝癌的發生發展具有顯著意義[14,15]。研究[10]發現,生物鐘基因可通過調控下游多種信號通路從而影響細胞周期及相關基因的表達,最終調控腫瘤細胞的生物學功能。2018年5~9月,本研究觀察了過表達CRY2的肝癌細胞系HepG2增殖能力變化,及細胞中多種生物鐘基因和蛋白的表達變化,從而研究CRY2對肝癌細胞生物鐘網絡調控的影響。
1 材料與方法
1.1 主要實驗材料 DMEM培養基、PBS和胎牛血清購自美國Hyclone公司;TRIzol試劑購自美國Invitrogen公司;逆轉錄試劑盒購自美國Fermentas公司;CCK-8檢測試劑盒;PCR引物由武漢谷歌生物科技有限公司提供;鼠抗人CRY1單克隆抗體、兔抗人CRY2多克隆抗體及兔抗人CLOCK多克隆抗體購于Abcam公司;兔抗人β-actin單克隆抗體購于Santa Cruz公司;鼠抗人PER3多克隆抗體購于Novus公司;兔抗人PER1、PER2、BMAL1多克隆抗體購自美國Proteintech公司;肝癌細胞系HepG2來自中國典型物種保藏中心;CRY2過表達病毒上清液及陰性對照病毒上清液的構建和鑒定由上海吉凱基因公司進行。
1.2 HepG2細胞分組及CRY2過表達載體轉染 于培養瓶中培養HepG2細胞,待細胞處于對數生長期,用胰酶消化細胞后均勻接種于編號1~6的6孔板中,每孔各加入2 mL含10%胎牛血清及1%抗生素的DMEM培養液,第1~3孔先加入5 μL的CRY2過表達病毒上清液(實驗組),第4~6孔先加入5 μL陰性對照病毒上清液(對照組),并每孔均加入2 μL聚凝胺(polybrene)促進轉染。于5% CO2、37 ℃培養箱中培養24 h后更換含10%胎牛血清及1%抗生素的DMEM培養液,每48 h更換1次培養液,連續7 d后實驗組獲得CRY2穩定過表達的HepG2細胞。以未轉染的HepG2細胞作為空白組。
1.3 HepG2細胞增殖情況觀察 實驗組、對照組、空白組的細胞分別接種于培養瓶中,待細胞長滿培養瓶的85%~90%時,用胰酶消化后離心收集,用含10%胎牛血清及1%抗生素的DMEM培養液重懸、計數,以2×103/mL接種于96孔板中,每孔加100 μL的培養液,每20孔分為一組,共三組。于轉染后24、48、72、96 h,各組分別選取5孔檢測細胞增殖情況。每孔棄培養基后,加入血清與CCK-8(100∶10)混合液110 μL,置于37 ℃、5% CO2條件培養箱中培養2 h,采用酶聯免疫檢測儀于波長460 nm處檢測各孔吸光度值,表示細胞增殖能力。
1.4 HepG2細胞中生物鐘基因檢測 采用real-time PCR法檢測實驗組和對照組細胞中的生物鐘基因CLOCK、BMAL1、PER1、PER2、PER3、DEC1、DEC2、CRY1、CRY2、NPAS2 mRNA。收集實驗組和對照組細胞,TRIzol法提取總RNA,計算RNA濃度,將RNA反轉錄合成cDNA,再以cDNA為模板,進行基因擴增。反應體系:2×SYBR PremixEx TaqTMⅡ 12.5 μL,0.4 μmol/L的上、下游引物各1 μL,50 ng/μL的DNA模板2 μL,三蒸水8.5 μL。反應條件:95 ℃預變性60 s,95 ℃變性60 s,60 ℃退火60 s,72 ℃延伸60 s,擴增40個循環,72 ℃再延伸 10 min。以β-actin為內參,以2-ΔΔCt表示目的基因相對表達量。重復3次實驗取平均值。相關生物鐘基因及內參基因引物序列見表1。

表1 生物鐘基因及內參基因引物序列
1.5 HepG2細胞中生物鐘基因蛋白檢測 將對數生長期的實驗組和對照組HepG2細胞用RIPA裂解液置于冰上裂解30 min,用細胞刮刀收集后于4 ℃、12 000 r/min離心機中離心5 min,收集上清液。用BCA蛋白測定試劑盒測定蛋白濃度。加入1/4體積的5×loading buffer,100 ℃加熱10 min。取10 μg蛋白樣品溶液于聚丙烯酰胺凝膠中電泳,凝膠濕轉PVDF膜,用5%脫脂奶粉室溫封閉1 h;加入相應的一抗抗體,4 ℃靜置孵育過夜,TBST洗膜3次,每次10 min后加入相應抗兔或抗鼠二抗IgG抗體,孵育1 h后洗膜3遍;暗室下將ECL發光液滴加在PVDF膜上,化學發光儀曝光,用凝膠成像系統拍照并測量蛋白條帶灰度值。以目的蛋白和內參蛋白條帶灰度值的比值表示目的蛋白相對表達量。實驗重復3次,取均值。
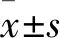
2 結果
2.1 各組細胞增殖能力比較 隨著轉染時間延長,各組細胞增殖能力呈增高趨勢。轉染48、72、96 h后,實驗組細胞增殖能力較對照組和空白組降低(P均<0.05)。詳見表2。
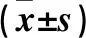
表2 轉染24、48、72、96 h后各組細胞增殖能力比較
注:與同時點對照組、空白組相比,*P<0.05。
2.2 兩組HepG2細胞中生物鐘基因及蛋白表達比較 實驗組細胞中PER1、PER2、PER3、CLOCK、CRY1、CRY2、BMAL1、NPAS2、DEC2 mRNA及蛋白相對表達量均高于對照組,DEC1 mRNA及蛋白相對表達量均低于對照組(P均<0.05)。詳見表3、4。
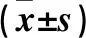
表3 實驗組與對照組細胞中生物鐘基因表達比較
注:與對照組相比,*P<0.05。
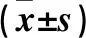
表4 實驗組與對照組細胞中生物鐘基因蛋白表達比較
注:與對照組相比,*P<0.05。
3 討論
生物鐘是晝夜節律的分子基礎,它是一種內源性的自身調節的循環過程,通過轉錄、翻譯、翻譯后修飾等一系列過程,形成節律性的生理周期[11~13]。細胞內生物鐘基因主要由一系列呈節律表達的生物鐘基因及其相應蛋白產物在轉錄和翻譯水平調控。這種轉錄-翻譯反饋環路的生物節律即是生物鐘的基本分子機制。[14~16]。CRYs可與生物鐘基因PERs形成復合體,從而調控生物鐘基因網絡[17]。目前已有報道生物鐘基因CRY2在多種腫瘤組織中的表達具有顯著差異,并調控下游腫瘤相關信號通路,從而參與惡性腫瘤的發生發展[18]。CRY2作為生物鐘基因網絡中關鍵環節,其在惡性腫瘤中表達上調是否導致生物鐘基因網絡中其他生物鐘基因表達的改變,目前尚未明確。
生物鐘基因除了其固有的生物鐘效應外,近年來越來越多的研究表明生物節律的異常表達還與腫瘤的發生、發展、療效和預后等密切相關。生物鐘基因CRY2即是已發現的幾種參與腫瘤發生發展的核心調控基因之一[19~21]。CRY2是晝夜節律核心振蕩器復合物的關鍵組分,其表達可受其他生物鐘基因調控。研究[13,16]表明生物鐘基因CLOCK/ARNTL形成的異二聚體可促進CRY2表達上調,CRY2與PERs形成異二聚體與CLOCK/ARNTL相互作用在反饋環中抑制CRY2表達上調。CRY2通過調控生物鐘基因網絡,參與細胞DNA損傷檢查點控制和重要細胞周期相關基因表達調節。同時,還有研究[17]表明CRY2突變可增加細胞對基因毒性藥物誘導的細胞凋亡的敏感性,同時也抑制p53突變小鼠惡性腫瘤的早期發展。此外,乳腺癌細胞CRY2表達下調更容易導致DNA損傷修復機制的破壞[18]。上述研究表明,CRY2可能與腫瘤的發生發展及預后密切相關,與患者的DNA損傷和化療效果也有關[19,20]。因此,深入研究其中分子生物學機制有助于提高腫瘤治療效果、改善患者預后。
本研究細胞增殖實驗結果顯示,CRY2過表達后,HepG2細胞增殖能力顯著下降,提示CRY2基因表達變化影響肝癌細胞的增殖。我們進一步檢測兩組細胞中生物鐘基因及蛋白發現,CRY2過表達后,肝癌細胞中PER1、PER2、PER3、CLOCK、CRY1、BMAL1 mRNA及蛋白表達水平均上調。上述研究結果提示,CRY2上調后可能通過調控生物鐘網絡從而抑制肝癌細胞的增殖能力,然而CRY2調控生物鐘網絡的具體分子生物學機制仍不清楚。本研究證實了CRY2過表達可顯著抑制肝癌細胞的增殖能力,同時能夠影響其他生物鐘基因的表達,進一步說明了生物鐘基因CRY2及其調控的生物鐘網絡在肝癌的惡性生物學行為中發揮著重要作用。未來我們將深入研究CRY2調控生物鐘網絡、調控肝癌細胞生物學行為的分子機制,最終為肝癌的臨床診斷及治療提供新思路。

