CIK細胞對肝癌細胞株HEP-G2體外殺傷作用及殺傷機制研究
龔小波 楊大剛△ 孫誠誼 王惠群 劉影
(1.貴州醫科大學附屬醫院,貴州 貴陽 550004 ;2.貴州醫科大學,貴州 貴陽 550004)
肝癌是當前嚴重威脅人類健康與生命的惡性腫瘤,占全球新發現癌癥的5.4%,其死亡率高,我國肝癌死亡率僅次于肺癌居第二位[1]。目前,肝癌以手術切除結合放療及化療的綜合治療為主。雖然綜合治療將肝癌的5年生存率提高了近15%,但總體仍未超過30%[2]。隨著腫瘤免疫學的不斷進展,腫瘤免疫治療已經成為繼手術和放、化療之后第四種腫瘤治療的手段,并且有望成為最終攻克腫瘤的方向[3]。本實驗通過研究CIK細胞在體外對肝癌細胞株HEP-G2的殺傷作用及殺傷機制,為肝癌的細胞免疫治療提供實驗依據。
1 材料與方法
1.1試劑及儀器 DMEM高糖培養基、PRMI-1640培養基、PBS緩沖液(美國Hyclone公司);GT-T551無血清培養基(北京寶日醫生物技術公司);胎牛血清(杭州四季青公司);淋巴細胞分離液(挪威Axis-shield公司);IFN-γ、IL-1α、CD3McAb、IL-2(美國Peprotech公司);臺盼藍染液、二甲基亞砜(DMSO)、辣根過氧化物酶(HRP)偶聯羊抗兔(二抗)(貴州鼎國生物技術公司);CD3-ECD、CD8-PE、CD56-FITC、CD69-PE、HLA-DR-FITC(美國Beckman CoμLter 公司);四甲基偶氮唑藍(MTT)(貴州賽蘭博科技公司);JC-1試劑盒、BCA蛋白濃度測定試劑盒、兔β-actin(上海碧云天生物技術公司);PVDF膜、ECL反應試劑盒(美國Amersham公司);兔抗人Caspase-3(一抗)(北京博奧森生物技術公司)。CO2培養箱、生物安全柜、低溫離心機(美國Thermo公司)、多功能酶標儀(美國Bio-tek公司);流式細胞儀(美國Beckman CoμLter 公司);Western blot電泳及轉印設備(美國Bio-rad公司);熒光顯微鏡(日本奧林巴斯公司)。
1.2細胞獲取及培養 肝癌細胞株HEP-G2來自于貴州醫科大學附屬醫院肝膽外科液氮長期保存。在含10%胎牛血清的DMEM培養基,37 ℃、5% CO2培養箱中培養,取對數生長期細胞進行實驗。CIK細胞制備:CIK細胞由貴陽醫學院附屬醫院腫瘤生物治療中心制備。健康志愿者外周血經淋巴細胞分離液分離,分離后的外周血單個核細胞(PBMC)用含0.6%自體血清的GT-T551培養基調至起始密度為2.0×106/L。于第0天加入IFN-γ 1 000 U/mL,置于37 ℃、5% CO2培養箱中培養,24 h后加入IL-1α 100 U/mL,CD3McAb 50 ng/mL,IL-2 1 000 U/mL繼續培養。以后根據培養情況添加含IL-2 1 000 U/mL的GT-T551培養基,并調整細胞密度為2.0×106/mL。CIK細胞培養至14 d,取少許培養細胞做流式細胞儀檢測。
1.3CIK細胞增殖及免疫表型檢測 培養第1、4、7、10、14 d時用臺盼藍染液計數CIK細胞數,并計算增殖倍數。流式細胞儀檢測CD3、CD56、CD8、CD69及HLA-DR的表達情況以表征CIK細胞的免疫表型及活化程度。
1.4CIK細胞殺瘤活性測定
1.4.1MTT法檢測CIK細胞對HEP-G2細胞殺傷活性 將HEP-G2細胞作為靶細胞按20×104/mL加入96孔板,每孔100 μL細胞懸液。12 h后按照效靶比1∶1、2.5∶1、5∶1、10∶1、20∶1加入CIK細胞,另設單獨HEP-G2細胞組和單獨CIK細胞組。每組均設3個復孔,37 ℃、5%CO2培養箱中各培養24、48、72 h。取出孔板振蕩,棄上清,PBS 100 μL洗板2次,1640培養基100 μL/孔,MTT(5 mg/mL)20 μL/孔,于37 ℃、5% CO2培養箱中培養4 h。取出孔板1 000 rpm離心5 min,棄上清,DMSO 200 μL/孔,振蕩溶解10 min,用酶標儀490 nm,測OD值,計算CIK殺瘤活性。殺傷率(%)=[1-(實驗組OD值-單獨CIK細胞組OD值)/單獨HEP-G2細胞組OD值]×100%。
1.4.2JC-1熒光染色檢測CIK細胞對HEP-G2細胞殺傷活性 將HEP-G2細胞作為靶細胞按130×104/mL加入6孔板,每孔1.5 mL細胞懸液。12 h后按照效靶比1∶1、5∶1、10∶1、20∶1加入CIK細胞,37 ℃、5% CO2培養箱中培養24 h。然后取出6孔板振蕩,棄上清,PBS 2 mL/孔洗板2次,1640培養液1 mL/孔、JC-1工作液1 mL/孔,37 ℃、5% CO2培養箱中培養20 min。取出孔板棄上清,JC-1緩沖液1 mL/孔洗板2次,1640培養基2 mL/孔,熒光顯微鏡下觀察。
1.5HEP-G2細胞中Caspase-3蛋白的表達情況 將HEP-G2細胞作為靶細胞按45×104/mL加入6孔板中4孔(A、B、C、D),12h后按效靶比1∶1、5∶1、10∶1、20∶1加入CIK細胞,37 ℃、5% CO2培養箱中培養24 h。收集并裂解細胞,提取總蛋白,用BCA試劑測蛋白含量。等量蛋白質采用120 g/L十二烷基硫酸鈉—聚丙烯酰胺凝膠垂直電泳,然后轉至PVDF膜上,用封閉液4 ℃封閉過夜,加入兔抗人Caspase-3抗體(1∶200),室溫孵育2 h,室溫下洗膜后加入相應辣根過氧化物酶(HRP)耦聯羊抗兔2抗,室溫孵育1 h,ECL顯影。以β-actin條帶作為內對照。
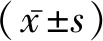
2 結 果
2.1細胞增殖及免疫表型檢測
2.1.1細胞增殖的動態觀察 見圖1,CIK細胞在第1~7天增殖比較緩慢,第7天以后增殖速度加快,第14天細胞增殖約100倍,細胞數為(9 611±961)×106個。細胞活率保持在97%以上。

圖1 CIK細胞增殖情況
2.1.2CIK細胞免疫表型變化 見圖2,CD3+CD8+及CD3+CD56+的比例隨培養時間的增加逐漸增高。培養第14天時,CD3+CD8+和CD3+CD56+比例分別達到(71.37±3.68)%和(23.93±4.20)%。

圖2 CIK細胞免疫表型變化
2.1.3CIK細胞活化情況 見圖3,T細胞活化標志HLA-DR的表達率隨培養時間的增加而增高。培養第14 d時,T細胞活化標志HLA-DR的表達率達到93.45%,已具備活化的淋巴細胞功能。

圖3 CIK細胞活化情況
2.2MTT法檢測CIK細胞對HEP-G2細胞殺傷活性 CIK細胞在體外對肝癌細胞株HEP-G2具有殺傷作用,并且隨著CIK細胞劑量及作用時間的增加,殺傷率增加(P<0.05)。效靶細胞作用24 h時,效靶比20∶1殺傷率與效靶比10∶1差異無統計學意義(P>0.05)。效靶細胞作用48 h時,效靶比20∶1殺傷率與效靶比10∶1差異有統計學意義(P<0.05)。效靶細胞作用72 h時,效靶比20∶1殺傷率與效靶比10∶1差異無統計學意義(P>0.05)。見表1。

表1 不同效靶細胞作用一定時間的殺傷率
注:與1∶1比較,△P<0.05,▲P<0.01;與2.5∶1比較,○P<0.05,●P<0.01;與5∶1比較,☆P<0.05,★P<0.01;與10∶1比較,◆P<0.01。與24 h比較,*P<0.05,&P<0.01;與48 h比較,#P<0.05。
2.3JC-1熒光染色檢測CIK細胞對HEP-G2細胞殺傷活性 圖4是不同效靶比的JC-1熒光圖。如圖所示:效靶比1∶1、5∶1、10∶1、20∶1作用24 h后,利用JC-1熒光染色檢測CIK細胞對HEP-G2細胞殺傷活性,綠色熒光表示HEP-G2細胞已經處于早期凋亡。
2.4Western blot法檢測肝癌細胞株HEP-G2中Caspase-3蛋白的表達 見表2,效靶比為1∶1時,凋亡蛋白Caspase-3的表達高于效靶比5∶1(P<0.05)。效靶比為20∶1、10∶1時,凋亡蛋白Caspase-3的表達均高于效靶比5∶1、1∶1(P<0.05)。見圖5,與CIK細胞共孵育的HEP-G2細胞在32 kD處出現明顯蛋白條帶,與所染Caspase-3一抗目的蛋白分子量相同。

表2 Caspase-3蛋白與β-actin總灰度值及不同效靶比組蛋白相對表達量的比較
注:與1∶1比較,*P<0.05。與5∶1比較,#P<0.05。

圖5 不同效靶比組Caspase-3蛋白的表達膠片
3 討 論
CIK細胞(多種細胞因子誘導的殺傷細胞)同時表達CD3+CD56+CD8+膜蛋白分子,又稱為NK細胞樣T淋巴細胞,兼具T淋巴細胞強大的抗瘤活性和NK細胞的非MHC限制性殺瘤優點;具有廣譜腫瘤殺傷性,對多種腫瘤細胞均表現強大的殺傷活性,對多重耐藥腫瘤細胞也具有殺傷活性,更加安全可靠、無毒副作用[4-6]。本研究培養的CIK細胞,經過14 d的擴增培養后,CD3+CD8+細胞比例提高2.24倍,CD3+CD56+細胞比例提高5.12倍,活化T細胞比例提高10.11倍,達到93.45%。表明培養細胞具備典型CIK細胞表型,并高度活化。
本研究結果顯示:(1)效靶細胞作用相同時間時,效靶比20∶1組與其它效靶比組相比,CIK細胞對肝癌細胞株HEP-G2有明顯殺傷作用。(2)效靶細胞作用48 h時,效靶比20∶1組與效靶比10∶1組在CIK細胞對肝癌細胞株HEP-G2的殺傷率上有差異。但作用24 h時,效靶比20∶1組與效靶比10∶1組殺傷率卻未發現差異。這是因為效靶細胞作用24 h時,CIK細胞對肝癌細胞株HEP-G2作用時間不足,殺傷作用不能完全體現。效靶細胞作用72h時,效靶比20∶1組與效靶比10∶1組殺傷率同樣未發現差異。這是因為CIK細胞、肝癌細胞株HEP-G2消耗培養基及細胞自身的凋亡,使得此時的殺傷率較效靶細胞作用48 h時的殺傷率增加幅度不大。此結果間接驗證了臨床回輸CIK細胞到人體的時間即間隔48 h回輸人體,1周為1療程。本研究還顯示,效靶細胞互相作用24 h后,當效靶比為1∶1時,JC-1熒光染色檢測到肝癌細胞株HEP-G2剩余的細胞數量最多,且肝癌細胞株HEP-G2呈紅色熒光的細胞數量均明顯多于其他效靶比組。當效靶比為20∶1時,肝癌細胞株HEP-G2剩余的細胞數量最少。
CIK細胞殺傷腫瘤細胞的機制并不十分明確,目前公認的:(1)CIK細胞釋放胞漿顆粒進入肝癌細胞外間隔,通過顆粒內含物發揮對靶細胞的直接殺傷作用。(2)CIK細胞可以釋放大量炎性細胞因子如IL-4、IL-2、IFN-γ、GM-CSF、TNF-a等,這些細胞因子不僅對腫瘤細胞有直接抑制作用,還可以通過調節機體免疫系統反應性間接殺傷腫瘤細胞[7]。(3)CIK細胞高水平表達Bcl-2、Bcl-xL、DADI、survivin等抗凋亡基因,這些基因共同導致CIK細胞可以耐受表達FasL(CD178)的肝癌細胞誘導的凋亡。CIK細胞也可以通過Fas/FasL途徑誘導凋亡機制,從而對其進行有效的殺傷[8]。Fas(CD95)作為一種普遍表達的受體分子,可以出現在多種細胞表面。FasL的大量表達只見于活化的T細胞和NK細胞。Fas和FasL的配接以三聚體的形式出現。3個Fas分子胞內段所帶有的死亡結構域(DD)相聚成簇,招募了胞漿中另一種帶有死亡結構域的銜接蛋白(FADD)。FADD以其DED(死亡效應結構域)連接另一個帶有DED的后續成分稱為Caspase8前體。Caspase8前體屬于酶原,激活后稱為Caspase8。Caspase8使Caspase3酶原轉化為具有活性的Caspase3,從而引發Caspase介導的級聯反應[9],誘導細胞的凋亡。
本研究發現,CIK細胞、HEP-G2細胞按照效靶比20∶1、10∶1、5∶1、1∶1在互相作用24 h后,均有凋亡蛋白Caspase-3的表達。其中,效靶比為20∶1、10∶1時,凋亡蛋白Caspase-3的表達均明顯高于效靶比5∶1、1∶1,表明在殺傷過程中CIK細胞的增加能導致凋亡蛋白Caspase-3的表達增多,誘導肝癌細胞凋亡的作用增強。但效靶比為1∶1(24 h)時,凋亡蛋白Caspase-3的表達高于效靶比5∶1。因此考慮效靶比5∶1比效靶比1∶1消耗的培養基相對較多,而效靶比5∶1組中的CIK細胞數量少于效靶比20∶1、10∶1組中的CIK細胞數量,故效靶比5∶1組中的CIK細胞既消耗了培養基、數量又不足,所以不能有效地誘導肝癌細胞HEP-G2的凋亡。
綜上,CIK細胞在體外對肝癌細胞株HEP-G2有明顯殺傷作用。殺傷機制有可能是通過Fas/FasL凋亡途徑,啟動凋亡蛋白Caspase介導的級聯反應,誘導下游凋亡蛋白Caspase-3的表達,從而引起肝癌細胞株HEP-G2的凋亡。


