結腸息肉大小、異型增生與胃發生腸上皮化生的相關性分析
高 智,屈亞威,劉海峰,
胃癌是常見的消化道腫瘤,其發病率在全球中位居第四位,在癌癥死亡原因中位居第二位[1]。在胃癌分型中,腸型胃癌是最常見的亞型,此分型來源于腸型胃癌的Correa級聯反應模式;在此模式中,正常胃部組織被幽門螺桿菌(Helicobacterpylori,HP)感染后經過微小黏膜病變逐步發展為胃炎、萎縮性胃炎、胃腸上皮化生(gastric intestinal metaplasia,GIM),之后出現異型增生最終導致腸型胃癌的發生[2]。雖然有許多針對胃癌的治療方案,但是多數胃癌患者仍因錯過最佳治療時期而縮短其生存時間;因此,需在胃癌形成前進行早期干預,對于存在癌前病變,如GIM的患者應進行長期隨訪[3],以避免胃癌的發生。
HP感染是GIM發生的主要危險因素。研究[4]結果表明,HP感染也與結直腸息肉和結直腸癌(colorectal cancer,CRC)的發生有關,HP感染可增加結直腸息肉和CRC的發病率。基于此,國外學者針對結腸息肉與GIM之間的關系進行研究,證實了結腸高級別上皮內瘤變是GIM的危險因素[5]。為進一步研究結腸息肉與GIM之間的關系,該研究對入組患者的結腸息肉發病部位、大小、數目、有無HP感染等因素進行統計分析,旨在總結分析結腸息肉的發生對GIM的影響,分析結腸息肉與GIM之間的相關性。
1 材料與方法
1.1病例資料回顧性研究2017年1月~12月在武警總醫院消化內科同時行胃鏡和腸鏡檢查患者的臨床資料,根據納入與排除標準共入組患者資料757例。根據胃鏡下表現、醋酸染色或病理活檢作為診斷GIM的標準,將其分為GIM組(n=397)與無GIM組(n=360),其中以胃鏡下表現及醋酸染色診斷GIM者136例,病理活檢診斷GIM者261例。收集兩組患者的一般情況與腸鏡檢查結果,包括性別、年齡、是否存在結腸息肉以及結腸息肉的部位、大小、數量和息肉有無異型增生。其中結腸息肉的部位分為3種,將位于橫結腸、肝區、升結腸以及盲腸部位的息肉定義為近端結腸息肉;位于直腸、乙狀結腸、降結腸和脾曲的息肉定義為遠端結腸息肉;近端及遠端結腸均出現息肉者定義為全結腸息肉。息肉的大小分為4級,Ⅰ:<0.5 cm,Ⅱ:0.5~1.0 cm,Ⅲ:1.0~2.0 cm,Ⅳ:>2.0 cm。息肉數目分為2種,單發:息肉數目為1枚,多發:息肉數目≥2枚。異型增生以組織病理學檢查為標準。
1.2納入與排除標準納入標準:① 年齡>18歲;② 于3 d內同時行胃鏡與腸鏡檢查。排除標準:① 長期服用抑酸劑與抗生素或正在進行HP根治者;② 腸道準備不足者;③ 炎癥性腸病者;④ 家族性腺瘤性息肉病者;⑤ 胃癌或結直腸癌者。
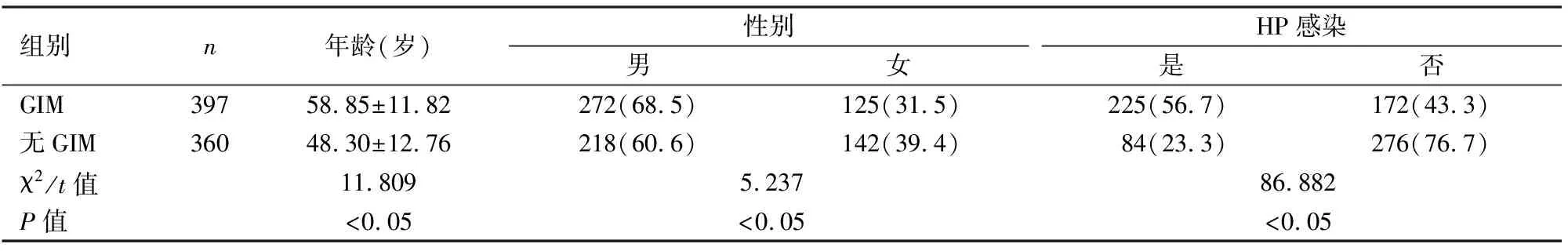
表1 兩組患者一般資料比較[n(%)]
1.3方法HP檢測采用C13呼氣試驗法,于內鏡檢查前1天進行檢測。患者于腸鏡檢查前1天進食流質飲食,晚8時口服果導片0.4 g,檢查當日4時口服聚乙二醇電解質散24盒,溶于2 000 ml水中,分次口服,首次口服600 ml左右,之后每隔15 min口服250 ml至排出清水。患者于胃鏡檢查前20 min口含鹽酸利多卡因膠漿0.2 g,10 min后行胃鏡檢查,根據胃鏡下醋酸染色診斷或內鏡下活檢后組織切片HE染色診斷患者是否出現腸化。

2 結果
2.1一般資料共納入757例患者,GIM組397例,無GIM組360例,兩組間性別及年齡比較差異有統計學意義(χ2=5.237,P<0.05;t=11.809,P<0.05),進一步將年齡分為≥50歲與<50歲兩組,兩組中年齡≥50歲的患者例數比較差異有統計學意義(χ2=172.949,P<0.05),兩組間HP感染發生率比較差異有統計學意義(χ2=86.882,P<0.05),見表1。
2.2兩組結腸息肉生長情況的統計分析經統計分析,GIM組結腸息肉發病率(χ2=5.487,P<0.05)、異型增生發生率(χ2=15.640,P<0.001)均高于無GIM組,兩組比較差異有統計學意義。見表2。兩組間結腸息肉生長部位比較差異無統計學意義(χ2=6.646,P>0.05),見表3。兩組間息肉生長大小的差異有統計學意義(χ2=11.525,P<0.05),見表4。在GIM組中,單發息肉者46例(11.6%),多發息肉者61例(15.4%),均略高于無GIM組,但兩組間息肉發生數目比較差異無統計學意義(χ2=5.133,P>0.05),見表5。
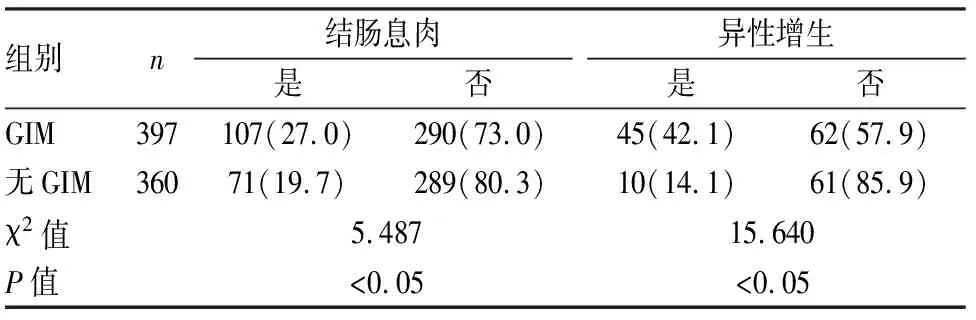
表2 兩組患者結腸息肉發生率及異型增生發生率比較[n(%)]

表3 兩組患者結腸息肉的生長部位比較[n(%)]
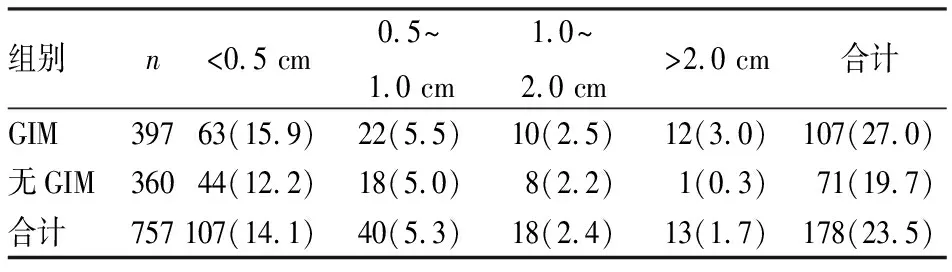
表4 兩組患者結腸息肉的大小比較[n(%)]
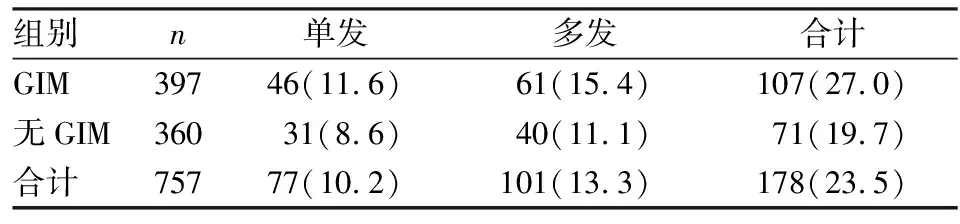
表5 兩組患者結腸息肉數目比較[n(%)]
2.3結腸息肉與GIM間關系的多因素分析將腸上皮化生作為應變量,χ2檢驗結果出現統計學差異的變量,如年齡、性別、HP感染等變量經賦值后進行二元logistic回歸分析,各變量及賦值信息,見表6。logistic回歸分析結果見表7。在GIM組與無GIM組對比中,息肉<0.5 cm、息肉大小為0.5~1.0 cm發生率差異均無統計學意義(P>0.05),年齡≥50歲(OR=10.035,P<0.001)、性別為男性(OR=1.555,P<0.05)、HP感染(OR=5.135,P<0.05)、異型增生(OR=3.392,P<0.05)、息肉大小為1.0~2.0 cm(OR=0.083,P<0.05)、息肉>2.0 cm(OR=3.878,P<0.05)差異有統計學意義,結合OR值,年齡≥50歲、男性、息肉>2.0 cm、異型增生OR值>1,說明上述因素為發生GIM的危險因素,出現GIM的可能性大,建議行胃鏡檢查以期及早發現GIM并進行隨訪以提高早期胃癌檢出率;息肉大小為1.0~2.0 cm者OR值<1,說明息肉為1.0~2.0 cm是GIM的保護因素,行胃鏡檢查時出現無GIM的可能性大,對于此類患者應行HP檢查以期及早發現危險因素并進行干預以避免GIM的發生。

表6 GIM相關因素賦值表
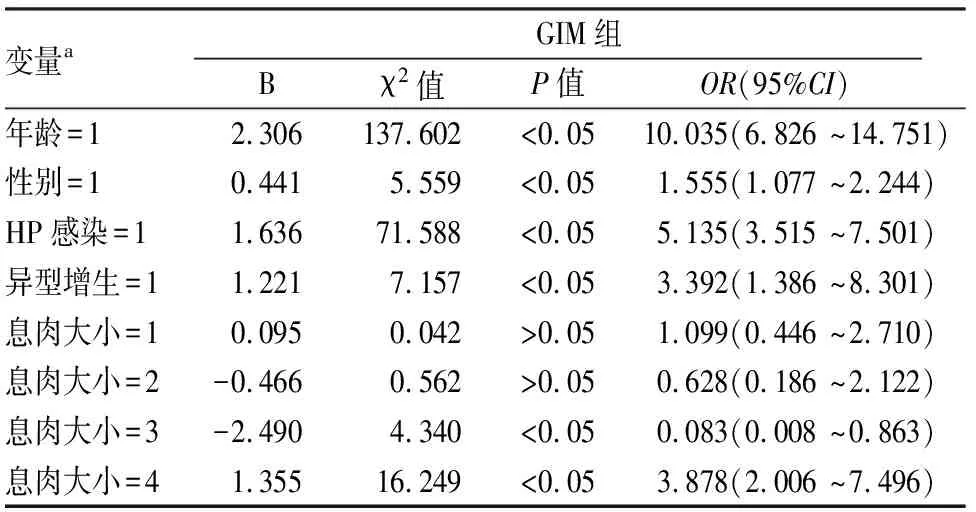
表7 GIM的臨床特征logistic回歸分析
a該表以病理檢查結果以無GIM組為對照組,B:回歸系數;OR:相對危險度;CI:置信區間
3 討論
胃癌是我國常見的消化道腫瘤之一,發病率為31.38/10萬,死亡率位居惡性腫瘤死亡率第3位[6]。胃癌的發生是多因素參與、逐漸演變的復雜過程,其最常見的危險包括年齡、性別、不良飲食習慣、吸煙、飲酒、HP感染及遺傳因素等[7]。胃癌患者的生存率與胃癌進展程度密切相關,早期胃癌患者治療后5年生存率高達90%以上[8],而進展期胃癌患者治療后5年生存率僅30%[9]。因此,胃癌的早診早治至關重要。目前常用的篩查方法有血清胃蛋白酶原及胃泌素17檢測、上消化道鋇餐檢查、內鏡篩查等;其中,內鏡及其活檢是診斷胃癌的金標準,對于平坦或凹陷型病變的早期胃癌以及癌前病變,其檢出率高于鋇餐等其他方法[7]。GIM即胃黏膜柱狀上皮被潘氏細胞、腸型杯狀細胞及吸收細胞所取代的病理過程[10]。GIM為胃癌的癌前病變,有研究[11]表明,GIM使慢性胃炎患者發生胃癌的風險提高了17.4~29.3倍。因此,內鏡下診斷并干預GIM的發生、發展對于降低胃癌發生率有重要意義。本文對GIM發生的因素進行研究分析,結果表明年齡≥50歲、男性、HP感染者患GIM的風險顯著增加,與研究[12-13]結果一致。GIM的臨床特征logistic回歸分析結果表明,除年齡、性別、HP感染與GIM的發生有關,結腸息肉>2.0 cm、息肉出現異型增生也與GIM發生有關,而息肉大小為1.0~2.0 cm者出現GIM可能性小。
有課題組同樣對GIM與結腸息肉發生特點進行研究[5],結果表明出現異型增生可增加GIM發生的風險,而結腸息肉大小、生長部位對GIM無影響。本研究在結腸息肉異型增生與GIM關系結果與研究[5]一致,但結腸息肉大小與GIM關系的結論存在差異,可能原因與生活環境、飲食習慣、遺傳及HP感染率高有關。HP感染引起結腸息肉或結腸癌的機制目前仍在研究中。最常見的假說為兩種[14]:一是HP感染引起的高胃泌素血癥,而胃泌素在腫瘤早期起促進增殖與分化的作用;另一假說為長期HP感染引起胃黏膜萎縮,使胃液分泌減少,引起腸道細菌過度生長、腸道營養物過剩而引發腸道炎癥。因此,HP感染患者GIM的風險增加,同時結腸息肉的發生率增高。
綜上所述,結腸息肉>2.0 cm或出現異型增生者發生GIM的風險較高,應提高警惕,當患者僅行結腸鏡檢查時出現上述息肉類型應及時行胃鏡檢查,以期及早發現GIM并進行隨訪以提高早期胃癌的檢出率。本研究樣本量較少,可進行大樣本量、多中心研究,同時可將生活地區、飲食習慣等影響因素納入回歸分析模型中,并進一步對結腸息肉大小、病變類型進行劃分以進一步研究結腸息肉與GIM的關系。

