急性髓系白血病患者骨髓單個核細胞中EZH2、PTEN mRNA表達及其相關性
李乾鵬,冉學紅,朱旭,劉洋,盛志新,劉麗萍
(濰坊市人民醫院,山東濰坊261000)
急性髓系白血病(AML)是一組高度異質性、源于白血病干細胞的惡性克隆性疾病群[1]。隨診療技術的提高,AML患者預后得到很大改善,但因AML易復發和耐藥,導致現階段治療失敗率較高[2]。對AML復發耐藥機制深入研究,有助于探索更有效的診療手段。果蠅zeste基因增強子同源物2(EZH2)[3,4]具有組蛋白甲基轉移酶的活性,在多種惡性實體腫瘤(如卵巢癌、胃癌等)中高表達,且與預后不良相關[4~6]。新近報道顯示,血液系統惡性腫瘤中EZH2呈高表達,并且EZH2高表達多發生在高危患者[3],提示EZH2參與血液系統惡性腫瘤的發生發展。張力蛋白同源的10號染色體缺失的磷酸酶基因(PTEN)是一種具有雙重特異性磷酸酶活性的抑癌基因,位于10號染色體上[7]。PTEN可使PIP3去磷酸化,調節細胞的增殖與存活[8]。PTEN在腫瘤組織中低表達,是某些腫瘤(如膀胱癌、胃癌等)診斷及預后的重要參考指標。研究表明,PTEN表達或活性水平微量降低可導致腫瘤易感性增強[8]。另有報道顯示,PTEN表達缺失可促進白血病干細胞產生[8,9]。由此可見,PTEN在腫瘤的發生發展中發揮重要作用。為探討EZH2、PTEN在AML發生發展中的作用,本研究采用實時熒光定量PCR法檢測AML患者骨髓單個核細胞中的EZH2、PTEN mRNA表達,并分析EZH2 mRNA與PTEN mRNA表達的相關性,為AML的診療提供新思路。
1 材料與方法
1.1 骨髓單個核細胞來源 選取濰坊市人民醫院血液科2014年3月~2015年3月收治的AML患者60例納入AML組,其中男29例、女31例,年齡16~82(47.24±7.91)歲。AML診斷標準參照《血液診斷及療效標準第3版》。另選擇因貧血、不明原因出血等行骨髓穿刺檢查者20例為正常對照組。本研究經醫院醫學倫理委員會批準,受試者均簽署知情同意書。采集兩組研究對象的骨髓液5 mL,無菌條件下EDTA抗凝處理,加入紅細胞裂解液,室溫靜置10 min,1 300 r/min離心10 min,PBS洗滌2次,獲得骨髓單個核細胞。
1.2 骨髓單個核細胞中EZH2、PTEN mRNA檢測 采用實時熒光定量PCR法。用TRIzol提取骨髓單個核細胞總RNA,檢測總RNA純度,逆轉錄為cDNA,進行PCR反應。PCR反應體系參照Real Master Mix(SYBR Green)試劑盒配置。反應條件為94 ℃反應5 min;94 ℃ 15 s,60 ℃ 60 s,共計40個循環終止反應;在PCR循環第二步60 ℃時收集熒光信號,設空白對照。內參β-actin上游引物序列為5′-AAGTACTCCGTGTGGATCGG-3′,下游引物序列為5′-ATGCTATCACCTCCCCTGTG-3′;人EZH2基因上游引物序列為5′-GACCCTGACCTCTGTCTTACTT-3′,下游引物序列為5′-GATGGTGCCAGGCAATAGATG-3′。人PTEN上游引物序列為5′-CTATTCCCAGTCAGAGGCGCTAT-3′,下游引物序列為5′-TGAACTTGTCTATCCCGTCGTGT-3′。以2-ΔΔCt表示目的基因相對表達量。
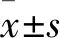
2 結果
2.1 AML組及正常對照組骨髓單個核細胞中EZH2、PTEN mRNA表達比較 AML組及正常對照組骨髓單個核細胞中EZH2 mRNA相對表達量分別為284.8±15.9、100.0±7.2,AML組及正常對照組骨髓單個核細胞中PTEN mRNA相對表達量分別為30.8±3.6、103.0±7.5。AML組骨髓單個核細胞中EZH2 mRNA相對表達量高于正常對照組,PTEN mRNA相對表達量低于正常對照組(P均<0.01)。
2.2 AML患者骨髓單個核細胞中EZH2 mRNA、PTEN mRNA表達的相關性 AML患者骨髓單個核細胞中EZH2 mRNA與PTEN mRNA相對表達量呈負相關(r=-0.694,P<0.05)。
3 討論
AML是嚴重威脅人類健康的造血系統惡性克隆性疾病[1,10]。AML的發病率逐年增加,且5年生存率小于50%[2,10]。化療作為AML的主要治療手段,已取得較大進展,但由于耐藥現象的存在,多數患者仍出現難治、復發,最終導致治療失敗[11]。表觀遺傳學變異在白血病的復發耐藥中具有重要作用。白血病細胞耐藥的主要機制包括DNA損傷修復異常、細胞周期紊亂、細胞凋亡逃逸、藥物代謝干擾、藥物靶點變異、藥物轉運障礙等。
EZH2基因位于染色體7q35,是PcG復合物的核心組成部分[12]。EZH2可三甲基化組蛋白H3的27位賴氨酸,發揮基因沉默的生物學效應;亦可通過甲基化依賴的泛素化機制降解RORα,沉默相關基因[3]。另外,EZH2也有基因活化的作用,如通過與β-catenin、ERα相互作用,導致ERα/β-catenin/Wnt通路活化,通過與RelA/RelB相互作用激活NF-κB[13,14]。EZH2在多種腫瘤的發生發展及腫瘤細胞的轉移、侵襲、耐藥中發揮重要作用,主要機制包括miRNA沉默、腫瘤免疫逃逸、非經典轉錄調節等[15]。在血液系統中,EZH2對維持造血干細胞的自我更新、分化有重要意義[13]。EZH2在AML、多發性骨髓瘤、淋巴瘤等惡性血液系統疾病中異常表達,且高表達EHZ2的患者預后差、易復發[16]。在血液系統疾病中,EZH2表現出雙重作用,如在彌漫性大B細胞淋巴瘤、濾泡性淋巴瘤中,EZH2存在功能獲得性突變;而在骨髓增生異常綜合征、骨髓增生異常綜合征/骨髓增殖性腫瘤、骨髓纖維化中,EZH2表現出功能缺失性突變[3]。
PTEN有9個外顯子和8個內含子,其編碼的蛋白在胞質中表現出雙重特異性磷酸酶活性,即蛋白酪氨酸磷酸酶活性和脂質磷酸酶活性[8]。在分子遺傳學水平,PTEN通過調控重要的信號通路與細胞代謝過程影響細胞基因的穩定性。在細胞水平,PTEN在干細胞的自我更新、細胞周期等方面具有重要作用[17]。在前列腺組織中,PTEN表達缺失導致腫瘤細胞增殖和腫瘤發生;在胚胎神經干細胞,PTEN表達缺失可促進干細胞的自我更新及加速細胞周期從G0期向G1期進展[8]。在血液系統,PTEN缺失可導致正常造血干細胞過度增殖并演變為白血病干細胞[17,18]。白血病干細胞中PTEN表達缺失導致干細胞基因不穩定,如β-catenin激活、Myc基因過表達等癌基因表達異常,上述癌基因異常表達又進一步促進白血病干細胞增殖,以此形成惡性反饋[8]。除此之外,PTEN缺失還可激活JAK2/STAT3通路及促進腫瘤微環境中免疫抑制因子的釋放,導致腫瘤細胞發生免疫逃逸[8]。因此,PTEN是一種重要的抑癌基因,其正常表達能夠抑制細胞過度增殖、促進細胞生理性凋亡、減少DNA損傷并抑制腫瘤細胞的代謝[8]。“胞核池”中PTEN表達水平對于維持細胞基因穩定性至關重要;PTEN表達缺失會導致細胞基因的完整性受損[8,19],出現原癌基因(如Myc)過表達及抑癌基因(如p53)低表達或缺失,促進腫瘤的發生發展與復發耐藥。
本研究結果顯示,AML組骨髓單個核細胞中EZH2 mRNA相對表達量高于正常對照組,PTEN mRNA相對表達量低于正常對照組;AML患者骨髓單個核細胞中EZH2 mRNA與PTEN mRNA表達呈負相關。這提示EZH2和PTEN與AML的發病有關,且二者之間可能存在一定的相互作用。我們推測,PTEN表達缺失可能是腫瘤發生的誘發因子。低水平的PTEN導致細胞中重要的癌基因EZH2穩定性減低,導致EZH2過度表達,進而參與AML的發病。我們先前研究發現促癌因子EVI1 mRNA在AML患者中高表達,PTEN mRNA在AML患者中低表達,二者亦呈負相關[20],推測在AML中PTEN缺失導致癌基因EZH2與EVI1突變,二者過度表達,最終誘發AML的發生發展。在此過程中是否有其他基因參與仍需要進一步驗證。關于PTEN與EZH2、EVI1之間的相互作用及其機制也有待研究證實。

