基于微流控技術的外泌體分離方法的研究進展
劉娜 杜盼盼 楊揚 李小毛
(上海大學機電工程與自動化學院,上海 200072)
外泌體是一種細胞內多泡小體與細胞膜融合后以外分泌的形式釋放到細胞外的一種囊泡,具有脂質雙分子層結構,直徑一般為30-150 nm,與其他微泡共同組成細胞外囊泡[1]。近幾年來的研究表明外泌體具有功能活性并可進行細胞間的信息傳遞,并且在抗原傳遞、蛋白及RNA轉運、血管介導新生、腫瘤細胞發生發展等過程中發揮著重要作用[2-4]。此外,由于外泌體具有體積小、易穿透生物膜、免疫原性低等優點,可以作為藥物的良好載體[5]。而且腫瘤細胞的外泌體中含有大量與腫瘤相關的mRNA、miRNA、rRNA、DNA及特異性蛋白質[4],因此在癌癥發生機制及癌癥的早期檢測中具有重要的研究和應用價值。例如,Tanaka等[6]研究表明miRNA水平與腫瘤生長進展以及侵襲性密切有關,Kalluri和Taylor等[7-8]發現癌癥患者中的病變器官和其中的異常細胞會比正常細胞產生更多的外泌體。
盡管外泌體在血液、尿液、乳液和唾液等體液中含量豐富[9],但是體液中其他種類的細胞外囊泡及生物分子往往會對其研究結果產生干擾,因此對外泌體的分離和純化是基于外泌體的疾病檢測及相關研究的重要環節。然而,外泌體具有尺寸小、密度低以及生物流體性復雜等特點,這對外泌體的分離和純化提出了重大的挑戰。近幾年來,圍繞癌癥等疾病的研究及診斷應用,已有大量針對外泌體分離和純化的方法技術研究。本文首先簡要介紹傳統的外泌體分離方法如離心法和過濾法等,然后重點介紹近年來利用聲流特性、流體動力學特性以及介電泳特性等基于微流控技術的外泌體分離方法。本文通過歸納比較當前已有的外泌體分離純化方法,旨在為要開展外泌體研究的研究人員提供參考, 推進外泌體在相關疾病檢測及其他生物醫學應用方面的研究進展。
1 傳統的外泌體分離方法
傳統的外泌體分離的方法,較為常用的有基于離心、過濾、免疫磁珠以及聚合物沉淀的方法。
超速離心法是目前傳統外泌體分離技術中應用最廣泛的方法。其原理主要是基于相對離心力的不同依次去除血液中的細胞、細胞碎片和大分子蛋白質等物質,最后分離純化得到外泌體。基于超速離心法的原理,大量改進的外泌體分泌方法被相繼報道。例如,邢宇洋等[10]采用多步差速離心的方法分離了乳腺癌MDA-MB-231細胞的外泌體,并從形態學、蛋白標記物和miRNA等方面對其進行了鑒定,進一步證實了多步差速離心方法是一種簡單有效的外泌體提取方法。陳加貴等[11]采用改良的超速離心法實現了肝癌細胞外泌體的分離和純化,首先收集使用無血清培養基培養肝癌SMMC-7721細胞的上清液,然后在3 kg下離心去除細胞和細胞碎片,然后依次在110 kg下離心3次獲得外泌體。這種改良后的超速離心方法能提取到一定純度的外泌體,并且能夠排除來自細胞培養血清所含的外泌體的干擾。為了進一步改善超速離心法分離外泌體的純度,研究者提出了利用蔗糖密度梯度的外泌體離心法,這種方法是將樣本和蔗糖梯度材料一起超速離心,使樣品中不同組分沉降到各自的等密度區域,從而實現外泌體的分離[12]。
盡管超速離心法在外泌體的分離中得到了廣泛的應用,但其對離心速度的苛刻要求以及較低的分離產量制約了其發展,為此相關學者提出了基于過濾的分離方法,如旋轉超濾技術。旋轉超濾技術分離外泌體的原理是利用超濾膜孔徑的大小對不同相對分子質量的物質進行分離。胡國文等[13]采用了一種利用旋轉超濾技術從骨髓間充質干細胞(Bone marrow mesenchymal stem cells,BMSCs)培 養 上 清液中分離外泌體的方法。首先收集骨髓間充質干細胞的培養上清液,在低速離心下去除殘余的細胞,然后用0.22 μm的過濾器去除細胞碎片,最后采用旋轉超濾技術成功分離外泌體。相對于超速離心法所需要的大于100 kg的離心力,這種方法僅需要517.125 kPa的壓力,可有效減少離心力對外泌體的損壞,并且可以提高外泌體的分離產量。然而,該方法中的缺點為過濾膜孔徑會對分離結果產生影響,Liu等[14]就發現使用30 nm和50 nm孔徑分離得到的外泌體內含蛋白質并不完全相同,這可能會導致后續的外泌體蛋白質分析和檢測結果產生差異。
外泌體表面含有CD9、CD63、CD81等特異性蛋白,因此可以利用這些特異性表面蛋白實現外泌體的分離和收集。免疫磁珠法就是一種通過抗體結合磁珠實現特異性捕獲外泌體的方法[15],該方法不僅可以增加外泌體的分離純度,還可以通過結合流式細胞術、蛋白質免疫印跡以及電子顯微鏡等方法對收集的外泌體進行分析。
另外,聚合物沉淀的方法也被用于分離外泌體。聚合物沉淀法是利用聚合物作為沉淀劑從生物樣本中分離沉降出外泌體,如基于聚乙二醇的沉淀方法的原理就是含水的聚乙二醇可以包裹外泌體形成外泌體聚合物,進而在低速離心中就可以輕松分離。Weng等[16]根據這個原理從海拉細胞培養上清液中分離出外泌體,并且研究了聚乙二醇的分子量MW和濃度對外泌體分離效果的影響。類似的,可以采用這種方法從血液、尿液、唾液等生物樣本中分離和純化外泌體。但是,這種方法提取的外泌體可能會受到聚合物和一些蛋白質的污染,從而對后續的功能性分析產生影響。
2 基于微流控技術的分離方法
雖然傳統的外泌體分離方法比較常用,但是存在所需樣本量大、可能損傷外泌體以及回收率低等缺點。近年來,隨著微納米制造工藝的發展,微流控技術被廣泛應用于各種微粒分離及檢測過程。基于微流控技術的分離檢測具有所需樣本小、檢測速度快及檢測成本低等優點,因此一些研究人員在微流控技術的基礎上結合聲波、介電電泳、微流體黏彈性以及其他物理特性成功發展了多種新穎的外泌體分離方法。
2.1 聲流體技術分離外泌體
研究人員將微流控技術和聲學巧妙地結合形成聲流體(Acoustofluidics),可有效實現細胞等微粒的分選和操縱,其原理是不同尺寸的微粒在微流控聲場中會受到差異化大小的聲輻射力和粘滯力[17-19]。其中,粘滯力與微粒的半徑成正比,而聲輻射力與微粒的體積成正比。如圖1-A-B所示,對于尺寸較大的微粒,聲輻射力起主導作用,微粒向聲波節點移動;而尺寸較小的粒子,黏滯力抵消了大部分的聲輻射力,微粒側向運動微弱。在聲輻射力和黏滯力的綜合作用下,尺寸不同的微粒會移向不同的出口,進而實現微粒的分離。雖然聲流體技術在細胞操縱和分離中得到了廣泛的應用,但最初的聲流體器件只適合兩種目標物的分離,因此很難從成分復雜血液中分離出外泌體。針對這種不足,Wu等[20]開發了一種新型的聲流體器件,可從全血樣品中以免標記、無接觸的方式快速有效地分離出外泌體。該器件及分離過程如圖1-C所示,整體分為微細胞去除模塊和外泌體分離模塊。首先,在微細胞去除模塊中利用較低頻率(19.6 MHz)聲波去除血液中尺寸較大的紅細胞、白細胞以及血小板等;然后在外泌體分離模塊中采用較高頻率(39.4 MHz)的聲波將外泌體與細胞外囊泡亞組成分(凋亡小體、較大的細胞外囊泡等)進行分離,并在通道的指定出口對外泌體進行收集。Lee等[21]也展示了一種基于聲波納米過濾系統的細胞外囊泡分離方法,該方法是根據細胞外囊泡和其他成分存在大小和密度差異,進而可以利用超聲駐波將納米尺度的囊泡(<200 nm)從細胞培養液和紅細胞產物中分離出來。
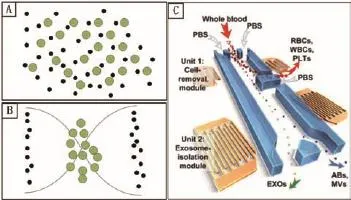
圖1 微流控技術結合聲波用于分離外泌體
基于聲流體的外泌體分離方法具有獲得的外泌體生物特性好、純度(~98%)和回收率(~82%)比較理想、所需樣本量少的優點,是一種較為新穎的分離方法。但是其分離原理是根據對象尺寸和聲阻抗特性實現的,因此不可避免地會受到血漿中與外泌體尺寸和聲阻抗特性類似成分的干擾。
2.2 介電泳技術分離外泌體
在置于溶液中的微電極上施加交流電壓,常常會在電極表面產生電滲流、介電泳和電熱流等電液動力現象,并且這些電液動力現象可以通過控制交流電壓的頻率和幅值進行靈活控制,因此被廣泛用于微流體的混合、微納顆粒的操控等應用[22-24]。其中,交流電滲適合用于低電導率溶液的操作,這是因為當溶液電導率比較高時,在電極表面形成的雙電層厚度非常小,使得交流電滲的作用減弱[25],難以實現從細胞培養液或血清中分離外泌體。介電泳(Dielectrophoretic,DEP)力是介質粒子在非均勻電場中受到極化并與電場相互作用產生的一種使極化粒子定向移動的力。由于介電泳力的大小與被操縱粒子及溶液介質的介電特性相關,并且與被操縱粒子的尺寸成比例[26],要利用介電泳在血液中實現外泌體的分離和純化,需要設計特別的電極結構。
Heineck等[27]通過比較平行導線排列和平面陣列,證實了平面陣列電極模型可以在高電導條件下不受電熱流的影響,這為從細胞培養液或血液等高電導溶液下分離外泌體提供了一種新的思路。Ibsen等[28]設計了一種基于介電泳技術的交流電動微陣列芯片,能夠快速地從未稀釋的血液樣本中分離并且回收膠質母細胞瘤的外泌體。該芯片的分離原理是根據外泌體與血漿中其他成分具有不同的介電特性,因此會受到不同的介電泳力,使得納米尺度的外泌體被吸引到微電極邊緣區域,即介電泳強場區域,而細胞及大分子蛋白質則被拉進電極之間的介電泳弱場區域,從而實現對外泌體的分離。Sonnenberg等[29]采用類似的微陣列電極方法成功從血液中分離出DNA等納米尺度物質。
采用介電泳技術分離外泌體回收率和純度高,而且所需的血漿樣本少(30-50 μL),在很短的時間內(15 min)就能富集到外泌體[28]。但是該方法一個潛在的缺點就是外泌體可能會與電極直接接觸產生電化學現象而受到損壞。可以考慮在陣列電極上鋪設一層多孔水凝膠層,避免外泌體與電極直接接觸,發生電化學效應。
2.3 利用流體動力學特性分離外泌體
在黏彈性微流體中,作用在粒子上的黏彈性力可使其產生移動[30],并且黏彈性力的大小及其產生的位移與粒子的大小有關,因此微流體的黏彈性力可以作為一種簡單的、無標記的技術用于粒子的操縱和分離。黏彈性微流體的黏彈性力被廣泛用于腫瘤細胞、血細胞、細菌、液滴和微球體等微納物體的操縱和分離[30-33]。相對于聲流體、介電泳及磁性等其他技術方法,利用微流體黏彈性的分離方法可以在不施加額外的場力的條件下對微粒進行精確操縱。盡管微流體黏彈性分離法有諸多優點,但其并不能在納米粒子上產生足夠大的黏彈性力。針對一般黏彈性微流體不能直接分離外泌體的局限,Liu等[34]提出了利用聚氧化乙烯聚合物(Polyoxyethylene,PEO)作為介質添加劑來改變流體的黏彈性。聚合物PEO可以增加微流體黏彈性的大小,從而增加作用在外泌體上的黏彈性力。如圖2-A-B所示,在分離過程中,控制入口和鞘流的流速使樣本最開始在微通道的兩側,尺寸較大的細胞外囊泡受到較大的黏彈性力移向通道中央,較小的外泌體受到的黏彈性力有限,位移較小,從而使外泌體和較大的細胞外囊泡移向不同的出口。
利用流體動力學的特性,Wunsch等[35]設計了一種基于橫向位移的外泌體分離方法,如圖2-C。這種方法是通過光刻技術在微通道內制造陣列納米柱來控制不同尺寸微粒的運動軌跡,其中陣列納米微柱間隙為25-235 nm,最大角度為θmax= 5.7°。在該設計中,低于臨界尺寸的微粒隨著層流的流動沿“Z”字型前進,而大于臨界尺寸的微粒則以陣列納米柱設定的路徑前進。通過優化陣列納米柱的參數,就可以控制微粒的運動軌跡,實現外泌體的分離。
相對于其他微流控方法,利用微流體的流動特性的分離方法不需要施加額外的場力,分離方便,且對外泌體的損害小,為微量樣本的外泌體分離和定量分析提供了新的思路。
2.4 其他微流控方法
不論是基于離心過濾的傳統方法,還是近年來新興的微流控分離方法均未在純度、回收率、生物活性等方面達到完全理想的分離效果。如今,研究人員越來越重視集成多種分離原理和方法,以期實現更好的分離效果。Davies等[36]結合微流體和過濾兩種方法,將納米多孔膜整合到微流控芯片上,形成微流控過濾系統。相對于常規的過濾方法,這種裝置可以通過改變致孔溶劑與預聚物溶液的比例控制納米孔的尺寸,使其適合于外泌體的提取和分離。并且此方法采用電泳驅動過濾,消除了一些可溶性蛋白的干擾,從而提高了純度。另外,Yasui[37]設計了一種基于納米線的微流控芯片用于收集尿液中的外泌體。該芯片將帶正電的納米線固定在微流控通道的基底上,實現很高的收集效率。與超速離心法相比,該方法檢測樣本小、樣本處理時間短,且提取的miRNA的種類更多。該芯片為基于尿液樣本的疾病早期診斷提供了一種新的策略。
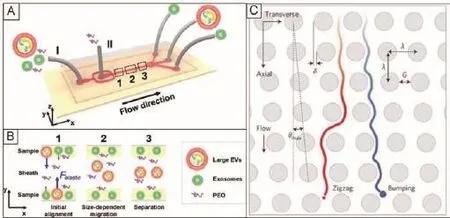
圖2 利用流體動力學特性分離外泌體
基于免疫的方法一直是外泌體分離的一個重要分支,He等[38]開發了一種新的微流控方法,將磁珠集成在微流控芯片上,可以對外泌體進行特異性免疫分離和靶向蛋白分析。該免疫磁珠結合微流控技術的方法不僅可以富集捕獲到外泌體,而且可以方便地制備透射電鏡表征樣品,從而提高捕獲效率以及分析的靈敏度。
除了上述的外泌體分離方法,也有一些針對特定應用和特殊需求發展而來的分離方法。如Chiu等[39]為了實現單細胞的外泌體的實時檢測,提出了一種單細胞外泌體測定法。該方法設計并制造了一種帶網孔的PDMS基底,并在離心力作用下使每個網孔能夠裝載單個細胞并培養,然后利用固定有CD-63抗體的蓋玻片對應收集每個網孔內細胞分泌的外泌體。該方法可以在體外環境下定量分析單細胞分泌外泌體的數量,并研究藥物和酸性環境對外泌體分泌量和蛋白質表達的影響。
3 總結
盡管近年來外泌體的分離研究取得了長足的進展,但是每種方法都有其優點和不足。表1對幾種典型的外泌體分離方法在回收率、純度以及優缺點等方面進行了總結和對比。
基于離心和過濾的方法仍是最常用和有效的方法,一次性可以獲得大量的外泌體,但不適用于微量以及珍貴樣本。通過離心方法提取的外泌體純度、回收率以及生物活性都會受到離心力、離心時間等一些因素的影響,而且分離前需要復雜的準備工作,耗費時間長(2-6 h)[40-42]。多步過濾的方法在前期準備上仍然需要離心處理,步驟繁瑣,而且需要大量的樣本(30-100 mL),產率反而很低。免疫磁珠分離法的分離效果嚴重依賴于特異性抗體,成本高,且只能分離獲得與抗體親和的外泌體,造成某些種類的外泌體丟失。
近年來,微流控技術在外泌體分離中得到廣泛的應用。基于微流控技術的分離方法具有分離速率較快,分離產率和純度較高,對樣本需求量較少的優點,與上述傳統方法相比更適用于微量樣品分析,有望被廣泛應用于未來個人醫療和精準治療中。然而,當前基于微流控的外泌體分離方法仍處于實驗研究階段,還需要進一步發展研究。
隨著外泌體分離方法和技術的發展,外泌體在細胞通信、疾病發生等重要生命活動中的作用及機制會進一步得到揭示,促進疾病檢測及相關治療方法的發展。
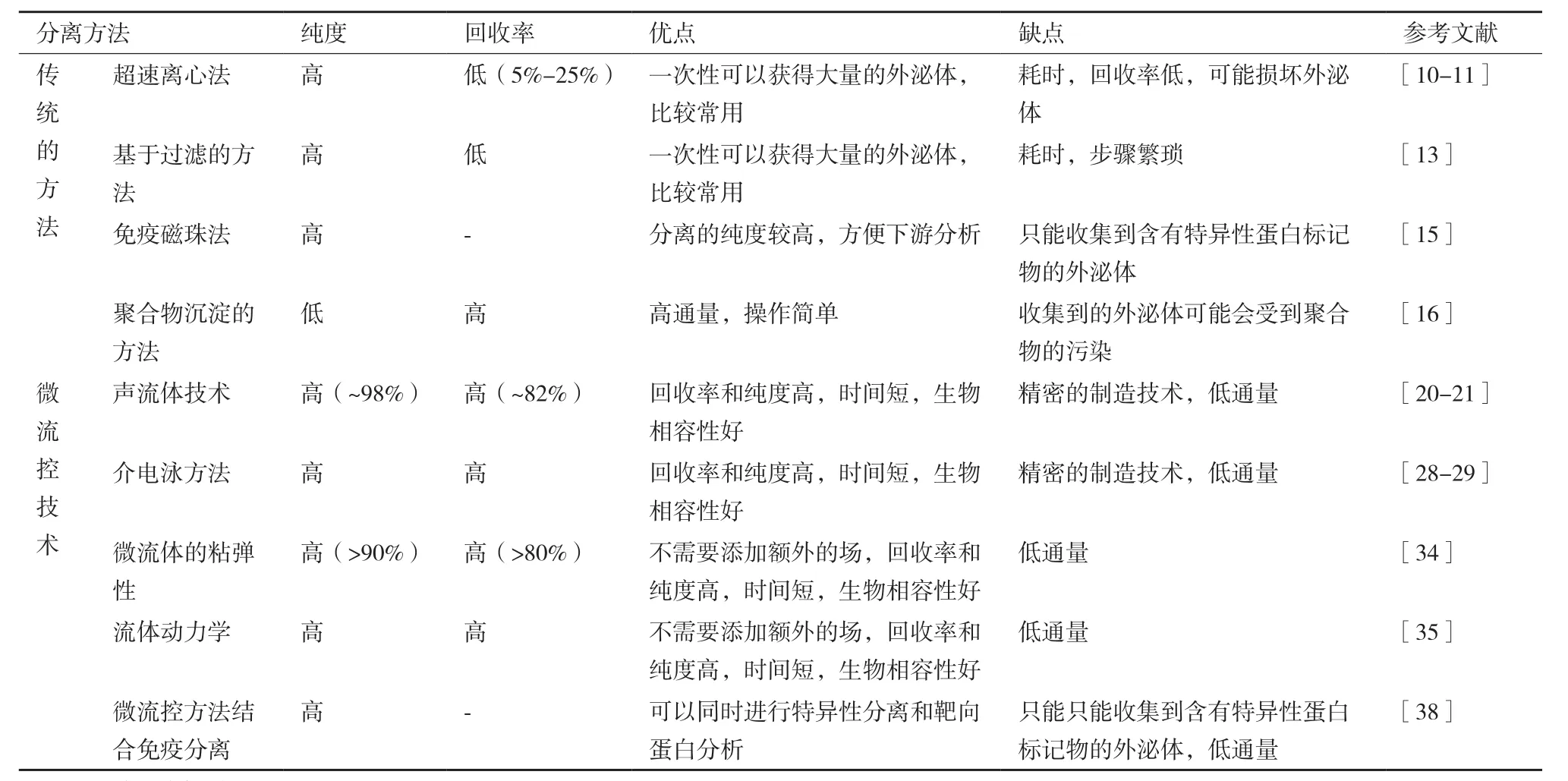
表1 外泌體分離方法的比較

