一種耐鈾植物促生菌的篩選及促生特性研究
王焯 羅學剛 丁翰林 楊昊
(西南科技大學生命科學與工程學院,綿陽 621010)
目前世界上對放射性污染治理采取的主要方法包括物理、化學和生物修復。生物修復以其成本低廉、不產生二次污染而受到許多學者的關注。生物修復主要包括動物修復、植物修復和微生物修復。其中植物修復技術對環境干擾小、操作簡便、綠色、原位且易于為公眾接受等優點,成為當前環境科學和污染生態學等領域的研究熱點[1-3]。但單純通過植物修復技術來促進對放射性核素的吸附富集,雖然從理論上分析可以有效治理鈾污染。但是在放射性污染環境中植物生長緩慢,效果不明顯且周期長。目前多數對放射性核素具有超富集的植物基本都存在生物量較低,生長緩慢,適應非原產地土壤環境較差等問題[4],所以增加植物的生物量、提高植物對新環境的抗性或者適應性成為植物修復放射性污染土壤技術中的關鍵。
植物根際促生菌(Plant growth promoting rhizobacteria,PGPR)在重金屬污染的條件下,通過分泌鐵載體、有機酸、表面活性劑、固氮酶、1-氨基環丙烷-1-羧酸脫氨酶(1-aminocyclopropane-1-carboxylate de-aminase,ACC)、植物生長激素:3-吲哚乙酸(Indole-3-acetic acid,IAA)等物質,可以改善植物生長發育境況,促進植物成長,增強重金屬脅迫條件下的植物生物量,提高植物修復的效率[5]。陳可等[6]利用熒光假單胞菌、綠針假單胞菌橙色亞種能明顯促進博落回抗干旱能力和對鈾的富集量。何琳燕等[7]從鎘超積累植物龍葵體內和根際土壤中分離篩選到能夠產生IAA的細菌,能夠明顯增加油菜幼苗根的長度。李艷梅等[8]從花生根際得到5株耐鎳產鐵載體芽孢桿菌,其中 HSGJ1能有效促進花生生長,增加生物量。Dell’ Amico等[9]從重金屬污染的禾本科牧草中得到的根際促生菌,大部分都表現出 ACC 脫氨酶活性,且都能增加植物生長。但目前利用放射性污染地區的植物內生菌促進植物對鈾的富集研究還相對較少。因此,本文擬以某典型鈾尾礦采集的蓼科植物酸模為材料,通過鈾耐受實驗以及定性定量分析各菌株的植物促生性能,以期分離出對鈾具有耐受性的植物促生菌,并該菌株接種到苜蓿根部,提高苜蓿的鈾積累量和生物量,為鈾尾礦污染土壤的植物修復提供一定的參考。
1 材料與方法
1.1 材料
1.1.1 植物樣品 供試的酸模植株于2017年10月采自某鈾尾礦區和附近地區,將取樣植株和根系附近土壤整體裝入樣品袋,帶回實驗室進行進一步處理。1.1.2 培養基 牛肉膏蛋白胨培養基(LB培養基):牛肉膏10. 0 g,蛋白胨10. 0 g,氯化鈉 5. 0 g,蒸餾水1 000 mL,調整pH值至7.0±0.2,于120℃滅菌15 min。鈾篩選培養基:在LB培養基加入5 g/L的乙酸雙氧鈾,使培養基中鈾濃度為100 mg/L。King’s培養基:10 mL丙三醇,蛋白胨 20.0 g,磷酸氫二鉀1.5 g,硫酸鎂1.5 g,蒸餾水1 000 mL,調整pH值至7.2±0.2,于121℃滅菌15 min。Dworkin and Foster 培養基(DF 培養基):磷酸氫二鈉 6.0 g,磷酸二氫鉀 4.0 g,硫酸鎂 0.2 g,葡萄糖 2.0 g,葡萄糖酸 2.0 g,檸檬酸 2.0 g,三氧化鉬 10.0 mg,硼酸10.0 mg,硫酸錳 11.2 mg,硫酸銅 78.2 mg,硫酸鋅124.6 mg,硫酸亞鐵100.0 mg,蒸餾水1 000 mL,調整pH值至7.0±0.2,于120℃滅菌15 min。ACC篩選培養基:將DF培養基中的硫酸銨替換成ACC。

表1 試驗土壤的理化性質
1.2 方法
1.2.1 酸模根部耐鈾內生菌的分離篩選 將從鈾礦區采集的的酸模樣品用自來水清洗干凈后,用去離子水漂洗3次。取樣品健康完整的根部,置于75%的酒精中消毒5 min,在于0.2%的次氯酸鈉溶液中消毒10 min,完成后用去離子水沖洗5遍,同時取最后一遍的去離子水100 μL,涂布于 LB 固體培養基,以檢測樣品表面消毒是否徹底。將完成消毒的根系樣品放入無菌研缽中,加入適量已消毒的石英砂,加入5 mL經過過濾除菌的PBS緩沖液,進行研磨。取不同稀釋倍數的研磨液100 μL涂布于鈾篩選固體培養基中,在30℃下,培養3 d。
1.2.2 內生促生菌篩選 采用Salkowski比色法測定菌株產IAA能力[10]。采用李振東[11]的方法制作比色液和標準曲線。將待測菌株接種到含有100 mg/L色氨酸的LB培養基中,以不含色氨酸的培養基為對照,在30℃,150 r/min的條件下培養24 h。取6 mL發酵液在10 000 r/min條件下,離心10 min。取上清液1 mL加入試管中,同時加入1 mL比色液,15 min觀察顏色變化。將溶液變紅色菌株保留,在取剩下的5 mL上清液,加入5 mL比色液,黑暗下靜止30 min,立即用紫外分光光度計測定OD530值。代入標準曲線,計算IAA含量。每組實驗重復3次。
上述產IAA菌株的ACC脫氨能力。參照張國壯[12]的方法,將待測菌株接種到LB培養基中,25℃,150 r/min下,培養24 h。取1 mL培養液,接種到DF培養基中,25℃,150 r/min下,培養24 h。取前一步的培養液1 mL,接種到ADF培養液中,25℃,150 r/min下,培養24 h。取最后一步的培養液100 μL接種到ADF固體培養基中,25℃培養3 d,觀察生長情況。將長勢良好的菌株保留,再次接種到含8 mL含3 mmol/L的ADF液體培養基中,25℃,150 r/min下,培養24 h。將培養液在4℃、8 000 r/min下,離心10 min,收集菌體,加入5 mL 0.1 mol/L pH 7.6的Tris-HCl緩沖液,懸浮菌體。在4℃、8 000 r/min下,離心10 min,收集菌體,重復該步驟3次以除去培養基。向第三次離心得到的菌體中加入1 mL 0.1 mol/L pH=7.6的Tris-HCl緩沖液,混懸后,然后轉移至2 mL離心管中,16 000 r/min下離心5 min。之后將菌體沉淀再次懸浮于0.6 mL 0.1 mol/L pH8.5的Tris-HCl緩沖液中,加入30 μL甲苯,漩渦振蕩30 s以破碎菌體。吸取0.2 mL破碎細胞菌懸液,加入20 μL 0.5 mol/L ACC溶液,混勻后于30℃條件下水浴15 min。然后向其中加入1 mL 0.56 mol/L HCl混勻,室溫下16 000 r/min離心5 min。取上述離心上清液1 mL,加入0.8 mL 0.56 mol/L HCl,混勻后再加入0.3 mL 2 g/L的2,4一二硝基苯肼,30℃下水浴30 min。然后,加入2 mL 2 mol/L NaOH顯色,測定540 nm下測定其吸光值OD540,以蒸餾水代替菌懸液的處理作為對照。將樣品的OD540。代入標準曲線得到其中α-丁酮酸的含量,計算每分鐘ACC脫氨酶催化ACC生成α-丁酮酸的物質的量,即單位酶活力U。利用考馬斯亮藍法以牛血清蛋白為對照,測定剩余的菌株懸浮液中蛋白質含量(μg)。用單位酶活力除以總蛋白質量即為比活力(U/μg),以此表示細菌的ACC脫氨酶活性。
1.2.3 內生菌重金屬抗性實驗 分別挑選1.2.1實驗中的外觀形態有差異的單菌落接種于LB液體培養基中擴繁24 h,吸取100 μL擴繁培養液接種到含有不同濃度的重金屬LB液體培養基中,在30℃,150 r/min條件下培養5 d。同時通過測定培養基OD600值確定菌落生長情況,以此得到每株菌株的耐受最低重金屬濃度即最小抑制濃度(MIC)。其中,鈾質量濃度為100、150、200、250、300、350 mg/L,鉛質量濃度為200、400、600、800、1 000、1 200 mg/L,錳質量濃度為400、600、800、1 000、1 200、1 400 mg/L,鎳質量濃度為25、50、75、100、125、150 mg/L。
1.2.4 內生菌的生理生化及分子鑒定 依據《常見細菌系統鑒定手冊》,對所篩得的菌株D16進行初步生理生化試驗[13]。目的菌株在 LB 固體培養基上生長,肉眼觀察菌落在培養基上的培養特征。對菌體用革蘭氏染色后,在光學顯微鏡下觀察其形態。
菌株的DNA 提取參照楊圣[14]的方法。以總DNA 為模板,采用通用引物pA(50-AGAGTTTGATCCTGGCTCAG)和pC5B(50-TACCTTGTTACGACTT)PCR擴增菌株的16S rDNA序列提取DNA。測序由成都戴維賽特生物科技有限公司完成。測序后在NCBI 數據庫用 Blast 軟件進行序列比對,隨后用MEGA 7. 0軟件、鄰位連接法構建系統發育進化樹,并進行 1 000 次的相似度重復計算。
1.2.5 內生菌促生特性研究 研究上述篩選的菌株在不同條件下的IAA產量和ACC酶活性。將菌種接種到設置的不同條件的液體培養基中,在150 r/min下,培養24 h,分別測定IAA含量和ACC脫氨酶活性。其中,研究pH、溫度、轉速產IAA培養基選用LB培養基,條件設置為:pH為4、5、6、7、8;溫度為20、25、30、35、40℃;轉速為 90、120、150、180、210 r/min。研究氮源、碳源產IAA培養基選用King’s培養基,條件設置為:碳源為甘油,葡萄糖,蔗糖,木糖,麥芽糖;氮源為硫酸銨,硝酸鉀,尿素,蛋白胨,酵母粉。轉速為90、120、150、180、210 r/min。ACC脫氨酶選用ADF培養基,條件設置為pH為4、5、6、7、8;溫度為20、25、30、35、40℃ ;ACC 底物濃度為 0.5、5、50、500 μL。
1.2.1 檢查前護理工作 護理人員需要為患者提供良好的護理環境,并且要確保檢查設備的完善程度,具體需要將患者檢查環境溫度控制在20~24℃,將濕度控制在50%~60%,并且要定期對檢查科室進行清潔和消毒工作,以此來預防院內感染現象。此外,護理人員需要結合患者的病情和心理承受能力,對患者進行適當的安慰和開導,并向患者講述基本的檢查流程,提高患者對胃鏡檢查工作的了解程度。
1.2.6 苜蓿促生菌盆栽實驗 盆栽實驗,每盆裝土1 kg。設置鈾濃度分別為 25、50、75、100 mg/kg。苜蓿種子經表面滅菌,催芽后種植入含鈾土壤中,每盆種植10顆。接菌處理,將所篩菌株接種到King’s培養基中,以所得的最佳條件培養24 h。將所得培養液4℃,8 000 r/min離心,棄去上清液,用無菌水沖洗3次,調整OD600值為1,每盆均勻噴灑50 mL,每15天添加1次。以不加菌液為對照,噴灑等量的無菌水。每個處理設置3個重復。60 d后收獲植物,將植物120℃殺青0.5 h,80℃烘至橫重。1.2.7 數據處理 參考蘇峰丙[15]的方法測定植株的鈾含量以及植株鈾積累量,植株鈾積累量=植株鈾含量×植株干重。利用 DPS 7.5 進行數據分析;Origin Pro 8. 5 軟件作圖。
2 結果
2.1 耐鈾內生菌的分離篩選
經過分離純化,從鈾尾礦區酸模根部分離出細菌32株,其中有11株在100 mg/L的鈾篩選平板上長勢良好。分別為D1、D4、D5、D6、D11、D13、D15、D16、D18、D26、D29。
2.2 待測菌株促生潛力研究
如圖1所示,D5、D16和D26具有產IAA能力和ACC脫氨酶活性,D5菌株24 h產IAA含量為58.6 mg/L,ACC 脫氨酶活性為 0.14(U/μg)。D16 菌株24 h產IAA含量為40.21 mg/L,ACC脫氨酶活性為 0.32(U/μg)。D26菌株 24 h產 IAA 含量為 18.3 mg/L,ACC脫氨酶活性為0.34(U/μg)。由于這3種菌株的IAA產量和ACC脫氨酶活性都相對較高,因此選用D5、D16、D26進行下一步實驗。
2.3 內生促生菌鈾及伴生重金屬抗性實驗
如表2所示,D5菌株對鈾、錳、鉛、鎳4種重金屬的最小抑制濃度為300、1 200、1 000、75 mg/kg;D16菌株對鈾、錳、鉛、鎳4種重金屬的最小抑制濃度為350、1 200、800、125 mg/kg;D26菌株對鈾、錳、鉛、鎳4種重金屬的最小抑制濃度為300、1 400、1 200、100 mg/kg。D16對鈾、鎳有較強的耐受能力。D26對錳和鉛具有較強的耐受能力。
2.4 D16的生理生化及分子鑒定

圖1 耐鈾菌株的植物促生特性

表2 待測菌株的最小重金屬抑制濃度
因為D16菌株具有較強的鈾耐受性(表2),且具有較好的植物促生性能(圖1)。因此,將其選為目標菌株。依據細菌分類手冊對其進行了生理生化鑒定實驗(表3),革蘭氏檢測結果為陰性。對D16的基因組 DNA 進行 PCR反應得到1 649 bp 大小的擴增片段,擴增后的 DNA片段經過純化測序,并在 Gen Bank 中與相似性較高的菌株進行比對,發現D16與木糖氧化無色桿菌相似度最高,相似度為99%。進一步構建系統發育樹(圖2),證實該菌株與木糖氧化無色桿菌親緣關系最近。
2.5 D16促生特性研究
2.5.1 溫度對D16菌株的生長和產IAA的影響 由圖3-A所示,在20-35℃范圍內,D16菌株的生長量隨溫度升高而增加,在35℃時達到最大值,OD600值為2.54。35℃后,生長量開始降低,到40℃時OD600值為1.93。IAA的產量隨生長量的改變而改變,因此,在20-35℃時,IAA產量逐步增加,在35℃時,達到最大值,最大IAA產量為42.12 mg/L。35℃后,IAA產量開始降低,到40℃時,IAA產量為23.72 mg/L。
2.5.2 不同轉速基對D16菌株的生長和產IAA的影響 如圖3-B所示,轉速在90-180 r/min時,D16菌株的生長量隨轉速提高而逐漸增加,OD600分別為2.69、2.72、2.75、2.78,當轉速高于180 r/min后,菌株生長量開始下降,當轉速為210 r/min時OD600為2.55,由此可知,轉速對D16的生長量影響較小。但在90-150 r/min范圍內,IAA產量隨轉速增加而快速增加,分別為28.94、31.55、38.98 mg/L,且在150 r/min,達到最大值。當轉速大于150 r/min時,IAA產量先下降后上升,在180、210 r/min時分別為 37.16、40.91 mg/L。

表3 D16菌株的生理生化鑒定

圖2 基于16s rDNA序列構建的系統發育進化樹
2.5.3 pH對D16菌株的生長和產IAA的影響 如圖3-C所示,pH 為 4 和 8 時,D16菌株生長受到抑制,IAA產量下降。pH8時,菌株受到的抑制作用最大OD600值為2.02,IAA產量最少為17.82 mg/L。pH在 5-7時,菌株生長量逐漸增加,且在pH6時達到最大值OD600為2.46。在pH為4-6這段范圍內IAA 分泌量緩慢增加。當pH在6-7時,IAA 的增長速率隨著 pH 的增大迅速變大并于pH7時達到最大,最大產量為34.84 mg/L。
2.5.4 氮源對D16菌株的生長和產IAA的影響 從4-A可以看出,5種氮源對D16菌株生長影響的順序為:酵母膏>蛋白胨>尿素>硫酸銨>硝酸鉀,當氮源為酵母膏時,菌體生長量最大,OD600為2.41;對菌株分泌 IAA 的影響順序為:酵母膏>蛋白胨>尿素>硫酸銨>硝酸鉀,當氮源為酵母膏時,菌株產IAA的活性最強,IAA產量為37.82 mg/L。
2.5.5 碳源對D16菌株的生長和產IAA的影響 由圖4-B所示,5種碳源對D16菌株生長影響的順序為:甘油>蔗糖>葡萄糖>蔗糖>木糖>麥芽糖,當碳源為甘油時,菌體生長量最大,OD600為0.97。對菌株分泌IAA的影響順序為:甘油>蔗糖>葡萄糖>木糖>麥芽糖。當甘油為碳源時,菌株產IAA的活性最強,IAA產量為10.76 mg/L。
2.5.6 底物濃度對D16菌株產ACC脫氨酶的影響 如圖5所示,菌株D16的脫氨酶活性隨著底物濃度的增加而上升。在底物濃度為0時,脫氨酶活性幾乎檢測不到。
2.5.7 pH對D16菌株產ACC脫氨酶的影響 如圖6-A所示,當培養基pH小于5時,D16菌株無法誘導產生ACC脫氨酶;當pH大于7時,酶活開始受到抑制;pH7時,酶活最大為0.312 6 U/μg。

圖3 不同培養條件對D16菌株的生長和IAA產量的影響
2.5.8 溫度對D16菌株產ACC脫氨酶的影響 如圖6-B,當溫度在20-30℃時,D16菌株ACC脫氨酶活性隨溫度升高而升高。在30℃時,酶活達到最大值為0.317 9 U/μg。當溫度高于30℃,酶活顯著下降,在40℃時,檢測不到酶活。

圖4 不同氮源、碳源對D16菌株的生長和IAA產量的影響
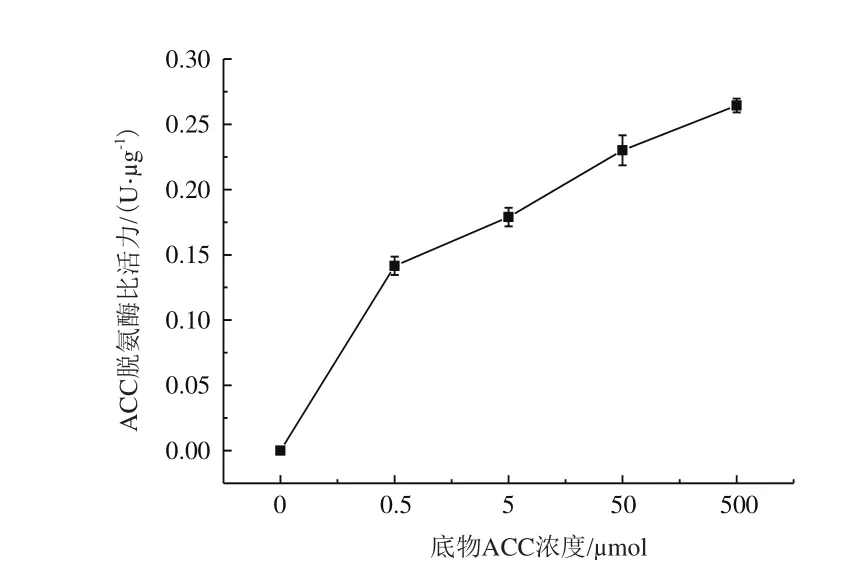
圖5 底物濃度對D16菌株產ACC脫氨酶的影響
2.5.9 轉速對D16菌株產ACC脫氨酶的影響 如圖6-C,轉速對D16脫氨酶的活性影響不大。當轉速在90-180 r/min時,D16菌株的ACC脫氨酶活性隨轉速提高而緩慢增加,分別為0.311 0、0.325 1、0.325 2、0.343 8 U/μg,當轉速高于180 r/min后,酶活開始緩慢下降,當轉速為210 r/min時,酶活為0.3148 U/μg。2.5.10 D16菌株對苜蓿生長與鈾積累的影響研究 由圖7可知,在接種D16菌株后,能提高苜蓿的生物量。其中,在沒有鈾脅迫的情況下,能提高干重160%;在25 mg/kg的鈾脅迫下,能提高67.5%的干重;在50 mg/kg的鈾脅迫下,能提高29.5%的干重;在75 mg/kg的鈾脅迫下,能提高17.9%的干重;在100 mg/kg的鈾脅迫下,能提高110.4%的干重。
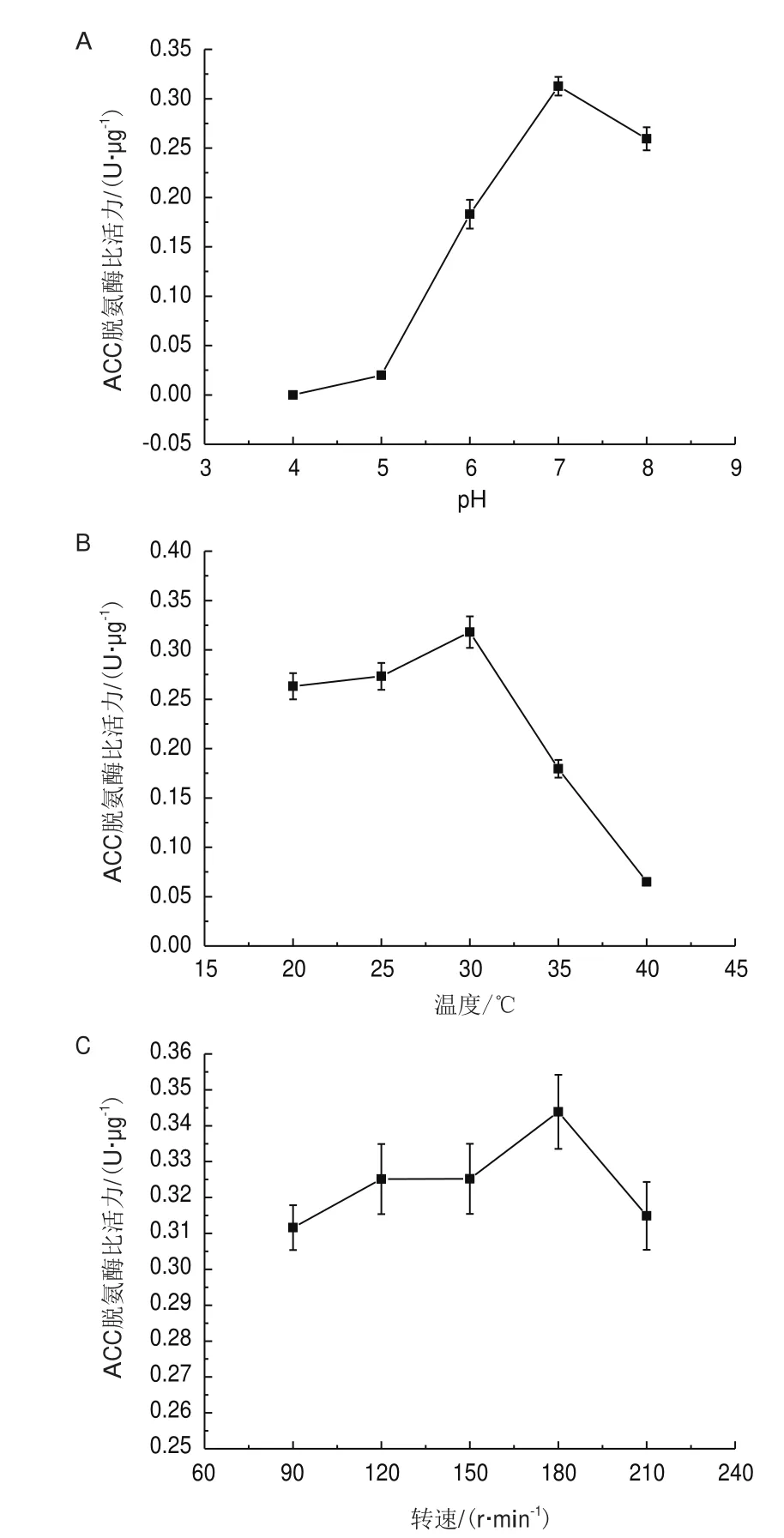
圖6 不同培養條件對D16菌株的ACC脫氫酶的影響
由圖8可知,接種菌株D16后,苜蓿中鈾的含量和積累量也有所提高。在25 mg/kg的鈾脅迫下,能提高12.2%的鈾植株含量,鈾的積累量卻沒有提高;在50 mg/kg的鈾脅迫下,能提高45.5%的鈾植株含量和11.8%的鈾植株積累量;在75 mg/kg的鈾脅迫下,能提高36.3%的鈾植株含量和88.8%的鈾植株積累量;在100 mg/kg的鈾脅迫下,能提高180.6%的鈾植株含量和78.6%的鈾植株積累量。
3 討論
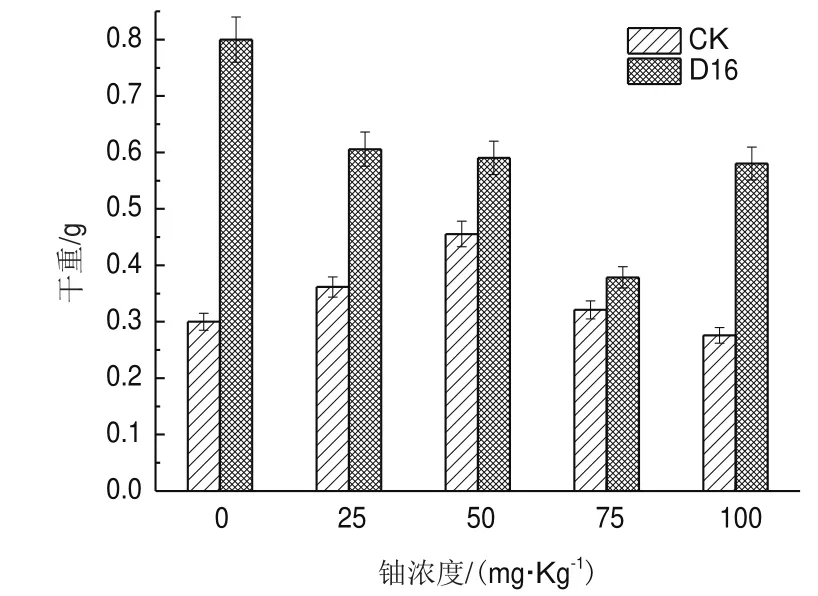
圖7 不同鈾濃度處理下D16對苜蓿生物量的影響

圖8 不同鈾濃度處理下D16對苜蓿富集鈾的影響
在植物修復放射性和重金屬污染中,植物促生菌的加入是一個較佳的方法,它能促進植物生長同時減輕放射性核素及重金屬對植物的脅迫作用[16]。Ying等[17]從銅礦區土壤篩選的一株氧化木糖無色桿菌對銅的最小抑制濃度能達到600 mg/L,重金屬污染地區的植物內生菌通常表現出較高的重金屬耐受能力[18]。本研究從某典型鈾尾礦區的蓼科植物酸模根部分離篩選出耐受一定濃度鈾的菌株D16,對鈾的最小抑制濃度能達到350 mg/kg,經鑒定為氧化木糖無色桿菌種。這說明該種菌株具有較強的重金屬耐受力。
植物促生菌所分泌的IAA是一種重要的植物激素,參與整個植物的生長發育過程,能促進植物生長,增加植物根系對礦質元素的吸收[19]。潘風山[20]從鎘超積累植物東南景天根部分離出一株產IAA的細菌,可使油菜地上部分的生物量提高 18.6%,同時對鎘的積累量提高45%。在重金屬、干旱等逆境條件下,乙烯會在植物體內過量產生,抑制植物根系的生長,阻礙植物體正常的生長發育[21]。植物促生菌產生的1-氨基環丙烷-1-羧酸(ACC)脫氨酶能將ACC 分解成 α-丁酮酸(α-ketobutyrate)和氨,這種物質是合成乙烯的前體物質。從而降低植物體內乙烯的水平,同時氨能作為植物所需氮源被利用,從而緩重金屬給植物生長發育帶來的不良壓力,提高植物對重金屬離子的吸收[22]。吉云秀[23]從被石油污染的鹽漬地區的植物翅堿蓬的根際土中分離出4種含有ACC脫氨酶的植物促生菌,且均能提高燕麥或者黑麥草的耐鹽性和生長參數。現有的研究表明,如果菌株具有一種促生性能,便具有促進植物生長的潛力[24]。本研究所篩菌株D16所表現的植物促生特征包括產生IAA和具有ACC脫氨酶,可能有更好的促生效果。
在誘導IAA培養基中,當pH為7時,菌株D16的IAA產量最大,這與徐文思[25]等篩選的菌株的產IAA的最適 pH 為8的結果不同,其原因應該是由于篩選出的菌株種屬不同。D16菌株隨轉速增加生長量緩慢增加,而IAA產量迅速增加,可能是由于菌株的生長和IAA產生均是好氧過程,菌株優先保證生長繁殖,再產生次生代謝產物。當以酵母膏和蛋白胨為氮源時,菌株D16的生長量和IAA的產量都為最高,說明有機氮源對菌株D16優于無機氮源。
當培養基中無ACC時,菌株檢測不到ACC脫氨酶活性,而隨著ACC濃度升高,酶活性增強,這與蒙淵[26]的結果相一致,這說明ACC脫氨酶為誘導酶。菌株D16所產ACC脫氨酶活性在pH為7時,有較高酶活,而當pH小于7時酶活迅速下降,pH大于7時酶活降低緩慢,這與沈萍[27]的結果相似,說明ACC脫氨酶不耐酸,而對偏堿性條件有一定的適應力。
將植物內生菌用于提高植物修復土壤重金屬效率已有較多研究,從商陸中篩選出的一種芽孢桿菌SLS18,不僅能促進甜高粱生長,還能提高對 Mn /Cd的吸收[28]。Zhang等[29]研究發現一株鞘氨醇單胞菌不僅可以增加東南景天生長,同時能提升東南景天對 Cd 的吸收。促生菌促進植物修復鈾污染的研究相對較少,Muhammad[30]的研究表明,利用從牧豆樹枝分離的3種促生菌可以促進雙稃草的生長和對鈾和鎘的積累。紫花苜蓿(Medicago sativa)是多年生的豆科草本植物,具有很強的環境適應力。Peralta-Videa等[31]的研究表明,紫花苜蓿對土壤中的Cd、Cu 或 Zn 具有較強的富集能力,是一種很有開發和利用價值的土壤修復植物。唐永金[32]和金星等[33]研究表明,紫花苜蓿能夠很好的吸收和富集土壤中的鈾。本研究從鈾尾礦區植物酸模根部分離出一株耐鈾內生菌,結果表明該菌株可以促進苜蓿生長,同時還能提高苜蓿對鈾的積累能力,這對于植物修復鈾尾礦區的污染土壤具有十分重要的作用和意義。
4 結論
從某典型鈾尾礦區植物酸模根部分離到的一株耐鈾菌株具有較強的IAA產率和ACC脫氨酶活性,經過生理生化及分子鑒定表明該菌株屬于無色木糖氧化桿菌。該菌株最佳產IAA條件為35℃,pH為7,轉速為150 r/min,氮源為酵母膏,碳源為甘油;最佳ACC酶活條件為溫度為30℃,pH為7,轉速180 r/min。該菌株植物促生特性能使苜蓿干重分別提高17.9%-110.4%;植株對鈾的富集率分別提高12.2%-180.6%。

