橄欖苦苷與Aβ1-42的親和效應及對Aβ1-42誘導的Neuro-2a細胞凋亡的保護作用
胡光強, 余 錄, 杜 曦, 高小青, 秦大蓮, 余崇林
阿爾茨海默病(Alzheimer’s disease,AD)是一種以記憶認知功能障礙為主的漸進性神經退行性疾病。流行病學調查研究顯示,到2050年,用于AD預防和治療的年消費將高達1.89萬億美元,給社會帶來巨大的經濟負擔[1]。AD有兩大病理特征,一是細胞外Aβ的異常聚集形成具有神經毒性的老年斑;另一個是細胞內tau蛋白的過度磷酸化形成神經纖維纏結,加速AD進程。其中,Aβ病理級聯假說是AD形成和發展的主軸,因此,尋找特異性與Aβ結合的藥物并探索其機制是治療AD的良好策略。
油橄欖是一種木犀科、齊墩果屬常綠喬木,廣泛種植于我國甘肅和四川。油橄欖果的食用和藥用價值極高,并已被熟知和應用。然而,橄欖葉的開發價值卻長期被忽視。橄欖葉中有一種主要的酚類化合物,即橄欖苦苷(Oleuropein,OE),其含量豐富且易于分離和純化[2]。橄欖苦苷有多種藥理作用,包括抗癌、抗氧化、增強免疫等[3~5],并且在神經系統的作用也逐漸被關注。我們的前期研究也證明,橄欖苦苷能保護腦缺血再灌注損傷[6]。為證實橄欖苦苷在AD作用的可能效應,我們首先檢測了橄欖苦苷對Aβ1-42纖維的抑制能力和親和效應,并進一步探討了其對Aβ1-42誘導的Neuro-2a細胞凋亡的保護作用。
1 材料和方法
1.1 材料 Neuro-2a細胞系(CCL-131,American cell type culture collection),橄欖苦苷(HPLC 98%),購自成都曼思特生物科技有限公司(批號:MUST-14092511)。噻唑藍(MTT)、十二烷基硫酸鈉(SDS)、硫生物素代磺色素(Th-T),購自美國Sigma公司。Aβ1-42多肽購自蘇州強耀生物科技有限公司。 生物素(Thermo Scientific,美國),SPR生物傳感器(Pall Fortebio,美國)。 細胞凋亡檢測試劑盒(北京四正柏生物科技有限公司)。酶標儀(美國biotek公司),流式細胞儀(美國BD FACS verse公司)生物分子相互作用儀(Pall Fortebio,美國),奧林巴斯倒置顯微鏡(Olympus,日本)。
1.2 方 法
1.2.1 Aβ1-42纖維的制備 取1 mg Aβ1-42多肽粉末,用400 μl的六氟異丙醇(HFIP)將其溶解,超聲至溶液澄清,再均勻分裝至4個1.5 ml離心管,用氮氣溫和吹干,然后得到無色透明的Aβ肽膜,附著于管壁內側,置于-80 ℃冰箱保存備用,需要時溶解。
1.2.2 Th-T熒光檢測 Th-T是一種熒光染料,能與淀粉樣纖維的β片層結構特異性結合,因此成為測定Aβ纖維的經典方法。Th-T用PBS溶解為20 μmol/L避光備用。Aβ1-42肽膜用含2%DMSO的PBS溶解,加入適量的橄欖苦苷,Aβ1-42終濃度為20 μmol/L,橄欖苦苷的終濃度分別為12.5 μmol/L、25 μmol/L、50 μmol/L,總體積為100 μl,置于37 ℃培養箱中連續孵育5 d。不加Aβ1-42和橄欖苦苷的溶液作為空白對照組,模型組不加入橄欖苦苷。在孵育的第5天,取10 μl該溶液,加入Th-T溶液190 μl,在波長440 nm~490 nm處檢測其熒光值。
1.2.3 Aβ1-42的生物素化及固化 用DMSO將生物素溶解至10 mmol/L,取孵育后的200 μl的Aβ1-42 (100 μg),按1∶0.5的摩爾比混合,室溫靜置反應30 min,使其實現生物素化。將200 μl生物素化的Aβ1-42轉移至黑色不透明的96孔板,然后把預濕的生物傳感器插入溶液中,生物素化的蛋白固化于傳感片,通過生物分子相互作用儀檢測Aβ1-42生物素化的成功與否,標記成功的Aβ1-42傳感器用于后續藥物親和力的檢測。
1.2.4 橄欖苦苷與Aβ1-42的親和力測定 將橄欖苦苷用PBS溶解成400 μmol/L,加入200 μl至96孔黑板,等比梯度稀釋成200 μmol/L、100 μmol/L至25 μmol/L 6個濃度,對照組加入等量的PBS。將建立成功的Aβ1-42傳感器插入另一含PBS的96孔板,預濕10 min。將兩板放入生物分子相互作用儀,設置洗脫、基線、親合、解離分別為120 s,6個濃度梯度循環。利用Forte Bio Da-ta Acquisition軟件實時收集分子相互作用的動力學數據,計算橄欖苦苷與Aβ1-42的親和力(KD)值。
1.2.5 Neuro-2a細胞的培養 Neuro-2a細胞是一種小鼠來源神經瘤母細胞,廣泛用于神經疾病的體外研究。將凍存的Neuro-2a細胞從液氮中取出,并于37 ℃水浴復蘇,然后轉移至6 cm的細胞培養皿,培養液為含10%的胎牛血清(FBS)和1%的親鏈霉素雙抗(PSG)的DMEM。將其吹打均勻,放置于5% CO2恒溫(37 ℃)細胞培養箱,培養至對數生長期,用于后續實驗。
1.2.6 MTT檢測 用MTT檢測橄欖苦苷對Neuro-2a的細胞毒性以及其對Aβ1-42誘導的Neuro-2a細胞的幸存率的影響。取對數生長期細胞,用PBS清洗,0.25%的胰酶消化1 min后,吸掉胰酶,加入培養基,吹打均勻,收集細胞,鏡下數細胞個數,然后按4000個/孔(100 μl)種植于96孔板,4 w只加入空白的培養基。24 h后,按濃度梯度加入藥物,48 h加入MTT,繼續孵育6 h,加SDS過夜,次日于590~650 nm波長處檢測吸光度,觀察橄欖苦苷對Neuro-2a的細胞毒性。另外,觀察橄欖苦苷對Aβ1-42誘導的Neuro-2a細胞的幸存率的影響,按10000個細胞/孔(100 μl)種96孔板,24 h后加入孵育的20 μmol/L的Aβ1-42,同時給予或不給于橄欖苦苷處理(分別為12.5 μmol/L、25 μmol/L以及50 μmol/L),24 h后,加入MTT,同上檢測。
1.2.7 流式細胞分析細胞的凋亡 取對數生長期細胞,種植于6孔板,20萬個細胞/孔,實驗分組如上,24 h后,在倒置顯微鏡下觀察細胞形態并在200倍光鏡下采圖。然后用PBS洗滌3次,胰酶消化,收集細胞,離心1500 rpm 3 min,吸去培養基,每個樣品用含2 μl的碘化丙錠和1 μl膜聯蛋白V的PBS 200 μl重懸,在室溫避光反應15~20 min后,用流式細胞儀檢測細胞凋亡。
2 結 果
2.1 橄欖苦苷抑制Aβ1-42纖維 20 μmol/L的Aβ1-42與Th-T混合反應后的熒光值比單獨的Th-T溶液對照組高近一倍,而當Aβ1-42與橄欖苦苷孵育后,其Th-T熒光值呈劑量依耐性地降低,與單獨的Aβ1-42相比較***P<0.001。結果表明12.5 μmol/L、25 μmol/L和50 μmol/L的橄欖苦苷顯著抑制Aβ1-42纖維(見圖1)。
2.2 橄欖苦苷與Aβ1-42的親和力 運用生物分子相互作用儀檢測目標蛋白與小分子藥物的親和力是目前直接而先進的藥物篩選手段。曲線圖所示(見圖2A),橄欖苦苷從12.5 μmol/L到400 μmol/L與Aβ1-42結合呈現濃度梯度趨勢。為曲線擬合狀態(見圖2B)。穩態分析結果顯示其平衡離解速率常數(KD)值為249 μmol/L,結合速率常數(Kon)為90.5,解離速率常數(Koff)為3.03,說明橄欖苦苷與Aβ1-42有較好的結合效果,具有較強的親和力。
2.3 橄欖苦苷的細胞毒性及對Aβ1-42誘導的Neuro-2a細胞的幸存率的影響 MTT結果顯示,橄欖苦苷從3.125 μmol/L到400 μmol/L對Neuro-2a有極小的毒性,并且在高劑量顯示具有促進細胞增殖作用。選取12.5 μmol/L、25 μmol/L和50 μmol/L的橄欖苦苷對Aβ1-42誘導的Neuro-2a細胞進行干預,鏡下觀察結果顯示,Aβ1-42導致Neuro-2a細胞形態發生變化,不規則,并且細胞間隙稀疏,表明有細胞死亡。橄欖苦苷對損傷的細胞形態有顯著的改善作用,并且提高Aβ1-42誘導的Neuro-2a細胞的幸存率,與Aβ1-42相比較***P<0.001(見圖3A~C)。
2.4 橄欖苦苷對Aβ1-42誘導的Neuro-2a細胞的凋亡的影響 流式結果分析表明,空白對照組僅有極少的細胞出現凋亡,凋亡率為(1.74±0.521)%;而Aβ1-42誘導的Neuro-2a細胞有大量的細胞凋亡(36.13±4.14)%;橄欖苦苷低、中、高劑量處理的細胞,其凋亡率分別為(28.5±2.44)%、(14.24±2.30)%及(8.21±2.01)%。與單獨的Aβ1-42相比較*P<0.05或***P<0.001(見圖4A、B)。
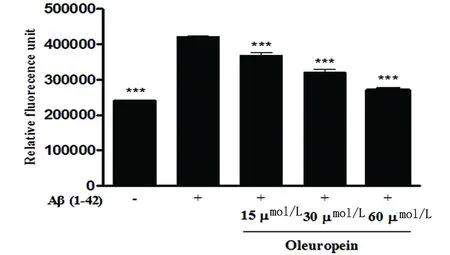
圖1 橄欖苦苷對Aβ1-42纖維的抑制效應

A:不同濃度的橄欖苦苷與Aβ1-42動態結合和解離圖;B:橄欖苦苷與Aβ1-42結合的穩態分析曲線擬合
圖2 橄欖苦苷與Aβ1-42的親和力
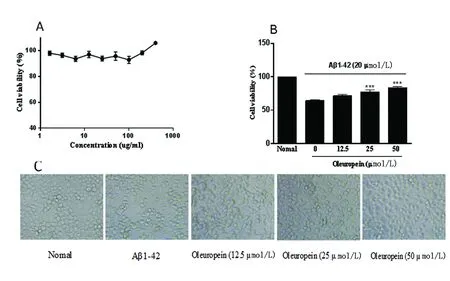
A:橄欖苦苷的細胞毒性;B:橄欖苦苷對Aβ1-42誘導的Neuro-2a細胞的幸存率的影響;C:各組細胞形態變化
圖3 橄欖苦苷的細胞毒性及對Aβ1-42誘導的Neuro-2a細胞的幸存率的影響

A:各組流式細胞圖;B:橄欖苦苷降低Aβ1-42誘導的Neuro-2a細胞的凋亡率
圖4 橄欖苦苷對Aβ1-42誘導的Neuro-2a細胞凋亡的影響
3 討 論
在阿爾茨海默病的發生發展過程中,β淀粉樣蛋白一直是發病機制的主流學說。新近的研究顯示,在AD患者出現癥狀的二十幾年前,患者的大腦中已開始出現Aβ的聚集[7],這也是諸多針對Aβ靶點的藥物在臨床試驗失敗的一大因素,但也同時更加說明Aβ在AD的預防和治療中的重要性。Aβ的聚集激活小膠質細胞和星型膠質細胞,影響軸突重塑;引起氧化應激反應,氧自由基釋放,促使線粒體損傷,繼而引起細胞凋亡的發生;促進tau蛋白的磷酸化,使神經纖維纏結形成,導致神經元的丟失。諸多損傷因素形成復雜的瀑布式級聯反應,使患者最終出現記憶功能損傷[8,9]。
Aβ是淀粉樣前體蛋白(amyloid precursor protein,APP)依次經β-分解酶和γ-分解酶水解而形成的一個多肽家族。APP另一非Aβ途徑為sAPPα,由α分解酶作用產生。研究表明,橄欖苦苷能夠抑制tau纖維的形成[10],并且促進APP的α分解酶途徑從而可能減少Aβ的產生[11]。這為我們的實驗提供了理論和實踐基礎。Aβ多肽家族中,Aβ1-42最易聚集且最具毒性,在AD患者腦中含量較高[12],因此被作為AD模型的首選。Aβ聚合有多種形式,包括單聚體、多聚體、纖維等,Th-T作為測定Aβ纖維的經典方法,已被廣發運用于針對Aβ靶點的藥物篩選[13,14]。因此,本實驗以Aβ1-42為靶點,通過傳統的Th-T熒光測定證明橄欖苦苷具有降解Aβ纖維的能力。生物膜層干涉(biolayer interferometry,BLI) 技術是一種基于光干涉原理的非標記技術,通過該技術計算出分子間的親和力,從而確認分子間的相互作用。該技術操作簡單、所需樣品量少、具有實時提供被分析物的相互作用等優勢[15],因此被廣泛用于蛋白與小分子親和力的測定以及抗體篩選等。本實驗通過該技術進一步確認了橄欖苦苷與Aβ1-42有良好的親和力,明確橄欖苦苷作為抗Aβ藥物的可能性。在此基礎上,我們發現橄欖苦苷能夠降低Aβ1-42誘導的Neuro-2a的細胞毒性,提高細胞幸存率,并保護Aβ1-42誘導的細胞凋亡,進一步驗證了橄欖苦苷在AD治療的潛在可能性。
總之,我們目前的研究支持橄欖苦苷作為治療阿爾茨海默病的潛在藥物。這是對橄欖葉天然成分的新的探索,并將有助于廢物的循環利用。然而橄欖苦苷在AD治療的機制有待進一步探索。

