基于模型認知的微專題復習法初探
方紅梅 魏天文

高中化學的復習既要完成對知識的梳理和整合,全面落實基礎,又要讓學生在重難點上有所提升和突破。這就要求教師恰當、靈活地運用科學的教學方法和手段。基于模型認知的微專題復習法在以導學案引導學生自主完成基礎知識梳理和整合的基礎上,針對重難點內容設置微專題,引導學生通過構建思維模型突破重難點知識,提升思維能力,實現知識的吸收。
一、復習模式
基于模型認知的微專題復習法的基本模式為:
首先,學生通過導學案的自主復習,可以完成對零散、孤立的化學知識的梳理和整合,構建基本的知識框架和知識網絡。教師通過導學案的問題反饋準確判斷學生在復習中的知識弱點,并結合重點和難點設置主題微專題。微專題的講解過程,重點在于在實際情境中引導學生通過分析推理構建分析和思維模型,并通過應用模型解決實際問題。
二、微專題的設置
微專題復習可以打破知識模塊之間的壁壘,將相似、分散、變式、拓展的知識重新建構與整合,形成點狀輻射或帶狀輻射。微專題的設置遵循以下原則:
(一)“三點”強化原則。微專題的設置一是強化考綱和教材的重點,二是強化學生導學案所反饋的弱點,三是強化知識難點。教師應該結合重點、弱點和難點精心挑選內容設置微專題。
(二)多樣化原則。微專題類型是多樣化的:可以是知識整合類的,如有機合成中的成環反應;可以是解題方法類的,如計算題中守恒法的應用;可以是相似題型類的,如平衡常數K的計算;可以是高頻考點類的,如鋰電池的考查。教師應根據復習內容靈活多樣的設置微專題。
(三)專一性原則。微專題重在突出解決一個主題問題,內容不能過多,否則就容易變為傳統專題而失去了微專題的專一性。微專題的設置要切實做到“三點”突出,類型靈活,主題鮮明。例如在電化學的復習中,教師通過檢查導學案,發現學生在書寫教材中的常見電池如鋅錳干電池、鉛蓄電池和氫氧燃料電池時的電極反應時,準確度較高,落實情況較好,但書寫有關新情境條件下的電極反應式時書寫錯誤較多,而判斷兩極的放電物質、電解質環境及交換膜對電極反應式書寫的影響等方面是主要錯因。2019年高考化學考試大綱“考試范圍與要求”中“化學反應與能量”第⑧條明確指出:理解原電池和電解池的構成、工作原理及應用,能書寫電極反應和總反應方程式,高考命題對知識內容的要求是三個層次中的“理解”。通過分析近5年的高考題發現,以新型電化學裝置為情境的電化學原理(電極判斷,電極反應,離子移動等)的考查,在高考中出現的頻率很高。
結合以上“三點”,我們確定了“新情境下電極反應式的書寫”電化學微專題。
三、構建模型→應用模型
通過分析大量關于電化學考查的高考試題發現,新情境一般分為兩類,一類以新型原電池為情境,另一類以新型電解池在生產生活中的應用為情境。情境不同但考查內容大同小異,如電極名稱、電極反應、離子的移動、電極附近或溶液pH值的變化或相關電極產物的計算等。這些內容的核心為電化學裝置和電化學原理:兩個電極、電子導體和離子導體構成閉合回路;在兩極分別發生氧化反應和還原反應(簡述為“負陽氧,正陰還”)。因此,新情境下的電極反應式書寫的思維模型構建了原理維度和裝置維度兩大認識維度。原理維度以氧化還原反應為基礎,包括電極反應物、電極產物、過程、反應現象;裝置維度包括原電池或電解池里面的所有裝置要素即電極材料、電子導體(導線)、離子導體(電解質溶液或鹽橋、膜)。以下以兩大維度為主線,具體介紹、分析新情境下電極反應式的書寫模型。
(一)已知總反應情境下的電極反應式的書寫
我們先來看一道2018年課標Ⅱ的考試題:
我國科學家研發了一種室溫下“可呼吸”的Na—CO2二次電池。將NaClO4溶于有機溶劑作為電解液,鈉和負載碳納米管的鎳網分別作為電極材料,電池的總反應為:3CO2+4Na[]2Na2CO3+C。下列說法錯誤的是( ????)。
A.放電時,ClO4-向負極移動
B.充電時釋放CO2,放電時吸收CO2
C.放電時,正極反應為:3CO2+4e=2CO32-+C
D.充電時,正極反應為:Na++e=Na
圍繞這道題目的電極反應式書寫模型構建,可以分三步完成。
1.提取題干信息
通過分析題目條件可以得出裝置為原電池裝置,題干所給總反應為自發進行的氧化還原反應,依據原電池的構成條件和電極反應特點,將此氧化還原反應拆分為兩個“半反應”,即氧化反應和還原反應,結合電解質的化學環境就可以確定原電池的負極和正極的電極反應。
首先,用雙線橋法分析總反應:
接著,將其拆分為兩個“半反應”:負極發生失去電子的氧化反應為“4Na-4e-=4Na+”;正極發生得到電子的還原反應為“3CO2+4e-=2CO32- +C”。
其次,原電池的工作原理是外電路中電子從負極通過導線流向正極,內電路中陽離子定向移動到正極,陰離子定向移動到負極,從而構成閉合回路,所以放電時ClO4-向負極移動。充電時原電池變為電解池,兩極的物質需要從放電后的物質恢復到放電前的活性物質,即Na+→Na發生還原反應,C→CO2 發生氧化反應,所以電池的負極與外接電源的負極相連變成充電時電解池的陰極,電池的正極與電源的正極相連變成充電時電解池的陽極,即“負變陰,正變陽”,用化學方程式表示就是陰極“4Na+4e- =4Na+”,陽極“2CO32-+ C-4e-=3CO2 ”,所以答案選D。
2.構建分析模型
從以上裝置和原理的兩大分析維度綜合得出本題的答案選D,同時提煉出“以總反應為基礎的電極反應式的書寫”的分析模型:
在學生已經具備常見原電池的分析模型和氧化還原反應雙線橋法的分析模型的基礎上,構建上述模型不僅完成了學生對原有模型的遷移,而且完善了學生對電化學知識的系統認識。
3.應用模型
為了使學生熟練應用模型,第三步選擇與上面例題條件相似的習題,強化學生的認識。
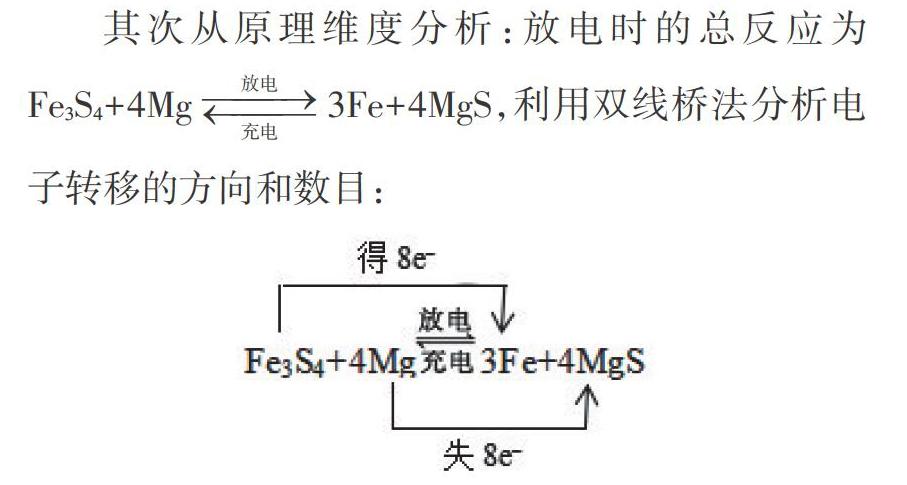
一種高能納米級Fe3S4和鎂的二次電池,其工作原理為Fe3S4+4Mg[放電充電]3Fe+4MgS,裝置如下圖所示。下列說法不正確的是( ????)。
A.放電時,鎂電極為負極
B.放電時,正極的電極反應式為Fe3S4+8e-=3Fe+4S2-
C.充電時,陰極的電極反應式為MgS+2e-=Mg+S2-
D.充電時,S2-從陰離子交換膜左側向右側遷移
首先從裝置維度分析:裝置外接負載,為原電池裝置,為二次電池;裝置中有陰離子交換膜,所以離子導體為陰離子;電極材料分別為Fe3S4和Mg。
其次從原理維度分析:放電時的總反應為Fe3S4+4Mg[放電充電]3Fe+4MgS,利用雙線橋法分析電子轉移的方向和數目:
然后將總反應拆分為兩個“半反應”即氧化反應和還原反應,結合離子導體為陰離子(S2-)確定放電時的電極反應為,負極發生失去電子的氧化反應,即“4Mg-8e-+S2-=4MgS”,正極發生得到電子的還原反應,即“Fe3S4 +8e-=3Fe+S2- ”。充電時負極變陰極,正極變陽極可得充電時的電極反應,即陰極“4MgS+ 8e-=4Mg+S2-”,陽極“3Fe+S2--8e-=Fe3S4”。電解池工作時,內電路中的陰離子S2-通過陰離子交換膜定向移動到陽極,即從左側(陰極室)移動到右側(陽極室),所以答案選D。
(二)總反應未知情境下的電極反應式的書寫
還是從例題說起,以下是2018高考課標Ⅰ中的一道題目。
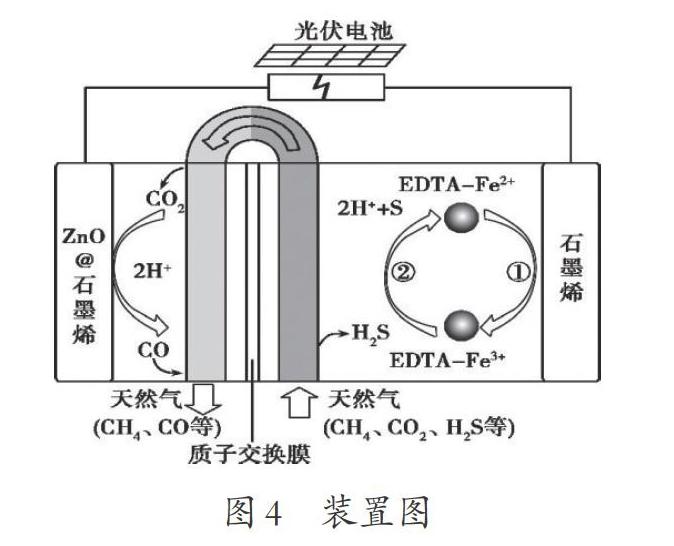
最近我國科學家設計了一種CO2+H2S協同轉化裝置,實現對天然氣中CO2和H2S的高效去除。示意圖如下圖所示,其中電極分別為ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯電極區發生反應為:①EDTA-Fe2+-e-=EDTA-Fe3+;②2EDTA-Fe3++H2S= 2H++S+2EDTA-Fe2+
該裝置工作時,下列敘述錯誤的是( ???)。
A.陰極的電極反應:CO2+2H++2e-=CO+H2O
B.協同轉化總反應:CO2+H2S=CO+H2O+S
C.石墨烯上的電勢比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需為酸性
1.提取題干信息
從裝置維度分析:該裝置為電解池,利用該裝置實現對天然氣中CO2和H2S的高效去除;ZnO@石墨烯(石墨烯包裹的ZnO)電極為陰極,石墨烯電極為陽極;裝置中有質子交換膜,離子導體為H+。
從原理維度分析:外電路中EDTA-Fe2+在陽極失去電子,CO2在陰極得到電子;內電路中H+定向移動到陰極。根據信息“陰極CO2放電,生成CO”,碳元素的化合價由+4價→+2價,得2e-,據此得出陰極反應式的主體為CO2 +2e-=CO。如何補充完成電極反應呢?下面從原子守恒和電荷守恒的角度分析。
結合關鍵信息“質子交換膜”、只允許H+自由移動,最后確定反應前補2個H+,反應后補1個H2O,完成陰極的電極反應“CO2+2e-+2H+=CO+H2O”,所以答案選C。
2.構建分析模型
從以上裝置和原理的兩大分析維度綜合得出本題的答案選C,同時提煉出“總反應未知情境下的電極反應式的書寫”的分析模型:
通過從裝置維度和原理維度分析得出的信息,確定陰陽兩極的放電物質和生成物質,結合離子導體最終確定電極反應式的書寫模型:
3.應用模型
2019年高二課標Ⅰ的第13題與上面這道題接近,適合作為練習題,幫助學生理解和運用模型。
利用生物燃料電池原理研究室溫下氨的合成,電池工作時MV2+/MV+在電極與酶之間傳遞電子,示意圖如下所示。下列說法錯誤的是( ???)。
A.相比現有工業合成氨,該方法條件溫和,同時還可提供電能
B.陰極區氫化酶作用下發生反應H2+2MV2+=2H++2MV+
C.正極區,固氮酶為催化劑,N2發生還原反應生成NH3
D.電池工作時質子通過交換膜由負極區向正極區移動
從裝置維度分析:裝置為原電池,用于研究室溫下氨氣的合成;離子導體為H+;MV+在左側電極上放電生成MV2+,發生失去電子的氧化反應,所以左側為負極,右側為正極。
從原理維度分析:利用生物燃料電池原理研究室溫下氨的合成的工作過程為:負極MV+在電極上失去電子生成MV2+,MV2+在氫化酶的催化作用下與H2反應生成MV+和H+。負極的電極反應為:MV+-e-=MV2+。正極MV2+在電極上得到電子生成MV+,MV+在固氮酶的催化作用下與N2反應生成MV2+和NH3。正極的電極反應為:MV2++e-= MV+。內電路中H+從負極定向移動到正極。因此,答案選B。
實際教學中發現,經過基于模型認知的微專題訓練,學生不僅建立了新情境下電極反應式書寫的有效途徑,而且能參考上述模型靈活分析其他電化學問題。
【本文是湖北省教育學會“十三五”教育科研課題2019年重點課題《以問題情境為主線的探究式教學模式》(課題編號:2019B19001)研究成果】
(作者單位:方紅梅,天門中學;魏天文,天門市教科院)
責任編輯 ?姜楚華

