白皮杉醇對DN大鼠腎小球內皮細胞損傷的保護作用及其機制
張云霞,邱書娟,孫秀菊,郭振濤,郭民
(濰坊醫學院附屬醫院,山東濰坊261031)
糖尿病腎病(DN)是臨床最常見的微血管并發癥之一,也是引起慢性腎臟疾病和終末期腎病的重要原因。研究證實,氧化應激和炎癥反應在內皮細胞損傷中具有重要作用,而DN發病的重要環節是腎小球內皮細胞損傷[1]。因此,抑制氧化應激和炎癥反應可改善腎小球內皮細胞損傷,延緩DN進展。白皮杉醇(PIC)是白藜蘆醇的衍生物,主要存在于葡萄、大黃、甘蔗等植物中,是一種多酚化合物。研究證實,PIC具有多種生物學活性,如抗氧化應激、清除自由基、抑制炎癥反應、抗細胞凋亡等作用[2],尤其在抗氧化應激方面較白藜蘆醇效果更明顯。但目前國內對PIC的研究較少,其作用機制亦不十分清楚。為此,2016年11月~2017年12月,我們觀察了PIC對DN大鼠腎小球內皮細胞損傷的保護作用,并探討其可能的作用機制。現報告如下。
1 材料與方法
1.1 材料 健康雄性SD大鼠50只,清潔級,8周齡,體質量(200±20)g,購自中國科學院上海實驗動物中心。所有大鼠分籠飼養,每5只1籠,自由攝食、飲水,飼養環境:溫度21~23 ℃、濕度50%~60%、自然晝夜節律光照。PIC,杭州廣林生物醫藥公司;鏈脲佐菌素(STZ),美國Sigma公司。所有引物由美國Invitrogen公司設計合成。Modular DPP全自動生化分析儀,瑞士Roche公司;RM-2145石蠟切片機,德國徠卡公司;梯度PCR儀、核酸蛋白測定儀,德國Eppendor公司。大鼠內皮素1(ET-1)、血管內皮生長因子(VEGF)ELISA試劑盒,上海谷研生物科技有限公司;超氧化物歧化酶(SOD)、丙二醛(MDA)檢測試劑盒,南京建成生物科技有限公司;兔抗大鼠p38 MAPK、TNF-α單克隆抗體,美國Sigma公司;DAB顯色試劑盒,武漢博士德生物工程有限公司。
1.2 動物分組處理 所有大鼠適應性喂養1周,隨機分為對照組、模型組及PIC低、中、高劑量組,每組10只。模型組及PIC低、中、高劑量組高糖高脂飼料喂養4周,給予STZ 30 mg/kg一次性腹腔注射,制備DN模型。腹腔注射次日,PIC低、中、高劑量組分別給予PIC 50、100、200 mg/(kg·d)灌胃,模型組給予等量生理鹽水灌胃,連續灌胃12周。對照組普通飼料喂養,不予注射STZ,同期等量生理鹽水灌胃。
1.3 相關指標觀察
1.3.1 腎功能及血糖 各組灌胃12周末,置于代謝籠中,留取24 h尿液,采用全自動生化分析儀、免疫透射比濁法檢測24 h尿白蛋白(U-Alb);禁食12 h,3%水合氯醛100 mg/kg腹腔注射麻醉,麻醉完全后腹主動脈取血3 mL,采用全自動生化分析儀檢測空腹血糖(FPG)及血清肌酐(Scr)、胱抑素C(Cys-C)。
1.3.2 腎小球內皮細胞功能及氧化應激狀態 各組麻醉完全后無菌條件下摘取右側腎臟,于冰冷的生理鹽水中漂洗。取適量腎組織,充分研磨,制成10%組織勻漿,2 500 r/min離心10 min,取上清。采用ELISA法檢測上清液ET-1、VEGF,硝酸還原酶法檢測上清液NO,黃嘌呤氧化酶法檢測上清液SOD活力,比色法檢測上清液MDA含量。所有操作嚴格按照試劑盒說明進行。
1.3.3 腎組織病理形態 取部分腎皮質,10%甲醛固定24 h,梯度乙醇脫水,二甲苯透明,石蠟包埋,4 μm厚連續切片。切片經二甲苯脫蠟至水,1%高碘酸氧化10 min,蒸餾水沖洗;Schiff氏液避光染色10 min,蒸餾水沖洗;0.5%偏重亞硫酸鈉浸洗2次,蒸餾水沖洗;蘇木素染核3~5 min,自來水沖洗;1%鹽酸乙醇分化,自來水沖洗;1%氨水返藍,流水沖洗;梯度乙醇脫水,二甲苯透明,中性樹膠封片。光鏡下隨機選擇10個400倍無重疊視野,觀察腎小球、腎小管、系膜基質病理形態及炎性細胞浸潤情況。
1.3.4 腎組織p38絲裂原活化蛋白激酶(p38 MAPK)、TNF-α表達 ①腎組織p38 MAPK、TNF-α mRNA表達:采用RT-PCR法。取部分腎組織,按TRIzol法提取組織總RNA,經紫外分光光度計和2%瓊脂糖凝膠電泳鑒定,提取的總RNA符合實驗要求。按cDNA合成試劑盒說明將總RNA逆轉錄為cDNA。以cDNA為模板進行PCR擴增。引物序列:p38 MAPK上游引物5′-AGGGCGATGTGACGTTTG-3′,下游引物5′-CTGGCAGGGTGAAGTTGG-3′,擴增片段1 083 bp;TNF-α上游引物5′-TGATCGGTCCCAACAAGGA-3′,下游引物5′-TGCTTGGTGGTTTGCTACGA-3′,擴增片段368 bp;β-actin上游引物5′-GGCATCCACGAATCTACCT-3′,下游引物5′-GCTGTCACCTTCACCGTTC-3′,擴增片段480 bp。PCR反應體系共25 μL:10×擴增緩沖液 2.5 μL,2.5 mmol/L dNTP 2.0 μL,上下游引物各1.0 μL,TaqDNA聚合酶0.4 μL,模板cDNA 2.0 μL,雙蒸水補齊至25 μL;反應條件:94 ℃預變性5 min;94 ℃變性30 s,55 ℃(p38 MAPK)、53 ℃(TNF-α)或57 ℃(β-action)退火30 s,72 ℃延伸30 s,重復30個循環;最后72 ℃延伸10 min。以β-action為內參,采用2-ΔΔCT法計算目的基因相對表達量。實驗重復3次,取平均值。②腎組織p38 MAPK、TNF-α蛋白表達:采用免疫組化法。取上述石蠟切片,置于60 ℃烘箱烘片30 min,二甲苯脫蠟,梯度乙醇脫水,0.01 mmol/L枸櫞酸緩沖液加熱抗原修復,自然冷卻至室溫,3% H2O2滅活內源性過氧化物酶活性。山羊血清封閉15 min,分別加入兔單克隆抗p38 MAPK、TNF-α一抗,37 ℃孵育2 h;然后加入生物素標記的二抗,37 ℃孵育30 min;DAB顯色,蘇木素復染,梯度乙醇脫水,二甲苯透明,中性樹膠封片,顯微鏡下觀察。用美國Sigma公司提供的陽性切片作為陽性對照,PBS代替一抗作為陰性對照。p38 MAPK陽性表達定位于細胞質,呈棕褐色;TNF-α陽性表達定位于細胞質,呈棕黃色。每張切片隨機取10個400倍不重疊視野,采用Image-Pro Plus軟件分析每視野光密度值,以此代表目的蛋白相對表達量。實驗重復3次,取平均值。

2 結果
2.1 各組血糖及腎功能相關指標比較 見表1。
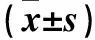
表1 各組血糖和腎功能相關指標比較
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05;與PIC低劑量組比較,△P<0.05;與PIC中劑量組比較,▲P<0.05。
2.2 各組內皮細胞功能和氧化應激相關指標比較 見表2。
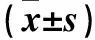
表2 各組內皮細胞功能和氧化應激相關指標比較
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05;與PIC低劑量組比較,△P<0.05;與PIC中劑量組比較,▲P<0.05。
2.3 各組腎組織病理形態觀察 對照組腎小球、腎小管結構清晰,基底膜厚度正常,間質中未見明顯炎癥細胞浸潤。模型組出現明顯腎小球和腎小管基底膜增厚,系膜基質增多,腎小管上皮細胞脫落、空泡變、管腔擴大,結構紊亂伴有萎縮,毛細血管腔嚴重受壓。與模型組比較,PIC各組腎組織損傷減輕,且隨著PIC濃度升高,腎組織損傷逐漸減輕。
2.4 各組p38 MAPK、TNF-α表達比較 見表3。
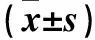
表3 各組p38 MAPK、TNF-α mRNA和蛋白相對表達量比較
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05;與PIC低劑量組比較,△P<0.05;與PIC中劑量組比較,▲P<0.05。
3 討論
DN是糖尿病最常見的微血管并發癥之一,即使嚴格控制血糖、規律應用ACEI/ARB類藥物亦不能阻止其進展。研究證實,腎小球內皮細胞損傷是DN發病的重要環節之一[3]。長期高血糖會通過激活蛋白激酶C通路、糖基化終產物蓄積、激活血管緊張素-醛固酮系統、氧化應激等途徑損傷內皮細胞,其電荷屏障和機械屏障破壞可導致蛋白尿,引起炎癥免疫反應,繼而導致系膜基質增生、腎小球硬化等[3,4]。內皮細胞可分泌多種細胞因子,如NO、ET-1、VEGF等,調控這些細胞因子可改善腎內微循環,抑制炎癥細胞浸潤,保護內皮細胞。高血糖可引起內皮細胞損傷,NO等舒張血管物質生成減少,ET-1等收縮血管物質生成增多[5],同時IL-8、IL-1、VEGF等細胞因子生成增多,促進腎臟炎癥反應、內皮細胞損傷及腎臟纖維化[6]。本研究模型組腎組織ET-1、VEGF明顯增多,NO明顯降低,證實DN大鼠腎組織存在明顯內皮細胞損傷。
PIC是白藜蘆醇的衍生物,主要存在于葡萄、大黃、甘蔗等植物中,是白藜蘆醇的羥基化衍生物,也是其代謝產物。研究證實,PIC具有抗氧化應激、抗細胞凋亡、抑制炎癥反應等作用,尤其在抗氧化應激方面效果更明顯[7]。有研究表明,PIC預處理能夠抑制棕櫚酸誘導的人臍靜脈內皮細胞損傷,增加NO生成,抑制氧化應激反應[8];PIC還能通過活化PI3K/AKT信號通路,促進內皮型一氧化氮合酶合成,促進NO釋放,繼而保護內皮細胞[9]。此外,PIC還能減輕胰島素抵抗,降低糖尿病小鼠血糖水平[10]。而DN的發生與炎癥反應和氧化應激密切相關,故PIC有可能延緩DN進展。但目前相關研究報道較少。
為探討PIC對DN的作用效果,本研究對DN大鼠給予PIC 50、100、200 mg/(kg·d)灌胃處理12周,觀察其血糖、腎功能、內皮細胞功能及氧化應激相關指標變化。結果顯示,模型組血糖和腎功能相關指標均明顯高于對照組;腎組織NO水平、SOD活性均明顯低于對照組,ET-1、VEGF水平及MDA含量均明顯高于對照組;且其腎組織出現明顯損傷,而對照組腎組織未見明顯異常。表明DN大鼠可出現明顯的腎小球內皮細胞損傷,且其損傷可能與氧化應激反應有關。本研究結果還發現,PIC各組均能改善腎小球內皮細胞損傷,抑制氧化應激反應,且隨著PIC濃度升高,其效果越來越明顯。表明PIC能夠抑制氧化應激反應,保護腎小球內皮細胞功能,延緩DN進展。
p38 MAPK是生物體內重要的信號轉導通路,能夠調控炎癥因子分泌[11],而內皮細胞損傷與炎癥反應密切相關。因此,在信號通路水平阻斷和調控MAPK表達,可減輕內皮細胞損傷。TNF-α、IL-6、IL-10等炎癥因子均可引起p38 MAPK通路活化[12,13],磷酸化的p38 MAPK入核后又能通過調控NF-κB等基因表達,促進單核巨噬細胞分泌TNF-α、IL-6、IL-10等炎癥因子,使得炎癥反應級聯擴大,加重內皮細胞損傷[14,15]。為探討PIC的作用機制,我們觀察了各組腎組織p38 MAPK、TNF-α表達。結果發現,模型組腎組織p38 MAPK、TNF-α表達明顯高于對照組,表明DN大鼠體內存在明顯的p38 MAPK通路激活。既往研究發現,抑制p38 MAPK通路活化能抑制內皮細胞釋放炎癥因子,緩解炎癥反應[16,17]。本研究結果顯示,PIC各組腎組織p38 MAPK、TNF-α表達均明顯低于模型組,且隨著PIC濃度升高,其效果越來越明顯。表明PIC可能通過抑制p38 MAPK通路活化,減輕炎癥反應、緩解氧化應激反應,從而發揮腎小球內皮細胞保護作用。
綜上所述,PIC能劑量依賴性地減輕腎小球內皮細胞損傷,保護腎功能,延緩DN進展,其作用機制可能與抑制p38 MAPK通路活化,減輕炎癥反應、緩解氧化應激反應有關。

