靶向EGFR抗體融合UL16結合蛋白2激活NK細胞治療結直腸癌的體內外研究
文家治
結直腸癌(colorectal cancer,CRC) 是全球常見的惡性腫瘤,大約有20 %的結直腸癌發展為轉移性結直腸癌,其患者5年內生存率僅僅不到10 %。結直腸癌傳統的治療方法為手術、化學治療和放射治療,但都存在著靶向性低、細胞毒性大等缺點[1-2]。表皮生長因子受體(epidermal growth factor receptor,EGFR)是臨床上研究比較多的一個腫瘤治療靶點,EGFR和其相應的配體結合后,結合為同源二聚體,也可以與其他TK受體結合從而激活細胞內TK區,通過啟動一系列級聯反應最終抑制腫瘤細胞增殖和凋亡,促進腫瘤細胞發生轉移,并且能夠耐受放療和化療等治療,所以,EGFR在腫瘤發生以及發展過程中發揮重要作用。據相關文獻報道,EGFR在胰腺癌、胃癌、結直腸癌、卵巢癌等惡性腫瘤中高表達,在腫瘤發生和發展過程中扮演著重要角色,其通過阻斷EGFR 信號可抑制腫瘤細胞的增殖[3-4]。NK 細胞表面活化性受體(natural killer cell activating receptor,NKG2D)是一種NK 細胞、CD8 + T 細胞、NKT 細胞等免疫細胞表面的蛋白。而UL16 結合蛋白(unique long 16-binding proteins,ULBP)是NKG2D 的一種配體,據相關文獻表明 ULBP蛋白參與了機體對肺癌、胃癌及宮頸癌的免疫過程,NK細胞可通過識別結直腸癌細胞表面ULBP3,通過NKG2D介導的殺傷效應來清除腫瘤細胞[5-6]。本研究主要探究靶向EGFR抗體融合UL16結合蛋白2激活NK細胞治療結直腸癌的體內外活性。
1 材料與方法
1.1 材料
DMEM培養基以及胎牛血清FBS購于賽默飛世爾公司(美國);PBS和雙抗(青霉素和鏈霉素)購于普洛立德生物科技有限公司;蛋白Marker 購于金斯瑞生物科技有限公司;FITC-標記的羊抗人IgG抗體購于南京賽博生物公司;細胞培養瓶以及細胞實驗相關耗材購于賽業生物科技有限公司;CytoTox96 非放射性細胞毒性試劑盒購于普洛麥格(北京)生物技術有限公司。
1.2 研究方法
1.2.1 目標融合蛋白的表達以及純化 在GeneBank中搜索靶向EGFR的抗體-西妥昔單抗的基因和UL16結合蛋白2的基因,合成后利用G4S柔性肽把兩者進行連接,構建重組質粒,然后使用畢赤酵母X-33表達系統進行表達。將上一步得到的發酵液通過硫酸銨沉淀法進行提取,然后再采用Protein A以及層析柱法進一步將蛋白分離純化,然后通過Western blot對得到的蛋白進行鑒定,從而獲得產量高以及純度高的目標融合蛋白。
1.2.2 通過流式細胞儀測定目標融合蛋白與HCT116細胞的結合 將HCT116細胞充分分散在培養基中,每組分散成106的單細胞懸液。將上述細胞細胞懸液分為西妥昔單抗組、目標融合蛋白組以及空白脫脂牛奶對照組。在西妥昔單抗組細胞中加入250 μL濃度為200 μg/mL西妥昔單抗抗體,在目標融合蛋白組細胞中加入250 μL濃度為200 μg/mL目標融合蛋白,在空白對照組細胞中加入250 μL脫脂牛奶,3組在冰上進行孵育1 h,然后用PBS進行洗滌,用FITC-標記的羊抗人IgG抗體進行孵育,用PBS進行洗滌,將3組分別上機進行檢測。使用Foxtable2017對數據進行處理分析。
1.2.3 MTT法 取對數期HCT116細胞,計數,調整細胞濃度至4×104個/mL。96孔板用PBS液封,每孔取100 μL細胞懸液種板,37 ℃、5 % CO2培養。12 h后待細胞貼壁后,給藥。每孔加入配制好的西妥昔單抗或目標融合蛋白液體50 μL,每個濃度設6個復孔,空白背景組和空白對照組補加50 μL DEPC水,37 ℃、5 % CO2條件下繼續培養48 h。48 h后,每孔加25 μL MTT工作液,左右前后搖晃均勻,37 ℃孵育4 h。4 h后4 000 rpm 離心10 min。小心吸出每孔培養基。每孔加入DMSO 150 μL,用微型振蕩器震蕩(500 r,10 min)。在酶標儀上測定吸光度(OD)值,選取檢測波長為570 nm,測定其OD值,并計算細胞存活率。細胞存活率(%)=(實驗組OD值-空白組OD值)/(對照組OD值-空白組OD值)×100%。上述實驗重復3次。
1.2.4 ADCC法測定目標融合蛋白激活NK細胞殺傷腫瘤細胞的能力 選用NK92細胞作為效應細胞,靶細胞是HCT116細胞。實驗組設置了NK92細胞與HCT116細胞不同比值的各個實驗組,比值分別為1∶1、1∶50、100∶1,5種對照組(靶細胞自發LDH釋放、效應細胞自發LDH釋放、靶細胞最大LDH釋放、培養基背景對照以及裂解液體積校正對照組),每組設置3 個復孔。按照試劑盒步驟將各種檢測試劑混合加入到細胞毒檢測板中,然后放在37 ℃培養箱中,孵育4 h;孵育結束后,用移液槍移取10 μL細胞裂解液加入到靶細胞最大釋放孔內,裂解45 min后,收集上清液;孵育4 h之后,用離心機250 g進行離心4 min;然后用移液槍吸取50 μL每孔中的上清液加入到一塊新的96 孔板中相對應的孔;然后在每孔中加入對應的底物中,然后在室溫下進行避光孵育30 min。然后在每孔加入50 μL終止液進行終止;在1 h內必須進行檢測,在492 nm波長測定各孔的吸光值。細胞毒性=(實驗組吸收值-效應細胞自發釋放吸收值-靶細胞自發釋放吸收值) /(靶細胞最大釋放吸收值-靶細胞自發釋放吸收值)×100。
1.3 統計學方法
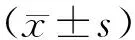
2 結果
2.1 高純度目標融合蛋白的獲得
西妥昔單抗和ULBP分別合成之后,然后通過PCR技術將西妥昔單和ULBP連接重組后,將Cetuximab-ULBP導入質粒中,通過畢赤酵母X-33進行表達。經過純化后,并且利用Western blot驗證后確定我們得到了高純度且構象正確的融合蛋白(靶向EGFR抗體融合UL16結合蛋白2)。
2.2 流式細胞儀測定目標融合蛋白和HCT116細胞的結合能力
靶向EGFR受體的西妥昔單抗和靶向EGFR抗體融合UL16結合蛋白2可與HCT116細胞表面相結合。流式細胞儀測定結果表明:西妥昔單抗和HCT1167細胞的結合率為79.21%,而靶向EGFR抗體融合UL16結合蛋白2和HCT1167細胞的結合率為73.53%,這表明了本研究制備的目標抗體仍然保持了母體抗體結合HCT116細胞的活性。
2.3 MTT結果
本研究通過MTT實驗測定目標融合蛋白對結直腸癌細胞HCT116的增殖抑制活性。MTT實驗結果如表1所示,和對照組相比較,西妥昔單抗組和目標融合蛋白組對HCT116細胞的增殖均有抑制作用,并且呈濃度依賴性。西妥昔單抗組抑制HCT116細胞增殖率為73.76%,目標融合蛋白組抑制HCT116細胞增殖率為71.98%,兩者活性相當。MTT實驗結果表明了我們制備的目標融合蛋白仍保留了西妥昔單抗抑制腫瘤細胞增殖的活性。另外,本實驗還通過MTT法測定了不同濃度下西妥昔單抗和目標融合蛋白的抗腫瘤活性,從表1可以看出兩者的抗腫瘤活性相當,并且抗腫瘤活性呈濃度依賴性。

表1 MTT法測定西妥昔單抗組和目標融合蛋白組對HCT116細胞的抑制率/%
2.4 ADCC實驗結果
本實驗制備的目標融合蛋白同時具備人IgGl抗體上完整的Fc片段和可以激活NK細胞的NKG2D片段,目標融合蛋白能夠通過以上2種途徑增強NK細胞、中性粒細胞等效應細胞殺傷結直腸癌細胞,增強目標融合蛋白(Cetuximab-ULBP)的ADCC作用。選用NK92細胞作為效應細胞,結直腸癌HCT116細胞作為靶細胞進行殺傷實驗,檢測目標融合蛋白(Cetuximab-ULBP)對這種殺傷作用的增強效果。結果顯示(表2),Cetuximab-ULBP能顯著增強結直腸癌HCT116細胞的殺傷作用。選用NK92細胞作為為效應細胞,當Cetuximab和ULBP效靶比為100∶1時,西妥昔單抗和Cetuximab-ULBP都能夠增強NK92的殺傷HCT116腫瘤細胞的作用,其中Cetuximab-ULBP組的細胞裂解率為(45.34±7.14)%,而西妥昔單抗組的細胞裂解率是(38.24±6.11)%,兩者比較,具有統計學差異(P<0.05)。原因主要是目標融合蛋白可以與結腸癌細胞結合,從而將NKG2D分子固定結合在結腸癌細胞的表面,從而誘導NK92和靶細胞之間發生相互作用,最終激活NK92細胞起到殺傷結腸癌細胞的作用。

表2 ADCC實驗檢測各組細胞裂解率
注:*為與對照組相比,P<0.05;#為與西妥昔單抗組相比,P<0.05。
3 討論
近年來EGFR是臨床上腫瘤治療的新靶點,臨床實驗發現EGFR在結直腸癌等多種腫瘤細胞表面表達,并且在腫瘤細胞的發生以及發展過程中發揮重要作用。根據相關文獻研究表明,通過抑制EGFR的表達,能夠起到抗腫瘤的作用,在腫瘤治療中具有良好的研究前景[7-8]。ULBP是一種可以激活NK細胞的配基,ULBP蛋白參與了機體對肺癌、胃癌及宮頸癌的免疫過程,NK細胞可通過識別結直腸癌細胞表面ULBP3,可以通過NKG2D介導的殺傷效應來清除腫瘤細胞,從而使腫瘤細胞脫離免疫逃逸[9-10]。本實驗將具有靶向性的抗體和ULBP分子相結合,具有靶向性的抗體能夠靶向到結直腸癌胞表面的特異性受體,起到抗腫瘤作用,并且還可以通過NKG2D介導的殺傷效應來清除腫瘤細胞,重塑機體NK細胞的殺傷作用,從而實現靶向雙重抗腫瘤的作用。
本研究成功地構建并且表達目標融合蛋白靶向EGFR抗體融合UL16結合蛋白2,并且成功克隆目標融合蛋Cetuximab-ULBP;通過Western blot實驗結果驗證了目標融合蛋白的正確表達以及成功裝配。通過體外抗腫瘤活性實驗結果表明我們的融合蛋白并沒有喪失抗體西妥昔單抗對HCT116腫瘤細胞原有的抗腫瘤活性,通過流式細胞儀實驗結果表明我們的融合蛋白并沒有喪失抗體西妥昔單抗對HCT116腫瘤細胞原有的結合能力。ADCC實驗結果表明,和單一親本抗體進行相比較,本研究構建的目標融合蛋白Cetuximab-ULBP介導NK細胞等免疫細胞的作用更強,從而起到抗腫瘤細胞的作用,這是由于我們的目標融合蛋白能夠成功地將ULBP靶向到結直腸癌腫瘤細胞表面,存在NK細胞表面的活化型受體NKG2D成功被ULBP激活,從而發揮了NK細胞介導地對結直腸癌細胞的免疫殺傷作用。Cetuximab-ULBP還可以通過Fc段及MICB段的介導,存在協同殺傷腫瘤細胞的效果。
綜上所述,與單一西妥昔單抗相比,靶向EGFR抗體融合UL16結合蛋白2通過介導免疫細胞殺傷腫瘤細胞而增強其抗腫瘤活性,在臨床上可作為一種結直腸癌治療的新方法。

