補益涼解法對病毒性肝炎小鼠免疫調節影響的實驗研究*
熊益群 梁越進 徐文軍 劉心亮 穆桂萍 徐紹剛 劉文赫 袁東凱 王靜娜
1.廣州中醫藥大學附屬深圳市中醫院中醫藥研究所 (廣東 深圳, 518033) 2.美國德克薩斯大學醫學分校免疫實驗室 3.廣州中醫藥大學碩士研究生班
病毒性肝炎是我國臨床常見的傳染性疾病,與肝硬化和肝細胞癌的發生密切相關,發病機制與病毒感染、免疫調節紊亂有關。而調控免疫,達到控制病情、延緩疾病進展,與抑制肝炎病毒的復制同為目前的重要治療手段。為此,我們對臨床驗方補益涼解法方進行了相關實驗研究,以探討其免疫調節作用及其機制。
1 材料與方法
1.1 實驗動物、藥物和試劑
1.1.1 實驗動物 C57BL/6 (B6)小鼠,SPF級,6~8 周齡,雌性,體重20~25g。
1.1.2 主要試劑:IL-33 ELISA試劑盒、sST2-ELISA試劑盒、淋巴細胞分離液、紅細胞裂解液、胰蛋白酶、胎牛血清、DMEM培養基、二甲基亞砜、重組IL-33、磷酸鹽緩沖液(PBS)等。
1.1.3 主要儀器 CO2培養箱、超凈工作臺、OLYMPUS倒置顯微鏡、熒光顯微鏡、流式細胞儀、自動平衡離心機、化學發光免疫分析儀、熒光定量PCR儀、多功能酶標儀、BI0-PLEX平臺等。
1.1.4 藥物 補益涼解方:生地、丹皮、山茱萸、女貞子、桑寄生、仙茅、五味子、黃芪、白術、川萆薢、川樸、葉下珠。水煎醇提制成,含生藥量2g/ml,冷藏備用(深圳市中醫院制劑室制備)。
1.2 實驗方法
1.2.1 造模、分組與用藥 根據治療方案將小鼠隨機分成6組:空白組、模型組、補益涼解方大、中、小劑量組,以及IL-33組。除空白組外,其余各組小鼠均行腺病毒3×109PFU(AdLacZ)尾靜脈注入以建立小鼠急性肝炎模型,空白組小鼠尾靜脈注射等容積生理鹽水。用藥(IL-33和補益涼解方)前,對小鼠血清AdLacZ病毒量、ALT、AST、IL-33、sST2進行檢測。
補益涼解法3組小鼠分別給予補益涼解方大、中、小劑量灌胃(分別含生藥5.84g/ml、2.92g/ml、1.46g/ml);IL-33組小鼠按0.8μg/只連續5天腹腔注射鼠重組IL-33;模型組小鼠以等容積PBS液腹腔注射,連續5天。第6天經小鼠眼眶取外周靜脈血,處死小鼠采集肝組織標本。
1.2.2 AdLacZ病毒量測定 尾靜脈注射腺病毒3×109PFU(AdLacZ)后0、0.5、1、3、6天取3只小鼠取血檢測ALT、AST;頸椎脫臼處死動物后,取肝組織用0.5%戊二醛固定30分鐘,切片用0.2mg/ml的X-gal在37℃孵育120分鐘。感染的細胞因為有β-gal 活性而被染成藍色,而未感染的細胞用中性紅復染。每個肝臟選取8個視野,用顯微鏡拍照,用Image-Pro Plus 6.0 software分析感染的肝臟細胞占整個肝臟細胞的比例。
1.2.3 肝組織病理學觀察 肉眼觀察各組大鼠肝臟體積大小、色澤、質地、包膜緊張度等。用10%福爾馬林固定肝臟組織,切片,用蘇木素伊紅染色,普通光學顯微鏡觀察肝組織病理。用Knodell評分系統打分。正常的肝臟沒有損傷或細胞浸潤,打分0;在門靜脈有少數細胞浸潤,但并無蔓延至肝小葉區,同時,伴隨肝小葉區有凋亡或壞死的細胞為2分; 大量的細胞浸潤在門靜脈區,擴散的凋亡和壞死為3分。
1.2.4 肝功能指標 谷丙轉氨酶(ALT)、谷草轉氨酶(AST)。
1.2.5 免疫相關指標 血清及肝組織IL-33、sST2,血清IFN-γ和 IL-2含量。
1.2.6 T淋巴細胞亞群分析 ①分離細胞亞群 肝臟原位灌注、膠原酶消化,30% 和 70% 的Percoll (Sigma) 梯度離心法純化細胞。脾臟單個核細胞分離自補益涼解方、IL-33處理的小鼠。脾臟淋巴細胞分離:小鼠脫頸椎處死后,脾臟被置入75微米的尼龍膜中擠壓,制成單細胞懸液,再加入紅細胞裂解液裂解紅細胞。對于lineage陰性細胞和陽性細胞的分離。細胞首先用Fc阻斷劑(clone 2.4G2, eBioscience) 孵育,然后再加入FITC標記的CD3, CD4, CD8, CD11b, CD11c, B220, NK1.1, Ter-119 和 Gr-1 (eBioscience) 抗體孵育30min。細胞洗滌之后,再用anti-FITC的磁珠孵育,再以LD柱陰選以分離lineage陰性細胞和陽性細胞。
②淋巴細胞培養 分離的細胞種在24孔板,每孔106個細胞,分別加以含有IL-33 10 ng/ml 、補益涼解方不同濃度及IL-2、IL7(10 ng/ml)的培養液,48h后以流式細胞儀檢測。Lin-細胞以1×105/ml的密度種在6孔板內,用含IL-2、7和33(10mg/ml)的完全培養基培養。
③流式細胞術 細胞首先用Fc阻斷劑孵育,然后再與熒光抗體孵育,接著用熒光二抗孵育。對于胞內染色而言,細胞用PMA (50ng/ml, Sigma)、 ionomycin (750 ng/ml, Sigma) 和GolgiStop (1μl/ml BD Bioscience) 一起孵育4小時。孵育結束后,細胞用eBioscience公司的試劑盒固定破膜,再染色胞內因子。流式細胞術分析培養的肝臟淋巴細胞CD4+、CD8+、CD11b+、 CD11c+、NK及CD4+Foxp3+Treg細胞水平,分析培養后的脾臟淋巴細胞液CD11b、CD11c、NK、CD4+Foxp3+Treg細胞及IFN-γ+CD4+、IFN-γ+CD8+T 細胞。
1.3 統計學方法 采用SAS統計分析軟件進行統計學處理。計量資料采用x±s表示,組間比較采用多因素方差分析,P<0.05表示差異具有統計學意義。
2 結果
2.1 各組小鼠實驗期間各項指標變化 見圖1。
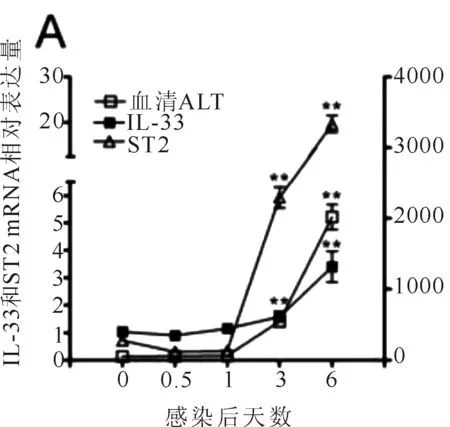
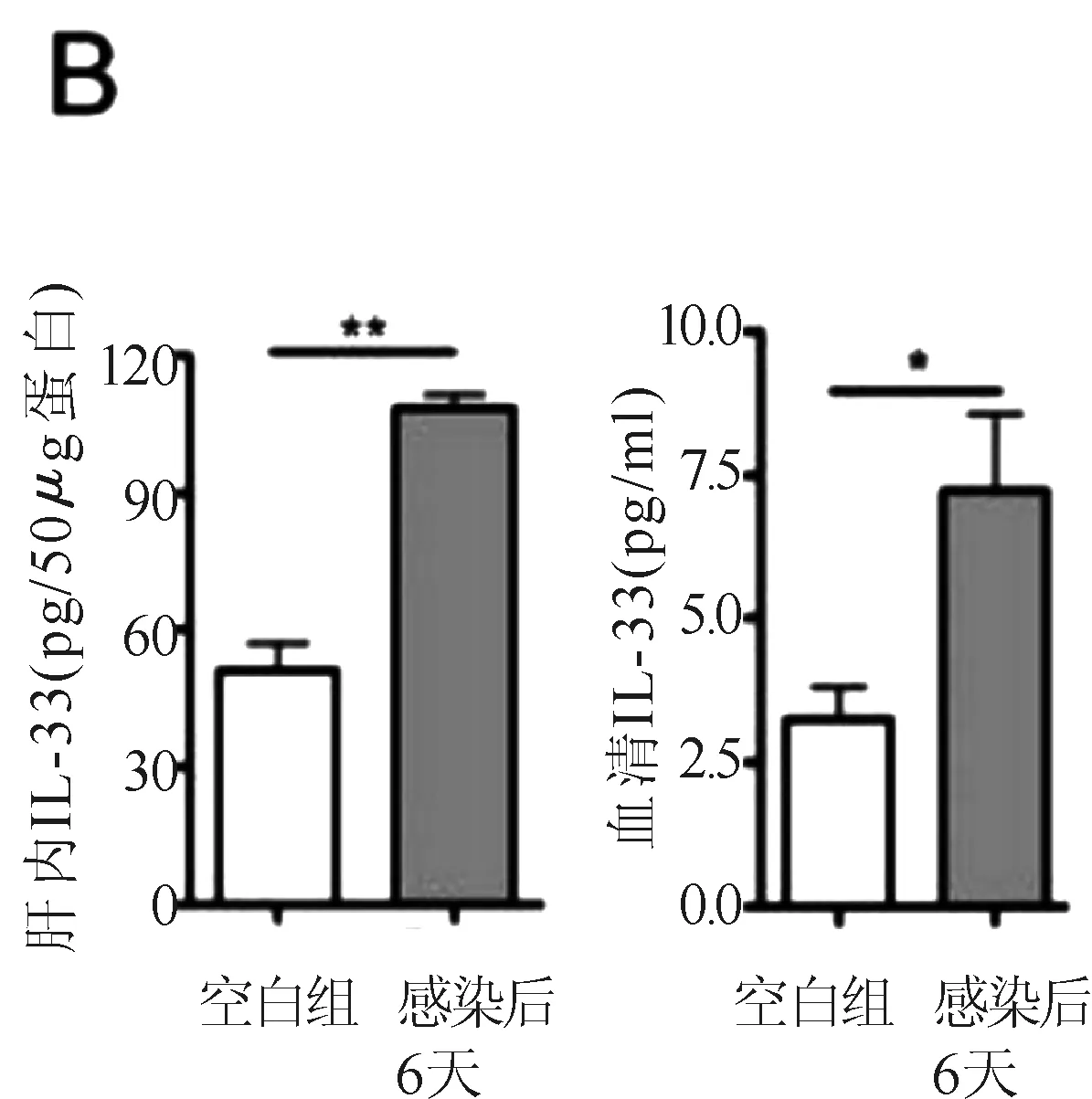
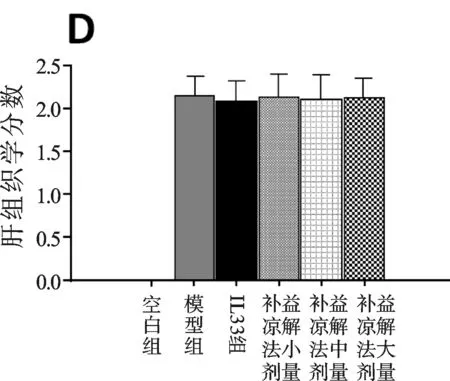
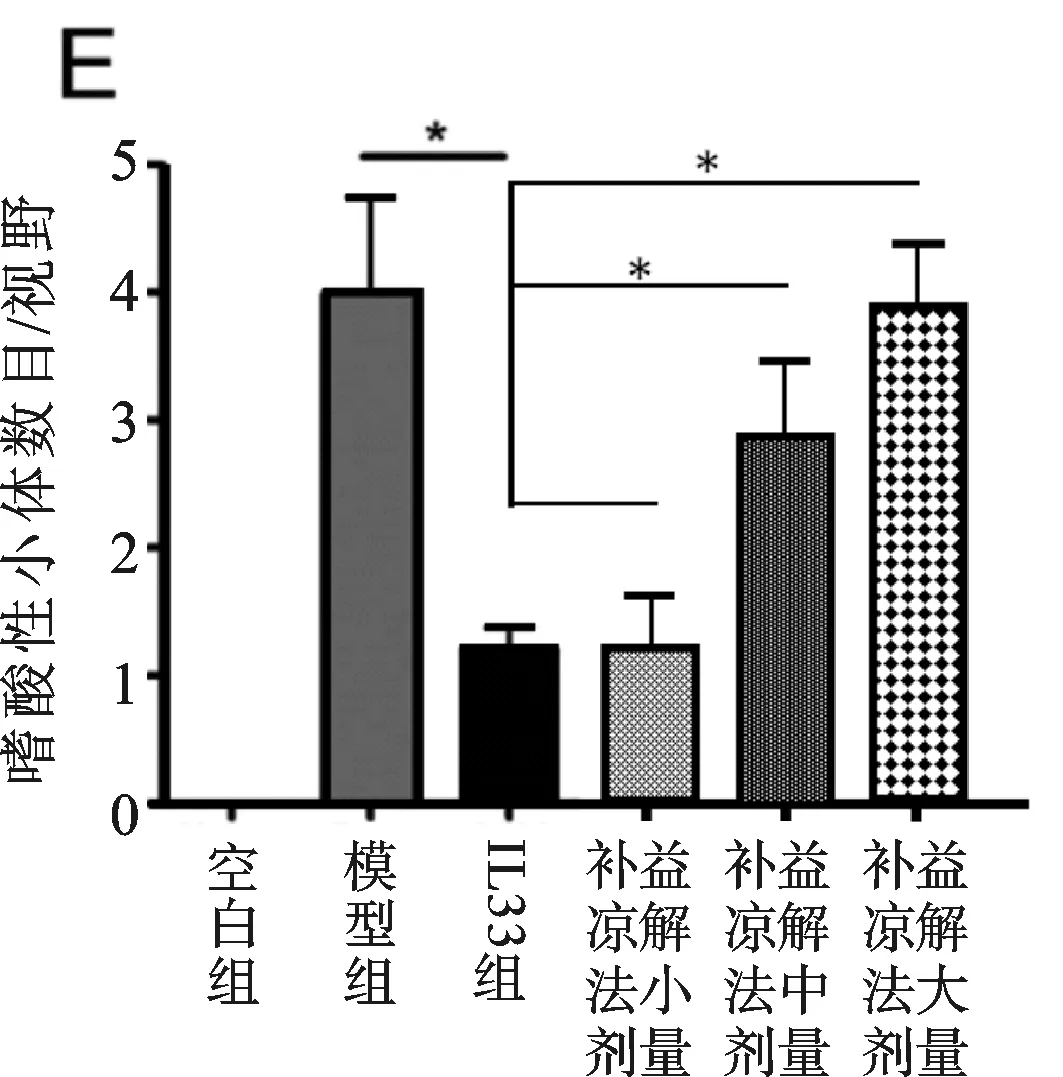
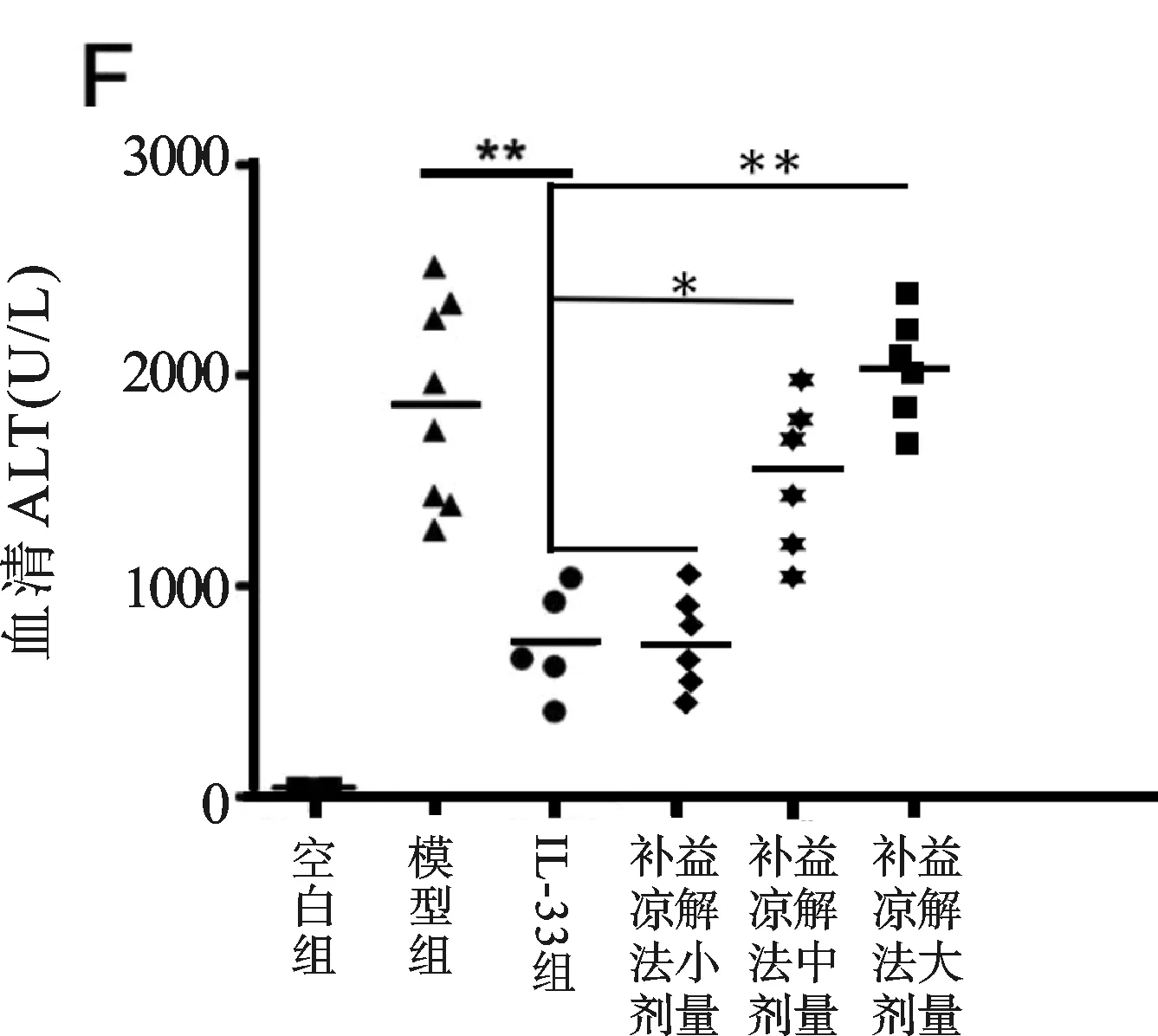
圖1 各組小鼠實驗期間各項指標變化圖
血清ALT水平在第3天開始,持續上升至第6日(見圖1A),肝IL-33和ST2在同一時間點表現同一模式,截止感染后第6天內,肝內和血清IL-33水平較空白組小鼠顯著升高(見圖1B,P<0.01,P<0.05)。腺病毒注射引起顯著的肝門及小葉區淋巴細胞滲透,橋接壞死伴隨嗜酸性小體在三個相鄰的區域被發現(見插頁彩圖1C,箭頭所示)。補益涼解法小劑量組和模型組在肝組織學分數方面不具可比性(P>0.05)(見圖1D),補益涼解法小劑量組嗜酸性小體數目顯著降低(P<0.05)(見圖1E),同時顯著降低實驗動物血清ALT水平(P<0.01)(見圖1F),與IL-33組相比,作用相似(P>0.05)。
2.2 各組小鼠實驗期間T淋巴細胞亞群變化情況 見圖2。圖2A所示,注射AD病毒各組小鼠第6天,可見肝內淋巴細胞聚集程度是空白組的8倍之多,而且1/2的肝內淋巴細胞(IHL)是CD8+T細胞。 IHL的數目并未被補益涼解法治療所改變,這與肝組織學分數是相同的。補益涼解法組和模型組小鼠肝內浸潤的CD4+和CD8+T細胞群中被激活的T細胞亞群(CD44hiCD62Llo)并不具備可比性(P>0.05)(見圖2B),這表明補益涼解法并不影響炎癥肝臟內效應T細胞的遷移,但能顯著減少CD11b+, CD11c+和NK細胞的數量(分別為P<0.05,P<0.01,P<0.01), 同時增加了Treg細胞的數量(P<0.05)(見圖2C)。NK細胞和Treg細胞的這種減少或增加的情況同樣發生在脾臟(分別為P<0.01,P<0.01)(見圖2D)。 補益涼解法降低CD11b+和CD11c+細胞上MHCII的表達和CD11b+、CD11c+細胞CD80的表達。根據兩組小鼠肝內β-gal活性程度,推測補益涼解法組AD肝內病毒清除率情況(見插頁圖2E),實驗結果顯示補益涼解法組和模型組感染后6天感染率分別為(10.6% ± 0.8%)和(7.3% ± 0.7%),感染后14天感染率分別為(0.8% ± 0.2%)和(0.7% ± 0.3%),AD病毒在感染后21天基本完全消失(每一組均<0.1%)。PCR方法測定肝組織內病毒載量結果與β-gal方法的結果一致,兩組小鼠的肝內病毒基因表達穩定下降。但補益涼解法與PBS肝內病毒清除率并無明顯差別(P>0.05)(插頁圖2E)。
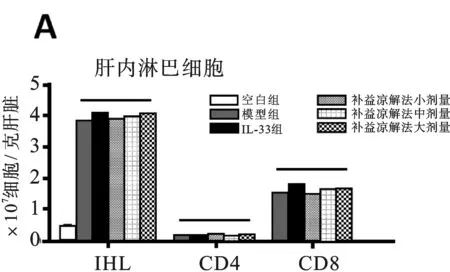

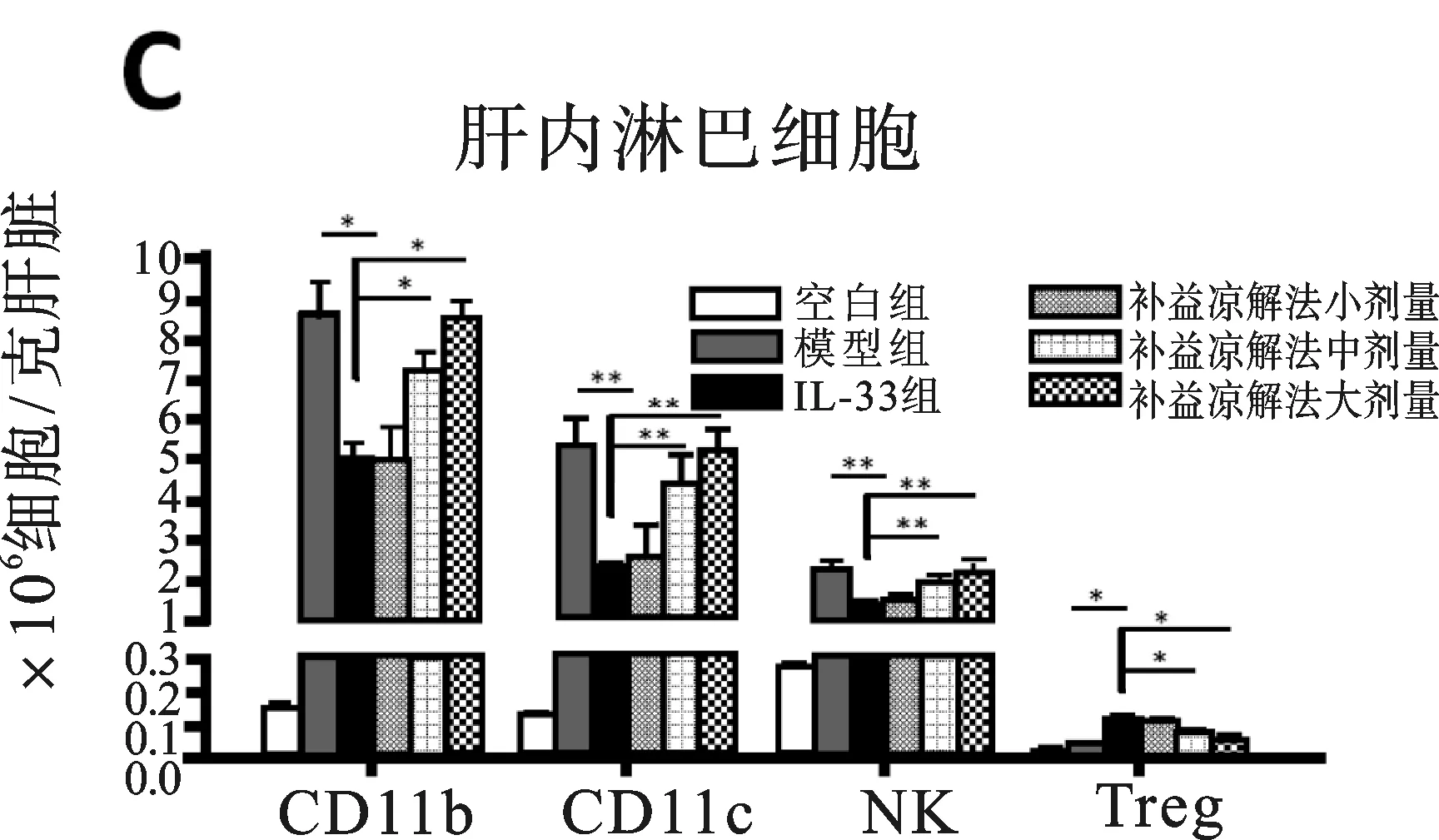
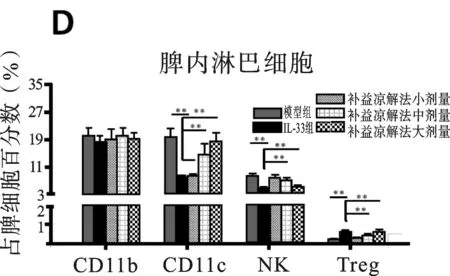
圖2 各組小鼠實驗期間T淋巴細胞亞群變化圖
2.3 各組小鼠實驗期間細胞毒性T淋巴細胞(CTL)變化 為了更進一步研究補益涼解法中藥在減輕肝損傷中的機制,我們對補益涼解法處理后小鼠炎癥細胞分泌的細胞因子進行了檢測。肝內IFN-γ+CD4+和IFN-γ+CD8+T細胞百分比,補益涼解法組相對模型組顯著增加(見插頁圖3A)。補益涼解法組小鼠血清IFN-γ和IL-2水平上調(分別為P<0.01,<0.05)(見圖3B),IFN-γ、顆粒酶B和穿孔素在兩組間差異均有顯著性意義(分別為P<0.05,P<0.05,P<0.05)(見圖3C),表示補益涼解法能夠增強病毒性肝炎小鼠1型免疫應答。
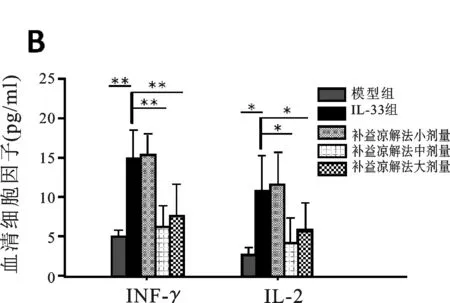
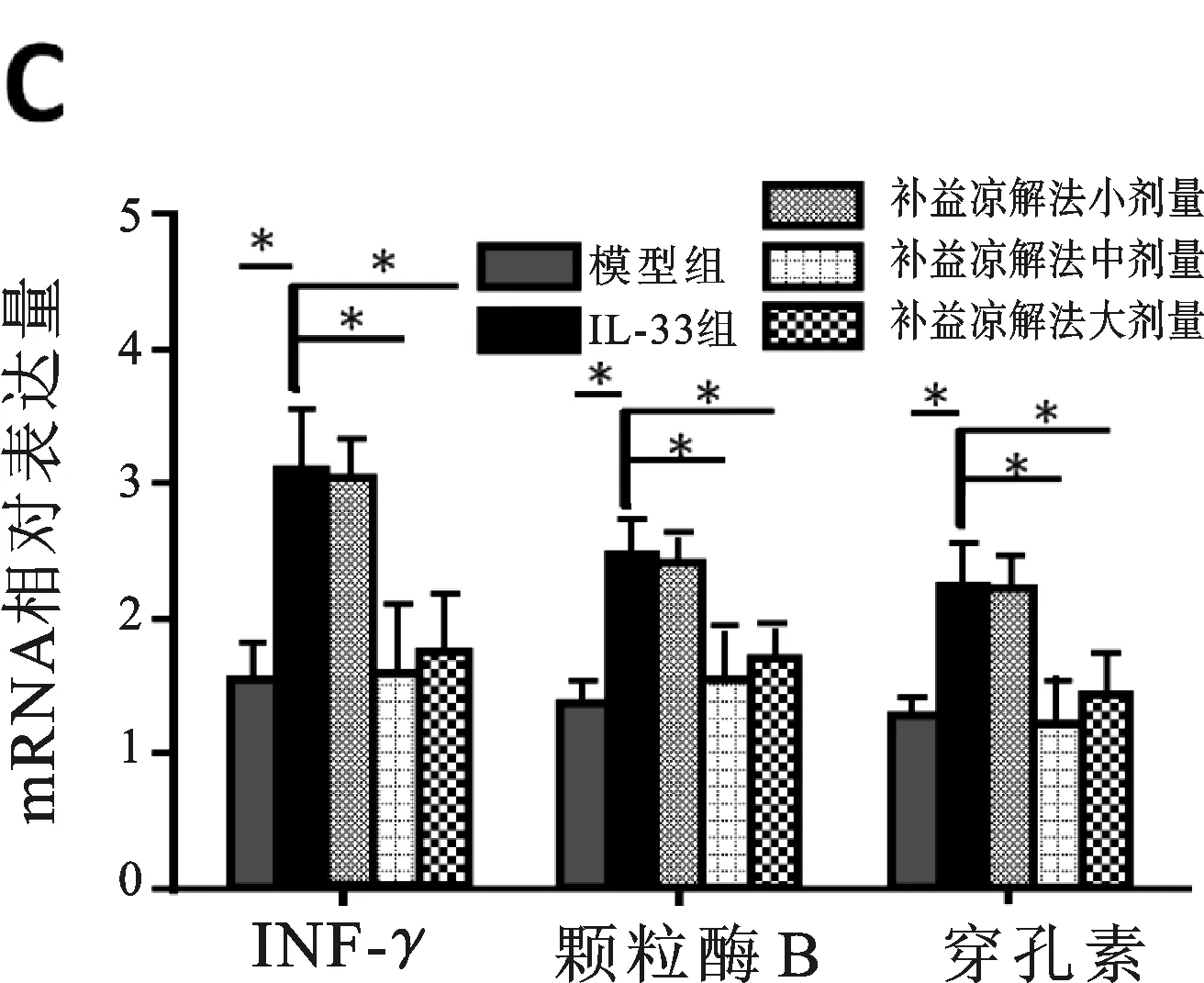
圖3 各組小鼠實驗期間CTL變化圖
3 討論
實驗結果顯示,補益涼解法驅動了肝內和血清1型(IL-2和IFN-γ)免疫應答,原有的細胞因子和趨化因子微環境聚集了大量高活性CD8+和CD4+T細胞至肝內。但是,IL-33/ST2相互作用引起的這種激進的免疫行為并沒有進一步加重肝損傷,從鏡下肝組織嗜酸性小體的明顯減少和血清ALT水平明顯下降來看,它限制了肝損傷的進一步發展。因此,它可能通過某些直接或間接的調節機制,調節著肝臟潛在的保護效應。
IL-33[1~2]是炎癥反應和免疫偏倚的重要調節因子,既可以作為轉錄因子發揮作用,又可以分泌至胞外結合受體,作為細胞因子發揮作用。在不同疾病中,IL-33發揮著不同生物學調節作用,對正常細胞的存活增殖及多種疾病的發病發展都具有重要作用。
研究結果顯示,模型組小鼠IL-33/ST2及ALT、AST均有升高,補益涼解法組(小劑量占優)小鼠肝功能復常,IL-33/ST2也隨之下降,表明IL-33/ST2的升高確與肝臟炎癥有關。
補益涼解法組方原則為涼血滋腎益氣,兼清熱解毒化濕。方中山茱萸、桑寄生、仙茅、女貞子、五味子滋腎,地黃、牡丹皮涼血散血;黃芪、白術健脾益氣;川萆薢、川樸理氣化濕;葉下珠清熱解毒。全方配伍,合清、透、活、補為一體,補中有清,清中有透。現代藥理學研究證實,方中的大多數中藥被證實具有調節免疫和抗病毒的作用。
研究表明山茱萸多糖可明顯提高小鼠腹腔巨噬細胞吞噬百分率和吞噬指數;可顯著促進小鼠溶血素的形成,并顯著促進小鼠淋巴細胞的轉化[3]。山萸與清熱利濕解毒類中藥配伍,可抑制亢進的體液免疫反應。五味子具有護肝降酶,抗菌,提高免疫功能,增強免疫力的作用[4]。黃芪[5]能增強機體免疫力,促進新陳代謝,抑制病毒,殺菌,調節血糖,改善心功能,有保護肝臟,降低血壓等作用[5];白術能促進細胞免疫,抗菌,保護肝臟的作用[6]。生地中其地黃多糖均可使小鼠的脾指數顯著提高,單核巨噬細胞的吞噬功能增強,還可明顯促進T 淋巴細胞增殖,使腹腔巨噬細胞的吞噬活性增強[7]。丹皮酚使小鼠脾臟指數和胸腺指數明顯提高,增強淋巴細胞轉化率,對特異性細胞免疫功能有明顯的作用,增強機體細胞免疫功能[8]。葉下珠有效成分鞣質對 HBeAg具有明顯的抑制作用,多糖類是一種綠色免疫調節劑,它能激活體內免疫細胞,增強機體正氣[9]。其復方制劑及葉下珠提取物均有很好的護肝降酶作用,AST和 ALT明顯下降,肝脾腫大情況明顯緩解。萆薢對小鼠單核巨噬系統的功能有明顯的促進作用。
補益涼解法防護病毒性肝損傷的作用機制可能是通過免疫調節,增強了Th1類細胞因子的表達,下調IL-33/ST2的表達,從而降低肝臟損傷。而補益涼解法對病毒的影響,盡管其清除率較對照組高,但統計學意義不大。

