替格瑞洛和雙倍劑量氯吡格雷對CYP2C19基因突變患者經皮冠狀動脈介入術后心血管缺血事件發生率影響的比較
林樂健,唐發寬,華寧,唐雪正,邸春霞,田玲,岳清如
(解放軍第309醫院心血管內科,北京 100091)
經皮冠狀動脈介入(percutaneous coronary intervention,PCI)治療后再發心血管缺血事件的機制是由多種因素導致的,血小板高反應性導致的阿司匹林以及氯吡格雷抵抗在介導這一復雜機制中占有重要地位[1]。氯吡格雷是一種前體藥物,必須經過肝臟內CYP2C19肝藥酶的代謝,才能發揮抗血小板凝集作用[2]。CYP2C19基因多態性是導致發生硫酸氫氯吡格雷抵抗的重要因素,CYP2C19酶存在多種突變等位基因,中國人群的CYP2C19變異主要是CYP2C19*2和CYP2C19*3兩型,臨床上CYP2C19基因分為野生型(CYP2C19*1/*1)、野生/突變型(CYP2C19*1/*2、CYP2C19*1/*3)和突變型(CYP2C19*2/*2、CYP2C19*2/*3和CYP2C19*3/*3),其中野生型也稱為快代謝型,對氯吡格雷效果好;突變型也稱為慢代謝型,可能會導致對氯吡格雷不敏感。根據不同基因型,個體化增加氯比格雷藥物劑量或者加用其他抗血小板藥物,可能是降低PCI術后心血管缺血事件發生率的有效辦法[3,4]。本課題組的前期工作已經發現,通過長期負荷劑量氯吡格雷的應用,可以改善PCI術后抗血小板治療效果,但心血管缺血事件發生率仍然較高,且出血風險也有所增加[5]。本研究通過快速基因檢測,篩選CYP2C19基因突變患者,分別應用加倍劑量氯吡格雷以及使用替格瑞洛替換兩種治療方案,利用血栓彈力圖儀檢測患者血小板抑制效果,通過臨床隨訪觀察患者PCI術后主要不良心血管事件(major adverse cardiovascular events,MACEs)以及出血事件的發生率,對比研究兩種方案的治療效果,并進一步探討其可能的作用機制,以期為臨床提供可行的個體化治療方案。
1 對象與方法
1.1 研究對象
入選2014年3月至2017年3月在解放軍第309醫院心血管內科住院并擇期行PCI手術的CYP2C19突變型患者240例,其中不穩定心絞痛92例,急性心肌梗死64例,穩定性心絞痛84例。納入標準:(1)入院后即刻靜脈抽血,進行CYP2C19基因型測定,突變基因型為CYP2C19*2/*2、CYP2C19*2/*3或CYP2C19*3/*3;(2)60~70歲。排除標準:(1)2周內發生的急性心肌梗死;(2)對阿司匹林或硫酸氫氯吡格雷有禁忌;(3)凝血酶原時間(prothrombin time,PT)超過正常值的1.5倍;(4)血小板<100×109/L;(5)有出血史;(6)貧血(血紅蛋白<100 g/L);(7)腎功能不全(肌酐> 221 μmol/L)。采用隨機數字表法將入選患者分為2組:氯吡格雷組和替格瑞洛組,每組120例。本研究經解放軍第309醫院倫理委員會批準(批準文號2014MS-004)。
1.2 方法
入院患者常規抽取靜脈血檢查血常規、血液生化指標以及凝血指標。分別于PCI術前以及術后7 d,3、6、12個月抽取外周靜脈血,通過血栓彈力圖儀檢測血小板抑制效果。氯吡格雷組術前至少提前12 h累計服用300 mg阿司匹林及300 mg硫酸氫氯吡格雷,PCI術后阿司匹林100 mg,1次/d,硫酸氫氯吡格雷150 mg,1次/d;替格瑞洛組術前至少提前12 h 累計服用300 mg阿司匹林及180 mg替格瑞洛[7],PCI術后阿司匹林100 mg,1次/d,替格瑞洛90 mg,早晚各1次。
1.2.1CYP2C19基因型測定 CYP2C19*2上游引物:5′-ATTACAACCAGAGCTTGGC-3′;下游引物:5′-AGCATTACTCCTTGACCTGTT-3′。CYP2C19*3上游引物:5′-CCATTATTTAACCAGCTAGGC-3′;下游引物:5′-AATGTACTTCAGGGCTTGG-3′。從外周全血中提取基因組全血DNA。將提取的DNA放于無菌蒸餾水中,在-20°C存儲備用。提取的總DNA在0.8%瓊脂糖凝膠上電泳檢測,紫外檢測其純度與濃度。
1.2.2 血栓彈力圖檢測 5000型血栓彈力檢測儀(Haemoscope公司,美國)檢測血小板抑制效果。主要檢測4項指標,包括:(1)反應時間(R值),即從血液樣本放入小杯至第1塊有意義的可檢測到的血凝塊形成所需要的時間,代表纖維蛋白開始形成的時間;(2)血凝塊形成時間(K值),即從R時間終點至描記圖幅度達20 mm所需的時間,即形成一穩固的血凝塊所需要的時間,代表纖維蛋白形成和交連導致血栓形成后獲得固定的彈性黏度所需時間;(3)Alpha角度(α°),即掃描圖中從R到K值形成的斜角,代表固態血栓形成的速度;(4)最大幅度(maximum amplitude,MA),即描記圖上的最大寬幅度,反映正在形成的血凝塊的最大強度及血栓形成的穩定性,直接反映纖維蛋白和血小板的最大動力性質。本研究使用4個通道檢測MA值,分別是高嶺土通道、激活劑A通道、花生四烯酸(arachidonic acid,AA)通道以及二磷酸腺苷(adenosine diphosphate,ADP)通道[6,7]。血小板抑制率采用下列公式計算:
抑制率(%)=[(MA高嶺土-MAAAor MAADP)/(MA高嶺土-MAA)]×100%。
1.2.3 MACEs及出血事件觀察 觀察患者住院期間和院外12個月隨訪期間MACEs的發生。MACEs包括:因冠狀動脈粥樣硬化性心臟病導致的死亡、經冠脈造影術證實的冠脈支架內血栓再形成、再發的不穩定心絞痛、再發的急性心肌梗死及總發生率[8]。出血事件按照全球梗死相關動脈開通策略(global use of strategies to open occluded coronary arteries,GUSTO)標準分級:(1)嚴重或威脅生命的出血:顱內出血或血流動力學受損且需要干預的出血;(2)中度出血:需要輸血,但不導致血流動力學受損的出血;(3)輕微出血:不符合嚴重和中度出血標準的出血。出現PCI術后出血的患者均使用質子泵抑制劑。
1.3 統計學處理
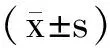
2 結 果
2.1 2組患者基本情況比較
2組患者的臨床基本資料間差異無統計學意義,心血管危險因素基本一致(P>0.05;表1)。
2.2 2組患者PCI治療情況比較
2組患者在冠脈病變部位、植入支架總數量、植入總長度、平均植入支架直徑以及平均植入數量間差異均無統計學意義(P>0.05;表2)。

表1 基線資料比較
BMI: body mass index; CHD: coronary heart disease; AMI: acute myocardial infarction; ACEI: angiotensin converting enzyme inhibitor; ARB: angiotensin receptor blocker; CCB: calcium channel blocker
表22組患者PCI治療情況比較

Table 2 Comparison of PCI treatment between two groups (n=120)
PCI: percutaneous coronary intervention; LAD: left anterior descending coronary artery; LCX: left circumflex artery; RCA: right coronary artery; LMA: left main artery
2.3 2組患者血栓彈力圖檢測結果比較
與氯吡格雷組相比,替格瑞洛組患者的R值和K值顯著增高,而MA值顯著降低,差異均具有統計學意義(P<0.01),2組間α角相比差異無統計學意義(P>0.05;表3)。氯吡格雷組與替格瑞洛組AA藥物抑制率分別為(92.9±3.7)%和(94.1±9.4)%,2組相比差異無統計學意義(P>0.05);ADP藥物抑制率分別為(62.5±5.1)%和(90.3±4.6)%,2組相比差異具有統計學意義(P<0.01)。
表32組患者血栓彈力圖檢測結果比較


ItemClopidogrel groupTicagrelor groupR(s)15.3±2.424.2±2.8??K(s)6.6±1.813.4±2.6??MA(mm)69.5±3.246.2±2.1??α angle(°)55.7±2.456.2±3.4
R: reaction time; K: kinetics; MA: maximum amplitude. Compared with clopidogrel group,**P<0.01
2.4 2組患者MACEs及出血事件發生率比較
替格瑞洛組患者MACEs發生率顯著低于氯吡格雷組(13.3%vs32.5%,P<0.01);但2組患者出血事件發生率(16.7%vs12.5%)間差異無統計學意義(P>0.05;表4)。
表42組患者MACEs及出血事件發生率比較
Table 4 Comparison of major adverse cardiovascular and bleeding events between two groups [n=120,n(%)]

ItemClopidogrel groupTicagrelor groupMACEs Cardiovascular death2(2.5)0(0.0) Stent thrombus10(8.3) 4(3.3) Unstable angina20(16.7)10(8.3) Myocardial infarction7(5.8)2(1.7) Total39(32.5)16(13.3)Bleeding event Severe bleeding0(0.0)1(0.8) Moderate bleeding1(0.8)2(1.7) Minor bleeding14(11.7)17(14.2) Total15(12.5)20(16.7)
MACEs: major adverse cardiovascular events
3 討 論
由于個體差異性,相同劑量藥物使用條件下,患者會產生不同的藥物效果。本研究通過基因檢測的方法,嚴格篩選CYP2C19基因突變的老年患者作為研究對象,有針對性地研究增加硫酸氫氯吡格雷藥物劑量對血小板抑制效果的改善作用,并對比研究了替換替格瑞洛后的抗血小板效果,研究結果表明,CYP2C19基因型突變患者PCI術后加倍劑量(150 mg/d)服用硫酸氫氯吡格雷,藥物抵抗發生率低,血小板抑制效果可以達標,但PCI術后心血管缺血事件發生率仍然偏高;而改為180 mg/d的替格瑞洛,可提高血小板抑制效果,有效降低MACEs發生率,同時并不影響患者出血事件的發生率。
氯吡格雷抵抗被認為是導致PCI術后支架內血栓再形成以及其他心血管缺血事件的重要原因[9]。有研究表明,75 mg/d硫酸氫氯吡格雷從服用后2 h開始產生抑制ADP受體介導的血小板聚集效果,但需要3~7 d才能夠達到最大抑制效果[10]。因此,PCI術前常規一次性使用300 mg甚至是600 mg負荷量以便縮短這一藥物延遲時間,進而獲得更進一步的抗血小板效果。然而,即使使用上述這種標準化的指南性治療方案,仍然不能完全抑制ADP受體介導的血小板聚集。硫酸氫氯吡格雷是一種前體藥物,本身無活性,必須經過肝臟內的CYP2C19肝藥酶的代謝,轉化為具有藥效的活性狀態才具有抗血小板聚集的作用。而CYP2C19代謝活性的個體差異性較大,這也就意味著CYP2C19弱代謝型患者使用硫酸氫氯吡格雷無效或效果欠佳[11]。
替格瑞洛是新一代非噻吩砒啶類P2Y12受體拮抗劑,體內經腸道吸收后直接作用于P2Y12受體,發揮抗血小板作用,無需經肝酶激活,其代謝產物同樣具有P2Y12抑制作用,半衰期更短,起效更快,并可與ADP受體可逆性結合。多項研究表明,與氯吡格雷相比,替格瑞洛可以顯著降低嚴重MACEs發生率[12-14]。本研究結果表明,180 mg/d替格瑞洛能夠顯著改善血小板抑制效果,并減少MACEs的發生。
本研究結果表明,與氯吡格雷組相比,替格瑞洛組患者的R值和K值顯著增高,而MA值顯著降低,差異均具有統計學意義(P<0.01)。這可能為解釋CYP2C19基因型突變者使用替格瑞洛可以提高血小板抑制率提供新的突破口,但其具體作用機制尚有待進一步闡明。
本研究同時觀察了2組患者出血事件發生率,結果表明,2組患者PCI術后12個月內出血事件發生率間差異無統計學意義。這可能與本研究納入患者例數相對較少有關。
綜上所述,篩選CYP2C19基因突變情況,根據結果指導PCI術后個體化用藥具有一定的臨床意義。在CYP2C19基因慢代謝型患者中,150 mg/d硫酸氫氯吡格雷可以使血小板抑制效果達標,但MACEs發生率仍然較高;替格瑞洛能夠有效減低藥物抵抗發生率,進一步改善血小板抑制效果,且可降低MACEs發生率。本研究僅選擇了年齡60~70歲的患者,試驗結果是否適用于高齡患者仍有待進一步研究。

