立位醛固酮腎素比值聯合立位醛固酮對老年原發性醛固酮增多癥的診斷價值
徐媛媛,蔣翠萍,馮強,陶曉明,顧芹,汪海東,孫皎
復旦大學附屬華東醫院內分泌科,上海200040
原發性醛固酮增多癥(primaryaldosteronism,PA)是最常見的繼發性高血壓病因之一,近年來隨著對PA的認識進一步提高及血醛固酮腎素比值(aldosteronerenin ratio,ARR)的廣泛應用,PA的診斷率上升了5~15倍[1]。多項研究發現高血壓患者中PA的發病率達到5%~10%,在難治性高血壓中的發病率可上升至17%~23%[2-4]。該病多見于中青年高血壓患者,但隨著ARR的廣泛使用,老年人PA的發生率也有所增加[5]。
PA是一種可以通過手術或藥物治療而治愈或明顯改善的繼發性高血壓,同時醛固酮的過量分泌可產生部分不依賴于血壓的心腦血管及腎臟損傷[6-7]。多項研究證實與年齡、性別和血壓相匹配的高血壓患者相比,PA患者出現左心室擴大、心肌纖維化、頸動脈內膜增厚及股動脈脈搏波速度上升的比例明顯增高,此外糖代謝異常等風險也明顯增加[6-8]。目前老年高血壓患者中PA的研究甚少,本文分析了近10年來復旦大學附屬華東醫院收治的老年 PA患者資料,探討適用于老年PA的診斷方法。
1 資料與方法
1.1 一般資料 2005年1月—2016年1月收治于復旦大學附屬華東醫院的30例60~75歲老年PA患者設為PA組,其中醛固酮腺瘤7例,雙側特發性醛固酮增多癥23例,男性20例,女性10例,平均(64.9±4.6)歲。同期隨機收集53例60~78歲的老年原發性高血壓(essential hypertension,EH)患者設為EH組,排除腎性高血壓、腎上腺性高血壓及腎血管性高血壓,其中男性33例,女性20例,平均(65.6±5.8)歲。所有患者對檢查過程知情同意。
1.2 研究方法 收治入院的患者進行病史采集,血壓測量,同時檢測血漿腎素活性(臥位+立位)、血醛固酮(臥位+立位)、血尿同步電解質和腎上腺CT等。計算其ARR,所有患者均進行生理鹽水抑制試驗從而進一步確診。
1.2.1 ARR測定[9]所有研究對象入院前均停用保鉀/排鉀利尿劑4周以上,停用血管緊張素轉換酶抑制劑、血管緊張素受體拮抗劑、二氫吡啶類鈣離子拮抗劑和受體阻滯劑2周以上,換用非二氫吡啶類鈣離子拮抗劑或 受體阻滯劑控制血壓。入院后清晨平臥位抽取血醛固酮及腎素,后站立2 h抽取血醛固酮及腎素,計算血醛固酮與腎素比值。
1.2.2 生理鹽水抑制試驗[9]試驗前須臥床休息1 h,早晨8點開始,在4 h內靜脈滴注0.9%的生理鹽水2000L(每小時500mL,滴速恒定),在整個過程中密切監測血壓和心率變化。在靜滴前和靜滴后分別測定血醛固酮及血鉀。鹽水試驗后血醛固酮>100 ng/L為陽性。
1.3 統計學分析 數據均采用SPSS19.0軟件包進行分析。符合正態分布的計量資料以均數±標準差(±s)表示,采用獨立樣本 檢驗;非正態分布的計量資料以中位數(Q1,Q3)表示,采用非參數檢驗;計數資料則以例數表示,采用2檢驗。以老年PA組為病例組,老年EH組為對照組構建ROC曲線,分析ARR切點的靈敏度及特異度。<0.05為差異有統計學意義,均采用雙側檢驗。
2.結果
2.1 老年PA與老年EH患者的一般資料分析 老年PA患者在性別、年齡、高血壓病程及血壓水平上與老年EH患者差異無統計學意義(>0.05)。PA組與EH組相比,臥位/立位血醛固酮水平及ARR升高(<0.01);臥位/立位血漿腎素活性下降 (<0.01)。24例(80%)老年 PA患者有過低血鉀病史,14例(26.4%)老年EH患者有過低血鉀病史,組間比較差異有統計學意義(<0.01)。見表 1。
2.2 ARR的ROC曲線分析 根據患者的臥位及立位ARR值繪制相關ROC曲線,臥位ARR的ROC曲線下面積AUC1為0.867(0.788~0.947),立位ARR 的ROC曲線下面積AUC2為0.864(0.788~0.941),2條曲線與參照線下面積0.5比較,差異均有統計學意義(<0.01),經比較2條 ROC曲線發現它們之間無差異,故認為臥位與立位ARR對篩查PA無差異。見圖1。
以ARR300作為篩查試驗切點的敏感性較高,此時立位ARR的特異性高于臥位ARR,使用立位ARR 300作為老年PA的篩查切點,敏感性為93.3%,特異性為62.3%。見表2。
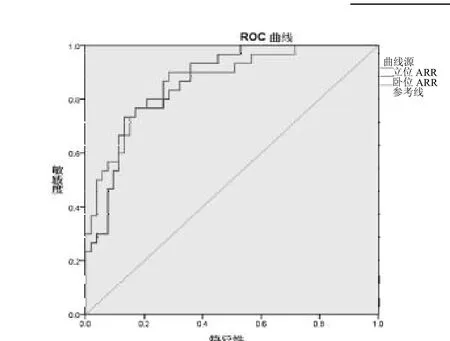
圖1 臥位、立位ARR比值區分老年PA及老年EH患者的ROC曲線
2.3 ARR>300的患者中立位血醛固酮水平分析 老年PA患者中共有28例(93.3%)立位ARR>300,老年EH患者中共有21例(39.6%)立位ARR>300。以ARR300作為切點時,絕大部分老年PA患者立位醛固酮>150 ng/L,同時老年PA患者立位醛固酮>250 ng/L比例顯著高于老年EH患者(<0.01)。見表 3。
對49例ARR>300的患者以臥位醛固酮水平繪制相關 ROC曲線,臥位醛固酮曲線下面積為 0.857(0.755~0.959)。以立位醛固酮水平繪制相關 ROC曲線,立位醛固酮曲線下面積為0.888(0.793~0.982),與參照線下面積0.5比較<0.01,但立位醛固酮曲線下面積更大。見表4。
表4 立位ARR>300的患者以立位醛固酮為切點診斷老年PA的
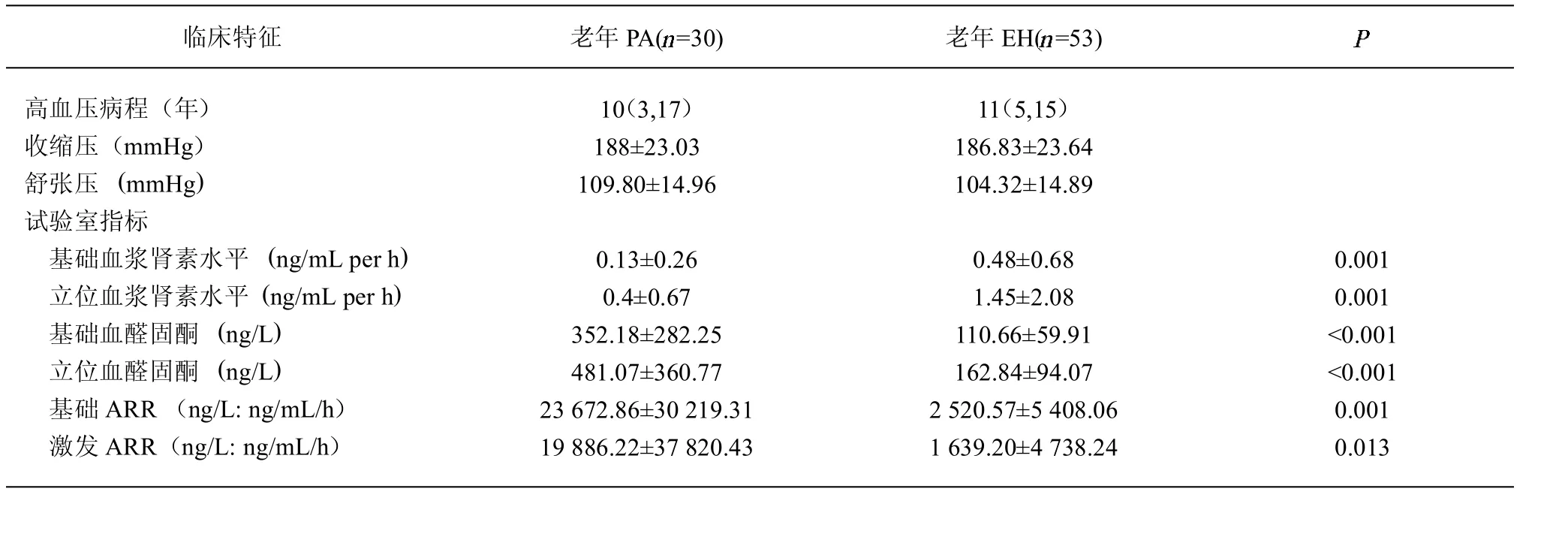
表1 老年PA及老年EH患者一般資料分析

表2 立臥位ARR切點對老年PA診斷的敏感性及特異性(ng/L:ng/mL/h)

表3 立位ARR>300的患者中立位醛固酮不同切點的病例數( ,%)

敏感性及特異性
3 討論
ARR是至今為止公認的最為可靠的PA篩查方法[9],但ARR會被多種因素所影響[10]。隨著年齡的增長,腎素水平下降,年輕PA患者和老年PA患者ARR的診斷切點可能也不盡相同。近期有研究[5]入組了13例老年PA及69例老年EH患者,同時納入了32例非老年PA及41例非老年EH患者,分別比較了老年及非老年患者ARR的切點,發現老年患者ARR的切點為556 ng/L:ng/mL/h,而非老年患者為272 ng/L:ng/mL/h。提示年齡可能對PA的篩查和生理鹽水抑制試驗的切點造成影響,所以建議對不同年齡層的患者診斷 PA時需結合年齡因素。本研究利用ARR繪制ROC曲線,發現當ARR為300作為篩查切點的敏感性較高,同時立位ARR的特異性高于臥位ARR,所以建議使用立位ARR300作為老年PA的篩查切點。
由于ARR的大小主要受腎素水平高低所影響,當血漿腎素活性絕對值<0.1ng/mL/h時,ARR>300的比例明顯升高,但這些患者大多數并非PA患者,為了避免ARR的假陽性率升高,有研究[11]建議結合醛固酮水平>150 ng/L來篩查 PA。但是也有研究[12]證實36%的PA患者血漿醛固酮水平<150ng/L,這其中多數是無優勢分泌的PA患者,這可能導致部分PA患者被漏診。近期頒布的PA指南[9]也建議對自發性低血鉀、血漿腎素低于檢測范圍同時血醛固酮水平>200 ng/L的患者不一定需要進一步行確診試驗。本研究發現在立位ARR>300的患者中,96.4%的老年PA患者立位血醛固酮>150 ng/L,而只有52.3%的老年EH患者立位血醛固酮>150 ng/L,2者差異有統計學意義(<0.01)。對49例ARR>300的患者以立位醛固酮為150ng/L診斷PA,敏感性為96.4%,特異性為42.9%。本研究認為結合立位醛固酮>150ng/L來篩查老年PA可減少ARR假陽性率的產生,使部分患者避免行確診試驗。
Letavernier[13]等研究認為可根據高臥位 ARR(>230 ng/L:ng/mL/h))同時合并高臥位醛固酮(>150 ng/L)或高立位醛固酮(>165ng/L)或高尿醛固酮水平(>25g/d)來診斷PA。老年高血壓患者行生理鹽水抑制試驗的風險較高,出現心力衰竭、惡性高血壓和嚴重低血鉀的比例升高。本研究發現,在立位ARR>300的患者中,75%的老年 PA患者立位醛固酮>250 ng/L,但在老年EH患者中立位醛固酮>250ng/L的患者只有1例(4.8%),差異有統計學意義(<0.01)。對49例ARR>300的患者以立位醛固酮為250ng/L診斷老年 PA,敏感性為64.3%,特異性為95.2%,由于本研究無立位醛固酮水平>300ng/L的老年EH患者入組,故可能夸大了其診斷老年PA的特異性。而老年高血壓患者血壓較難控制,心血管風險較高,無法進一步行確診試驗,可選擇立位醛固酮>250 ng/L來代替確診試驗進一步明確診斷。
綜上所述,立位ARR和臥位ARR都可以作為老年PA患者的篩查方法,但立位ARR的特異性高于臥位ARR。立位ARR300ng/L:ng/mL/h適合作為老年PA的篩查切點,同時可結合立位醛固酮>150ng/L來決定是否進行確診試驗。對無法進行確診試驗的老年患者,可同時結合立位醛固酮絕對值大于250ng/L來初步診斷。
[1] Mulatero P,Stowasser M,Loh KC, .Increased diagnosis ofprimaryaldosteronism,includingsurgicallycorrectableforms,in centers from five continents[J].J Clin Endocrinol Metab,2004,89(3):1045-1050.
[2] Hannemann A,Wallaschofski H.Prevalence of primaryaldosteronism in patient's cohorts and in population-based studies-areview of the current literature[J].Horm Metab Res,2012,44(3):157-162.
[3]RossiGP,BerniniG,Caliumi C, .A prospectivestudyofthe prevalence of primary aldosteronism in 1,125 hypertensive patients[J].J Am Coll Cardiol,2006,48(11):2293-2300.
[4]HannemannA,BidlingmaierM,FriedrichN, .Screeningfor primaryaldosteronism inhypertensivesubjects:resultsfromtwo German epidemiological studies[J].Eur J Endocrinol,2012,167(1):7-15.
[5] Nakama C,Kamide K,Kawai T, .The influence of aging on the diagnosis of primary aldosteronism[J].Hypertens Res,2014,37(12):1062-1067.
[6] Mulatero P,Monticone S,Bertello C, .Long-Term cardioand cerebrovascular events in patients with primary aldosteronism[J].JClinEndocrinolMetab,2013,98(12):4826-4833.
[7] Rossi GP,Bernini G,Desideri G, .Renal damage in primary aldosteronism:results of the PAPY Study[J].Hypertension,2006,48(2):232-238.
[8] Reincke M,Fischer E,Gerum S, .Observational study mortality in treated primary aldosteronism:the German Conn's registry[J].Hypertension,2012,60(3):618-624.
[9] Funder JW,Carey RM,Mantero F, .The management of primaryaldosteronism:casedetection,diagnosis,andtreatment:an endocrine society clinical practice guideline[J].J Clin Endocrinol Metab,2016,101(5):1889-1916.
[10]Stowasser M,hmed AH,Pimenta E, .Factors affecting thealdosterone/reninratio[J].HormMetabRes,2012,44(3):170-176.
[11]Young WF.Primary aldosteronism:Renaissance of a syndrome[J].Clin Endocrinol(Oxf),2007,66(5):607-618.
[12]Stowasser M,Gordon RD.Primary aldosteronism--careful investigation is essential and rewarding[J].Mol Cell Endocrinol,2004,217(1/2):33-39.
[13]Letavernier E,PeyrardS,Amar L, .Bloodpressureoutcome of adrenalectomy in patients with primary hyperaldosteronism withor without unilateral adenoma[J].J Hypertens,2008,26(9):1816-1823.

