替諾福韋與替比夫定阻斷乙型肝炎病毒母嬰傳播效果比較
周佩,鐘曉祝,廖慧華,何建軍,陳春暉
(南方醫科大學珠江醫院,廣州510282)
替諾福韋與替比夫定阻斷乙型肝炎病毒母嬰傳播效果比較
周佩,鐘曉祝,廖慧華,何建軍,陳春暉
(南方醫科大學珠江醫院,廣州510282)
目的比較替諾福韋(TDF)和替比夫定(LdT)阻斷乙型肝炎病毒(HBV)母嬰傳播的效果和安全性。方法選取42例HBeAg陽性、HBV DNA>106IU/mL的孕婦,將其分為TDF組17例和LdT組25例,自妊娠中晚期服藥至分娩。檢測各組治療前和分娩前HBV DNA、ALT水平,觀察藥物不良反應、嬰兒生長發育情況以及母嬰傳播阻斷效果。結果兩組嬰兒7月齡檢測HBsAg均為陰性,乙肝母嬰傳播阻斷率均為100%。除LdT組1例嬰兒出現先天腭裂,其余嬰兒生長發育指標均正常。TDF組和LdT組孕婦治療后HBV DNA水平均較治療前降低(P均<0.05),經等效性檢驗,兩組治療后HBV DNA水平具有等效性(P<0.05)。產前ALT水平較基線水平下降(P均<0.05),兩組ALT復常率比較差異無統計學意義(P>0.05)。兩組孕婦均未出現不良反應。結論TDF和LdT均能降低乙肝孕婦產前HBV DNA水平,阻斷乙肝母嬰傳播效果良好,且較為安全。
乙型肝炎病毒;妊娠;替諾福韋;替比夫定;母嬰傳播
我國屬于乙型肝炎病毒(HBV)感染高流行地區,母嬰傳播是HBV重要的傳播方式。若未采取任何預防措施,HBeAg陽性、高病毒載量的孕婦所生新生兒HBV感染率高達80%~90%[1]。即使通過乙肝疫苗和乙肝免疫球蛋白聯合預防,也仍有8%~15%預防接種無效,發生乙肝母嬰傳播[2~4]。研究顯示,高病毒載量的孕婦服用核苷(酸)類似物能夠降低母體HBV DNA載量,顯著降低母嬰傳播發生率[5~7]。目前用于治療乙肝的核苷(酸)類似物很多,但僅有替諾福韋(TDF)和替比夫定(LdT)屬于妊娠B級藥物,可用于乙肝孕婦的治療[8,9]。由于TDF在我國上市時間短,在中國乙肝孕婦中的研究數據尚不多,關于TDF和LdT抗病毒療效是否有差異也少有報道。本研究對乙肝孕婦應用TDF和LdT治療進行回顧性分析,為阻斷HBV母嬰傳播提供更準確和可靠的臨床依據。
1 資料與方法
1.1 臨床資料 選取2015年7月~2016年7月在本院隨訪分娩的慢性乙肝病毒感染孕婦42例,均符合《慢性乙型肝炎防治指南》[10]中的診斷標準。根據患者選用的抗病毒藥物分成TDF組和LdT組,TDF組17例,年齡(29.8±4.5)歲,初始用藥孕周(26.2±3.8)周,藥物暴露時間(10.7±4.5)周;LdT組25例,年齡(28.9±4.3)歲,初始用藥孕周(25.9±4.0)周,藥物暴露時間(10.1±4.1)周。納入標準:①HBeAg陽性,HBV DNA>1×106IU/mL;②治療前無乙肝抗病毒治療史;③自愿接受抗病毒治療;④按時隨訪,完成相關檢查項目。排除標準:①合并其他病毒感染,如HAV、HCV、HIV感染;②合并其他肝病,如自身免疫性肝病、酒精性肝病等;③合并心血管、泌尿系等其他系統慢性疾病。兩組年齡、初始用藥孕周、藥物暴露時間具有可比性。本研究通過醫院倫理委員會審查,入選孕婦均簽署知情同意書。
1.2 治療方法 TDF組給予TDF(葛蘭素史克)300 mg/次口服,LdT組給予LdT(諾華制藥有限公司)600 mg/次口服,1次/d,均從妊娠中晚期開始服藥至分娩。嬰兒出生24 h內注射乙肝免疫球蛋白100 IU,并于出生24 h內、1月齡及7月齡時分別接種乙肝疫苗10 μg。
1.3 觀察指標及檢測方法 ①血清HBV DNA檢測:于治療前、治療后(分娩前)抽取孕婦外周血4 mL,取血清用Light Cycler擴增儀Taqman熒光PCR檢測HBV DNA,試劑盒購自瑞士羅氏制藥公司,檢測下限為500 IU/mL。②血清ALT檢測:于治療前、治療后(分娩前)抽取孕婦外周血4 mL,取血清用Aeroset生化分析儀(中山標佳生物有限公司)、速率法檢測ALT水平,正常值參考范圍4~40 U/L。③母嬰傳播阻斷效果:嬰兒在7月齡時抽取外周血4 mL,取血清用酶聯免疫吸附法檢測乙肝標志物,HBsAg陰性為阻斷成功。④嬰兒生長發育情況:觀察嬰兒出生時Apgar評分、體質量、身長、出生缺陷等。⑤不良反應:觀察孕期服用抗病毒藥物的不良反應,如胃腸道反應、肌酸激酶升高、腎功能損害等。
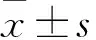
2 結果
2.1 兩組治療前后血清HBV DNA水平比較 治療前兩組血清HBV DNA水平比較差異無統計學意義(P>0.05),治療后兩組產前HBV DNA均較治療前降低(P均<0.05),組間比較差異無統計學意義(P>0.05)。進一步行等價檢驗,兩組治療后HBV DNA水平具有等效性(P<0.05)。見表1。

表1 兩組治療前后
2.2 兩組治療前后血清ALT水平比較 治療前TDF組ALT水平中位數為20(11.0~83.0)U/L,LdT組為35(12.0~76.0)U/L,兩組治療前ALT比較差異無統計學意義(P>0.05);治療后TDF組ALT水平中位數為16(10.5~21.0)U/L,LdT組為18(10.0~24.5)U/L,兩組產前ALT較治療前均下降(P均<0.05)。TDF組治療前6例ALT異常,治療后0例異常,ALT復常率為100%;LdT組治療前10例ALT異常,治療后1例異常,ALT復常率為90%,兩組ALT復常率比較差異無統計學意義(P>0.05)。
2.3 兩組母嬰傳播阻斷效果 兩組嬰兒7月齡時檢測乙肝標志物,HBsAg均為陰性,HBsAb均為陽性,母嬰傳播阻斷率為100%。
2.4 兩組嬰兒生長發育情況 分娩后所有嬰兒Apgar評分均為9分。TDF組嬰兒體質量(3 182.94±473.97)g,身長(50.14±1.79)cm,未觀察到先天缺陷;LdT組嬰兒體質量(3 041.20±491.79)g,身長(49.00±2.78)cm,1例嬰兒出現先天腭裂;兩組嬰兒各生長發育指標比較差異均無統計學意義(P均>0.05)。
2.5 兩組不良反應情況 治療期間,TDF組和LdT組孕婦無任何不適,耐受情況較好,無孕婦因不良反應終止用藥。未觀察到與用藥相關的實驗室指標異常情況。
3 討論
母嬰傳播是我國HBV慢性感染的主要傳播模式,采用乙肝疫苗和乙肝免疫球蛋白聯合預防可顯著降低新生兒乙肝感染率。但目前高乙肝病毒載量孕婦所生嬰兒仍有8%~15%預防接種無效,發生乙肝母嬰傳播。流行病學研究證實,HBV DNA載量高于1×106IU/mL是母嬰傳播的獨立危險因素[10,11]。既往有研究報道,當HBV DNA>1×108IU/mL時,母嬰傳播率為43.0%,HBV DNA<1×106IU/mL時,母嬰傳播率下降30.0%,而當HBV DNA<104IU/mL時,傳播風險將低至6.0%以下[12]。因此,降低HBV DNA水平是阻斷乙肝母嬰傳播的關鍵措施之一。亞太肝病學會(APASL)[13]、歐洲肝病學會(EASL)[14]推薦,HBV DNA>1×106IU/mL的高病毒載量乙肝孕婦,在妊娠中晚期可應用核苷(酸)類似物阻斷HBV母嬰傳播。TDF和LdT屬于核苷(酸)類似物,通過抑制病毒復制過程中聚合酶和轉錄酶的活性發揮抗病毒作用,臨床前研究尚未觀察到對胚胎和胎兒發育造成不良影響,因此可用于乙肝孕婦。目前TDF和LdT已被美國食品藥品管理局(FDA)列為妊娠B級藥物,被證實能夠降低母體HBV DNA水平,妊娠期使用是安全的[8,9]。
既往文獻報道,HBV DNA治療前后水平及變化在抗HBV中有很好的預測價值[15];妊娠期抗病毒藥物暴露時間較長的孕婦,分娩時病毒載量更低[16]。本研究結果顯示,兩組孕婦產前HBV DNA水平均較治療前下降,兩組治療后HBV DNA水平具有等效性,提示對于HBeAg陽性、HBV DNA>1×106IU/mL的乙肝孕婦,于妊娠中晚期開始應用TDF和LdT至分娩均能有效抑制HBV復制,兩藥療效具有等效性。但本研究病例數尚少,還有待繼續積累樣本進一步觀察。
本研究中,TDF組和LdT組嬰兒完成乙肝疫苗全程接種后,于7月齡時檢測乙肝標志物,嬰兒HBsAg均為陰性,母嬰傳播阻斷率為100%。說明高病毒載量乙肝孕婦經過TDF和LdT抗病毒治療后,乙肝母嬰傳播的發生率進一步下降。
本研究中,部分孕婦妊娠中后期ALT輕度升高,考慮與妊娠期體內激素水平波動有關,后期多可自行恢復。服藥期間所有孕婦未出現藥物不良反應,嬰兒出生后的生長發育指標無異常。LdT組1例嬰兒出現先天腭裂,但該孕婦在妊娠中晚期服藥,此時胎兒的器官發育已經完成,且既往研究提示LdT無致突變性和無致畸性[2],不會對胚胎和胎兒的生長發育造成不良后果,故不能肯定該嬰兒先天缺陷與藥物相關。以上結果表明,孕期服用TDF和LdT抗病毒治療是較安全的。
綜上所述,TDF和LdT都能降低HBeAg陽性、HBV DNA>1×106IU/mL的乙肝孕婦產前HBV DNA水平,阻斷乙肝母嬰傳播效果良好,且較為安全,孕婦可根據自身的病情及經濟能力個體化選擇藥物。
[1] Centers for Disease Control and Prevention(CDC).Assessing completeness of perinatal hepatitis B virus infection reporting through comparison of immunization program and surveillance data-United State[J]. Morb Mortal Wkiy Rep, 2011,60(13):410-413.
[2] Zou H, Chen Y, Duan Z, et al. Virologic factors associated with failure to passive-active immunoprophylaxis in infants born to HBsAg-positive mothers[J]. J Viral Hepat, 2012,19(2):1365-2893.
[3] Han GR, Cao MK, Zhao W, et al. A prospective and open-label study for the efficacy and safety of telbivudine in pregnancy for the prevention of perinatal transmission of hepatitis B virus infection[J]. J Hepatol, 2011,55(6):1215-1221.
[4] Wu Q, Huang H, Sun X, et al. Telbevudine prevents vertical transmission of hepatitis B virus from women with high viral lords: a prospective long-term study[J]. Clin Gastroenterol Hepatol, 2015,13(6):1170-1176.
[5] Zhang H, Pan CQ, Pang Q, et al. Telbivudine or lamivudine use in late pregnancy safely reduces perinatal transmission of hepatitis B virus in real-life practice[J]. Hepatology, 2014,60(2):468-476.
[6] Jourdain G, Ngo-Giang-Huong N, Cressey TR, et al. Prevention of mother-to-child transmission of hepatitis B virus: a phase Ⅲ, placebo-controlled, double-blind, randomized clinical trial to assess the efficacy and safety of a short course of tenofovir disoproxil fumarate in women with hepatitis B virus e-antigen[J]. BMC Infect Dis, 2016,16:393.
[7] Pan CQ, Han GR, Jiang HX, et al. Telbivudine prevents vertical transmission from HBeAg-positive women with chronic hepatitis B[J]. Clin Gastroenterol Hepatol, 2012,10:520-526.
[8] But DY, Yuen MF, Fung J, et al. Safety evaluation of telbivudine[J]. Expert Opin Drug Saf, 2010,9(5):821-829.
[9] A Working Group of the Office of AIDS Research Advisory Council (OARAC). Recommendations for useofantiretroviraldrugsinpregnantHIV-1-infected womenformaternal healthandinterventionstoreduceperinatal HIV-1 transmission in the United States[EB/OL].2015.
[10] 中華醫學會肝病學分會,中華醫學會感染病學分會.慢性乙型肝炎防治指南(2015更新版)[J].中華肝臟病雜志,2015,23(12):888-905.
[11] Liu CP, Zeng YL, Zhou M, et al. Factors associated with mother-to-child transmission of hepatitis B virus despite immunoprophylaxis[J]. Intern Med, 2015,54(7):711-716.
[12] Zhang RL, Luo Y, Xie JX, et al. A correlation analysis between the rate of vertical transmission of HBV and HBsAg-positive father to infant and the rate of neonatal cord blood HBV-DNA[J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2010,31(2):159-162.
[13] Liao YF,Kao JH,Piratvisuth T,et al. Asian-Pacific consensus statement on the management of chronichepatitis B: a 2012 update[J]. Hepatol Int, 2012,6(3):531-561.
[14] European Association for the Study of the Liver. EASL clinical practice guidelines: management of chronic hepatitis B virus infection[J]. J Hepatol, 2015,57(1):167-185.
[15] Lee S, Park JY, Kim do Y, et al. Prediction of virologic response to tenofovir mono-rescue therapy for multidrug resistant chronic hepatitis B[J]. J Med Virol, 2016,88(6):1027-1034.
[16] Yi W, Pan CQ, Liu M, et al. Clinical outcomes of tenofovirdisoproxil fumarate(TDF) treatment versus no treatment for pregnant women with active chronic hepatitis B(CHB) and elevated alanine aminotransaminase(ALT)[J]. Hepatology, 2014,60(S1):1088-1128.
10.3969/j.issn.1002-266X.2017.42.030
R512.6
B
1002-266X(2017)42-0091-03
中國肝炎防治基金會資助項目(TG1509XBK)。
鐘曉祝(E-mail: 569418126@qq.com)
2017-04-28)

