大劑量阿托伐他汀在冠狀動脈臨界病變患者中的應用效果觀察
龔厚文,許鋒成,余朝萍,藍亞平,晏明君,劉天虎
(成都市郫都區人民醫院,成都611730)
大劑量阿托伐他汀在冠狀動脈臨界病變患者中的應用效果觀察
龔厚文,許鋒成,余朝萍,藍亞平,晏明君,劉天虎
(成都市郫都區人民醫院,成都611730)
目的觀察冠狀動脈臨界病變患者應用大劑量阿托伐他汀治療的臨床效果。方法選取221例經過冠狀動脈造影證實的冠狀動脈臨界病變患者,隨機分為觀察組111例和對照組110例,分別給予阿托伐他汀40、10 mg/d口服治療。觀察兩組1年內血脂達標率、高敏C反應蛋白(hs-CRP)水平,急性心血管事件的發生情況及他汀相關不良反應發生情況。結果與治療前相比,兩組治療后TC、LDL-C、TG水平均下降,且觀察組TC、LDL-C、TG低于對照組(P<0.05或<0.01),血脂達標率高于對照組(P<0.01);兩組hs-CRP均下降,觀察組低于對照組(P<0.05或<0.01)。隨訪期間,觀察組發生急性心血管事件5例,對照組為16例,觀察組少于對照組(P<0.05)。兩組不良反應發生率比較無統計學差異(P>0.05)。結論大劑量阿托伐他汀能有效降低冠狀動脈臨界病變患者的血脂水平和炎癥水平,穩定易損動脈粥樣硬化斑塊,減少急性心血管事件發生,治療安全可靠。
阿托伐他汀;冠狀動脈粥樣硬化;急性心血管事件;血脂;高敏C反應蛋白
冠狀動脈臨界病變是指冠狀動脈造影測定的冠狀動脈狹窄程度50%~70%的冠狀動脈病變,在冠狀動脈造影及冠狀動脈介入治療(PCI)中較為常見[1]。據報道[2],臨界病變中的6%會在1年內發展為急性冠狀動脈事件,需要介入治療;87%需要介入治療的罪犯病變是先前造影小于60%的臨界病變。因此,臨界病變在冠心病的防治中占有重要地位。雖然臨界病變的介入治療成功率相對較高,但由于介入本身會產生并發癥,并存在再狹窄的風險,因此藥物治療顯得尤為重要。相關研究[3]顯示,脂質代謝紊亂、炎性反應均參與了動脈粥樣硬化并加重血管狹窄。他汀類藥物具有降脂、抗炎癥、抗動脈粥樣硬化等作用。本研究選取221例冠狀動脈臨界病變患者,分別采用大劑量和常規劑量阿托伐他汀治療,觀察對冠狀動脈臨界病變的影響。
1 資料與方法
1.1 臨床資料 選取2014年9月~2016年3月我院收治的穩定型心絞痛患者221例,男149例、女72例,年齡37~70(63.11±7.67)歲。均行冠狀動脈造影檢查證實為冠狀動脈臨界病變,冠狀動脈狹窄程度50%~70%,且為單支病變。排除嚴重的心、肝、腎功能不全患者以及他汀類藥物過敏的患者,兩組服用阿司匹林、氯吡格雷、美托洛爾、硝酸酯類藥物、血管緊張素轉換酶抑制劑及降糖藥無明顯差異。將其按照數字表法分為觀察組111例和對照組110例。觀察組男72例、女39例,年齡(62.19±8.47)歲,病變位于前降支64例、回旋支23例、右冠狀動脈24例,合并高血壓31例、糖尿病27例;對照組男77例、女33例,年齡(63.53±7.02)歲,病變位于前降支65例、回旋支24例、右冠狀動脈21例,合并高血壓32例、糖尿病30例。兩組臨床資料具有可比性。
1.2 治療方法 觀察組給予阿托伐他汀40 mg/d口服,對照組給予阿托伐他汀10 mg/d口服。
1.3 血脂、高敏C反應蛋白(hs-CRP)檢測方法 入院次日采集患者清晨空腹外周靜脈血8 mL,EDTA抗凝,離心取上清液。用OLYMPUS2700型全自動生化分析儀測定血脂、hs-CRP。每3個月復查1次。治療12個月后參考中國成人血脂異常防治指南(2016年修訂版)將LDL-C作為干預靶點,LDL-C<1.8 mmol/L或LDL-C較基線至少降低50%為血脂達標[4]。
1.4 預后及不良反應觀察方法 隨訪1年。每3個月對患者進行電話及門診隨訪1次,詢問患者急性心血管事件的發生情況,急性心血管事件包括不穩定型心絞痛、非ST段抬高型心肌梗死、ST段抬高型心肌梗死、猝死。觀察用藥期間與他汀有關的不良反應,包括轉氨酶升高、橫紋肌溶解等。
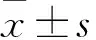
2 結果
2.1 兩組治療前后血脂及hs-CRP水平比較 見表1。兩組治療后TC、LDL-C水平均較治療前下降(P均<0.01),觀察組TC、LDL-C水平低于對照組(P均<0.05)。隨訪1年,觀察組血脂達標87例,達標率78.38%;對照組血脂達標45例,達標率40.90%。觀察組血脂達標率高于對照組(P<0.05)。兩組hs-CRP均較治療前下降(P均<0.01),觀察組較對照組降低(P<0.05)。
2.2 兩組急性心血管事件發生情況比較 觀察組發生不穩定型心絞痛2例,非ST段抬高型心肌梗死2例,ST段抬高型心肌梗死1例,急性心血管事件發生率為4.50%;對照組分別為11、4、1例及14.55%。觀察組急性心血管事件發生率較對照組降低(P<0.05)。

表1 兩組治療前后血脂及hs-CRP比較
注:與同組治療前比較,▲P<0.01;與對照組治療后比較,△P<0.05。
2.3 兩組不良反應比較 觀察組發生轉氨酶升高3例,對照組為1例,兩組不良反應發生率比較無統計學差異(P>0.05)。
3 討論
在臨床上,冠狀動脈臨界病變的發生率遠高于狹窄程度>70%的顯著病變。在冠心病的治療評價中,冠狀動脈造影狹窄程度>70%的病變被認為可引起明顯的心肌缺血,因此主張對其進行介入治療或旁路手術。而對于臨界病變如何治療,目前報道較少。冠狀動脈臨界病變中往往存在不穩定動脈粥樣硬化斑塊,而不穩定的動脈粥樣硬化斑塊的發病機制是斑塊內出血、破裂,使血小板在局部激活聚集,同時炎癥參與,繼而血栓形成,導致急性冠狀動脈綜合征(ACS)。流行病學資料顯示,60%~70%的ACS患者的基礎病變狹窄程度在30%~70%,表明多數ACS患者是由無血流動力學意義的輕中度狹窄所引起的。Smith在1996年發表于Circulation的4個研究的數據顯示,導致急性心肌梗死(AMI)的病變中大約70%為<50%的狹窄。他汀類藥物具有降脂、穩定斑塊、抗炎癥、抗動脈粥樣硬化等作用[12]。中國患者的首個前瞻性隨機對照研究CCSPS研究發現,常規劑量組較安慰劑組冠心病事件減少45.1%,總死亡危險降低33%,兩組LDL-C降幅相差17.6%。PROVE-IT研究結果顯示,大劑量他汀組能夠降低再次血運重建,減少因心絞痛再次住院,治療效果明顯優于常規劑量組,主要終點事件下降16%。研究表明,大劑量他汀治療可進一步減少心血管死亡和心肌梗死等事件。Tungsubutra等[5]研究顯示,大劑量他汀治療可減少冠心病患者急性心血管事件。Karlson等[6]研究發現,長期使用大劑量他汀使冠心病患者明顯獲益,減少心血管死亡、非致死性心肌梗死、血運重建、缺血性卒中、不穩定性心絞痛或心力衰竭惡化住院。COURAGE臨床試驗研究顯示,PCI治療并不比大劑量他汀類藥物治療更有效地改善穩定型心絞痛患者的病死率、非致死性心肌梗死及急性冠狀動脈綜合征的發生率等遠期預后。Latacz等[7]回顧性分析了232例造影診斷的臨界病變患者,分為介入治療組和藥物組,12個月隨訪發現介入治療組有13%因再狹窄需要再次介入治療,而藥物組僅有4%因癥狀反復發作接受了血運重建;心絞痛復發率在介入治療組更高。另有研究[8~10]顯示,與常規劑量他汀類相比,冠心病患者大劑量他汀治療可進一步降低心血管事件。Nissen等[11]研究認為,他汀類藥物治療可逆轉冠狀動脈粥樣硬化斑塊。這意味著導致AMI等嚴重后果的病變中臨界病變占很高比例,這部分人群可能存在猝死風險。因此,對臨界病變的判斷和研究十分重要。
本研究對冠狀動脈臨界病變患者應用不同劑量的阿托伐他汀治療1年,兩組TC、LDL-C、TG、hs-CRP均降低,觀察組降低更明顯;在其他治療措施相似的情況下,觀察組急性心血管事件的發生率較對照組降低,其原因與血脂控制達標、炎癥因子水平更低、易損斑塊穩定有直接關系。而大劑量他汀也并未增加藥物不良反應,表明該方案治療冠狀動脈臨界病變患者安全可靠。
綜上所述,大劑量阿托伐他汀能有效降低冠狀動脈臨界病變患者的血脂水平和炎癥水平,穩定易損動脈粥樣硬化斑塊,減少急性心血管事件的發生,具有臨床推廣價值。
[1] 陳紀林,延榮強.冠狀動脈臨界病變介入治療的新思路[J].中國循環雜志,2013,28(2):81-82.
[2] Glaser R, Selzer F, Faxon DP, et al. Clinical progression of inciden- tal,asymptomatic lesions discovered during culprit vessel coronary intervention[J]. Circulation, 2005,111:143-149.
[3] 劉寧.冠狀動脈臨界病冠心病患者應用腦心通膠囊對炎性反應及預后影響分析[J].海峽藥學,2014,18(9):111-113.
[4] 中國成人血脂異常防治指南(2016年修訂版)[J].中華心血管病雜志,2016,31(10):940-941.
[5] Tungsubutra W, Phongtuntakul B. Achievement of LDL-cholesterol goal with statins after an st segment elevation myocardial infarction[J]. J Med Assoc Thai, 2015,98(2):129-136.
[6] Karlson BW, Palmer MK, Nicholls SJ, et al. To what extent do high-intensity statins reduce low-density lipoprotein cholesterol in each of the four statin benefit groups identified by the 2013 American College of Cardiology/American Heart Association guidelines? A VOYAGER meta-analysis[J]. Atherosclerosis, 2015,241(2):450-454.
[7] Latacz P, Rostoff P, Gackowski A, et al. Comparison of the efficacy and safety of pharmacological treatment versus percutaneous coronary angioplasty in patients with intermediate coronary artery lesions[J]. Kardiol Pol, 2009,67(8A):1004-1012.
[8] LaRosa JC, Grundy SM, Waters DD, et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease[J]. N Engl J Med, 2005,352:1425-1435.
[9] Schwartz GG, Olsson AG, Ezekowitz MD, et al. Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled trial[J]. JAMA, 2001,285:1711-1718.
[10] Pedersen TR, Faergeman O, Kastelein JJ, et al. High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial[J]. JAMA, 2005,294:2437-2445.
[11] Nissen SE, Nicholls SJ, Sipahi I, et al. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial[J]. JAMA, 2006,295:1556-1565.
[12] Puri R, Nissen SE, Shao M, et al. Impact of baseline lipoprotein and C-reactive protein levels on coronary atheroma regression following high-intensity statin therapy[J]. Am J Cardiol, 2014,114(10):1465-1472.
10.3969/j.issn.1002-266X.2017.42.020
R541.4
B
1002-266X(2017)42-0062-03
劉天虎(E-mail: lthzgl@163.com)
2017-04-26)

