模擬外周靜脈PICC置管聯合5-FU對人臍靜脈內皮細胞增殖及遷移的影響
趙艷杰,王彥茹,吳蘭華,陳玲,賴麗君,林素蘭
(新疆醫科大學,烏魯木齊830000)
模擬外周靜脈PICC置管聯合5-FU對人臍靜脈內皮細胞增殖及遷移的影響
趙艷杰,王彥茹,吳蘭華,陳玲,賴麗君,林素蘭
(新疆醫科大學,烏魯木齊830000)
目的觀察模擬外周靜脈置入中心靜脈導管(PICC)置管聯合5-氟尿嘧啶(5-FU)對人臍靜脈內皮細胞增殖和遷移的影響,探討其損傷靜脈內皮細胞的機制。方法將體外培養2~3代的人臍靜脈內皮細胞隨機分成對照組、PICC損傷組、5-FU損傷組、聯合損傷組,對照組加入完全培養基,PICC損傷組模擬PICC置管損傷(把PICC導管切成小段,用消毒槍頭對貼壁細胞進行劃痕,與細胞一起培養),5-FU損傷組模擬5-FU外滲損傷(將5-FU配制成4 μL/mL溶液,與細胞一起培養),聯合損傷組模擬PICC置管損傷+5-FU外滲損傷。培養0、5、10、30、60、120 min后,觀察各組細胞形態變化,采用MTT比色法檢測細胞增殖活性,ELISA法檢測血管性假性血友病因子(vWF)表達水平;細胞劃痕法誘導24 h后,觀察各組細胞遷移能力。結果鏡下觀察對照組細胞形態為不規則的梭形,胞質飽滿、排列緊密,各模擬組細胞形態均有不同程度的收縮、變圓、胞質皺縮,細胞脫落,模擬PICC置管損傷組細胞形態改變最輕,模擬PICC置管聯合5-FU損傷組最為顯著。與對照組比較,各模擬組細胞活性降低、細胞遷移能力降低,模擬PICC置管聯合5-FU損傷組細胞活性、細胞遷移能力較其他各組均降低(P均<0.05)。各模擬組培養30 min后細胞培養上清液中vWF水平均明顯升高,模擬PICC置管聯合5-FU損傷組vWF水平較其他各組均升高(P均<0.05)。結論PICC置管聯合5-FU能夠損傷人臍靜脈內皮細胞,降低細胞增殖活性,抑制細胞遷移;該作用可能與其刺激細胞產生vWF有關。
中心靜脈導管;5-氟尿嘧啶;人臍靜脈內皮細胞;血管性假性血友病因子;細胞增殖;細胞遷移;體外實驗
目前,經外周靜脈置入中心靜脈導管(PICC)已廣泛用于長期靜脈輸液、反復輸入血制品、靜脈高營養、化療等患者。PICC在為臨床治療提供方便的同時,因反復置管、長期留置和護理不當等,會對患者的靜脈血管壁造成機械性刺激[1],再加上化療藥物外滲,對血管造成嚴重損傷,常導致靜脈血栓、靜脈炎等相關并發癥[2,3]。既往研究[4]表明,導管留置時間、血管損傷、內皮細胞凋亡三者呈正相關。血管內皮細胞是構成血管內膜層的主要成分,它能通過合成和釋放多種血管活性因子,在血管的病理、生理中發揮重要作用[5]。血管性假性血友病因子(vWF)是鑒定內皮細胞受到刺激或損傷的特異性標志物,其表達量可反映內皮細胞損傷程度[6]。研究顯示,PICC置管、5-氟尿嘧啶(5-FU)外滲會對血管造成嚴重損傷,但其機制尚不明確,而內皮細胞的病理生理功能又是血管損傷修復的第一步。2017年1~6月,我們通過體外培養人臍靜脈內皮細胞,觀察PICC置管聯合5-FU對細胞活力、細胞遷移能力及細胞培養上清液中vWF表達水平的影響,探討PICC、5-FU導致血管損傷的機制。
1 材料與方法
1.1 材料 人臍靜脈內皮細胞EA.HY926細胞株購于上海拜力生物科技有限公司,高糖培養基(DMEM)、雙抗、胰蛋白酶均購自美國Hyclone公司。胎牛血清購自美國Gibco公司。PICC導管購自美國巴德公司。5-FU購自上海旭東海普藥業有限公司。96孔板購自美國康寧公司。四甲基偶氮唑藍(MTT)、二甲基亞砜(DMSO)購自美國Sigma公司。CO2培養箱、酶標儀購自奧地利SUNEISE。
1.2 細胞培養與分組處理 將細胞用含有10%胎牛血清、5%雙抗與DMEM的完全培養基,置于37 ℃、5% CO2培養箱中培養,待細胞生長到80%~90%融合時,加入0.25%胰蛋白酶消化傳代,取2~3代用于實驗。把PICC導管切割成均勻的1 mm小段,用10 μL消毒槍頭對貼壁細胞進行劃痕,與細胞一起培養來模擬PICC置管對血管的損傷。按人體表面積給藥,將5-FU配制成4 μL/mL溶液,與細胞一起培養來模擬藥物外滲對血管的損傷。將細胞分為4組,對照組加入完全培養基,PICC損傷組模擬PICC置管損傷,5-FU損傷組模擬5-FU外滲損傷,聯合損傷組模擬PICC置管損傷+5-FU外滲損傷。
1.3 細胞增殖活性觀察 采用MTT比色法。將EA.HY926細胞制成單細胞懸液,以100 μL/孔接種于96孔板。繼續培養24 h,使細胞同步化,洗去未貼壁的細胞。將細胞分為4組,處理方法按1.2,每組設6個復孔。培養0、5、10、30、60、120 min后,加入5 g/L MTT 10 μL繼續培養4 h,小心吸除并保留原培養液,用于vWF檢測。再在各孔中加入150 μL DMSO,置于酶聯免疫檢測儀內,于490 nm波長處檢測各孔的光密度(OD)值。通過OD值比較各模擬組與對照組細胞增殖活性的變化。
1.4 細胞遷移能力觀察 采用劃痕法。將EA.HY926細胞制成單細胞懸液,按2 mL/孔接種于6孔板。待細胞長滿后,取消毒的200 μL槍頭,垂直進行細胞劃痕。PBS洗滌3次,去除劃下的細胞。將細胞分為4組,處理方法按1.2。繼續培養24 h后,用顯微鏡拍攝24 h時的細胞劃痕圖像(50×),用IPP軟件計算細胞遷移率。
1.5 細胞培養上清液中vWF檢測 取4組細胞培養上清液,用0.22 μm針式濾器抽濾,按照ELISA試劑盒說明書檢測vWF水平。
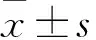
2 結果
2.1 各組細胞形態學比較 倒置相差顯微鏡下可見,對照組細胞呈不規則的梭形,細胞核呈橢圓或圓形,偶見雙核,胞質飽滿豐富,細胞邊界清楚,細胞較多、密集,單層融合時呈典型的“鋪路石”樣。PICC損傷組多數細胞胞質飽滿豐富,少數細胞收縮、變圓,細胞邊界不清楚,間隙增寬,較少有細胞脫落。5-FU損傷組多數細胞胞質不甚飽滿且不豐富,細胞收縮、變圓,細胞邊界不清楚,間隙增寬,有較多細胞脫落。聯合損傷組較多細胞胞質空癟貧乏,細胞收縮、變圓,細胞邊界不清楚,間隙增寬,隨處可見細胞脫落。
2.2 各組細胞增殖活性比較 與對照組相比,PICC損傷組、5-FU損傷組、聯合損傷組培養30、60、120 min后OD值減少(P均<0.05),聯合損傷組OD值最低(P均<0.05)。見表1。

表1 各組不同時點細胞增殖活性比較
注:與對照組同時間點比較,*P<0.05。
2.3 各組細胞遷移能力比較 PICC損傷組、5-FU損傷組、聯合損傷組、對照組的細胞遷移率分別為51.72%、21.57%、18.24%、75.94%,PICC損傷組、5-FU損傷組、聯合損傷組細胞遷移率均較對照組下降(P均<0.05),其中聯合損傷組細胞遷移率最低(P均<0.05)。
2.4 各組細胞培養上清液中vWF水平比較 誘導30 min時,PICC損傷組、5-FU損傷組、聯合損傷組細胞培養上清液vWF水平均高于對照組,并達到峰值(P均<0.05);在5、10、60、120 min時各組細胞培養上清液vWF水平比較差異無統計學意義(P均>0.05)。見表2。

表2 各組不同時點細胞培養上清液中vWF水平比較
注:與對照組同時間點比較,*P<0.05。
3 討論
PICC是由硅膠材料制成、標有刻度、可放射顯影富有高彈性的輸液導管,常用于需要持續輸液、反復輸入血液制品、靜脈給予高營養、化療等患者[7]。PICC在為臨床提供方便、優質治療的同時,也產生了諸多并發癥,如靜脈炎、靜脈血栓等,增加了患者的痛苦甚至病死率[8]。5-FU屬于化學制劑類廣譜抗腫瘤藥物,其不良反應較明顯[9],靜脈輸注時一旦藥物發生外滲可造成局部軟組織、血管的炎癥反應,使組織和血管損傷、潰爛,甚至導致功能障礙[10]。另外,成纖維細胞也受到損傷,使組織修復困難,加上炎性細胞產生的抑制作用,最終導致壞死的局部組織遷延不愈[11]。
靜脈血栓、靜脈炎是臨床靜脈輸液導管引起的常見并發癥[12]。這些并發癥主要是由導管的機械性刺激和外滲藥物的毒性引起。引起內皮損傷或功能障礙的病理刺激有兩種,一種是血流或置入物對內皮層產生的剪切力、壓力等機械力,另一種是由細菌內毒素、炎癥因子等引起的生化改變。PICC反復置入和外滲5-FU藥物的刺激對內皮細胞損傷的病理機制分別屬于第一、第二種。PICC、5-FU可導致血管內皮細胞多種形式的功能失調,如形態的改變、血管內皮細胞增殖和遷移的抑制等,最終導致血管病變的發生。本研究結果顯示,各模擬組細胞生長較慢,數量較少,單層融合時并沒有出現典型的“鋪路石”樣,說明PICC、5-FU對EA.HY926細胞造成了損傷。MTT檢測顯示,同一組不同時間點測定的OD值減少,30、60、120 min時OD值與對照組比較有統計學差異,表明細胞的活性開始降低,30 min時PICC、5-FU對EA.HY926細胞造成了損傷;而30、60、120 min時,各模擬組間OD值比較差異無統計學意義,說明EA.HY926細胞并沒有隨著誘導時間的延長而加重損傷,這與既往研究血管內皮損傷呈時間依賴性相悖,可能與本實驗導管留置時間間隔較短有關。而當PICC導管聯合5-FU共同培養EA.HY926細胞時,同一時間點測得的OD值顯著低于對照組;在細胞劃痕實驗中,當PICC導管聯合5-FU共同培養EA.HY926細胞時,細胞遷移率最低。說明PICC導管聯合5-FU使EA.HY926細胞功能失調,會抑制EA.HY926細胞的增殖和遷移,使其形態改變和功能異常,導致細胞損傷和細胞凋亡,進而使靜脈血管發生病變。PICC導管作為異物置入血管,由于機械性刺激和留置會對EA.HY926細胞造成不同程度的損傷。5-FU主要通過其毒性作用于細胞代謝周期的各個階段,通過影響細胞DNA和蛋白質的合成[13],引起嚴重的慢性組織反應、壞死。
既往研究表明,血管壁內皮細胞的損傷修復在血管壁的病理生理中有重要作用[14]。內皮細胞在受到刺激或損傷時,Weibel-Palade小體釋放出vWF,vWF介導血小板聚集于損傷的血管內皮下,啟動血栓引起血管并發癥。有研究發現,在受到損傷或刺激的內皮細胞的溶解物及上清中,vWF的合成和釋放均增加。本研究結果顯示,各模擬組EA.HY926細胞培養上清液中vWF水平與對照組相比均有不同程度的升高,其中以聯合損傷組升高最為明顯,并在30 min時達到峰值,隨后下降并趨于平穩,說明EA.HY926細胞在受到PICC、5-FU引起的損傷后,細胞Weibel-Palade小體快速釋放vWF參與炎癥反應,同時可推斷PICC、5-FU是通過vWF造成EA.HY926細胞損傷。
綜上所述,模擬PICC置管聯合5-FU對內皮細胞造成了損傷,表現為影響細胞形態和對其生物功能的抑制,其機制可能與Weibel-Palade小體釋放vWF造成細胞損傷有關。
[1] 張玲,徐麗.造血干細胞移植病人PICC導管最佳置管時間探討[J].護理研究,2016,30(26):3313-3314.
[2] 趙芳,吳美妮,王冬冬,等.肘窩上3~10 cm外周靜脈穿刺中心靜脈置管的并發癥[J].山東醫藥,2016,56(3):78-80.
[3] 馬婷.全國部分三甲醫院162個腫瘤科靜脈治療護理現狀的調查分析[J].中華現代護理雜志,2015,8(17):2041-2044.
[4] 劉青焱.三種血管通道器材對靜脈損傷的對比實驗研究[D].成都:四川醫科大學,2015.
[5] Lourenco SA, Ohara CV. Nurses′ knowledge about the insertion procedure for peripherally inserted central catheters in newborns[J]. Rev Lat Am Enfermagem, 2010,18(2):189-195.
[6] L′Azou B, Fernandez P, Bareille R, et al. In vitro endothelial cell susceptibility to xenobiotics: comparison of threecell types[J]. Cell Biol Toxicol, 2005,21(2):127-137.
[7] 尚靜,王銳.兩種靜脈途徑在直腸癌患者FolFox4化療方案中的應用[J].中國醫藥導報,2017,14(8):167-170.
[8] Liem TK, Yanit KE, Moseley SE, et al. Peripherally inserted central catheter usage patterns and associated symptomatic upper extremity venous thrombosis[J]. J Vasc Surg, 2012,55(3):761-767.
[9]張書俊,王耿澤,劉建文.5-氟尿嘧啶為基礎的化療方案聯合三維適形調強放療用于進展期胃癌術后的臨床觀察[J].中國藥房,2016,27(15):2062-2064.
[10] 黃榮,李夢帆,黃毅,等.深靜脈血栓患者血清炎癥因子水平與血管損傷程度的關系[J].山東醫藥,2016,56(44):58-60.
[11] 宋方,田茂波,黃晶,等.抑制干擾素誘導蛋白p204表達促進大鼠血管外膜成纖維細胞生長與遷移[J].中國動脈硬化雜志,2016,24(1):18-22.
[12] 王欣鵑,張志剛.國內有關PICC相關性靜脈炎研究的文獻計量學分析[J].護理研究,2016,30(25):3138-3141.
[13] 李大玉,梁大敏,束波,等.沉默DNA依賴蛋白激酶亞基對肝癌耐藥細胞Bel-7402/5-FuDNA損傷修復功能的影響[J].中國現代醫學雜志,2016,26(17):19-22.
[14] Michaelis UR. Mechanisms of endothelial cell migration[J]. Cell Mol Life Sci, 2014,71(21):4131-4148.
10.3969/j.issn.1002-266X.2017.42.013
R47
A
1002-266X(2017)42-0046-03
新疆維吾爾族自治區自然科學基金資助項目(2016D01C175)。
林素蘭(E-mail: 2402745049@qq.com)
2017-07-28)

