IL-37對(duì)人原代髓樣樹突狀細(xì)胞炎癥相關(guān)因子表達(dá)的影響
吳萬(wàn)通,崔兆娜
(1天津市東麗區(qū)東麗醫(yī)院,天津300300;2天津市河西區(qū)陳塘莊街社區(qū)衛(wèi)生服務(wù)中心)
IL-37對(duì)人原代髓樣樹突狀細(xì)胞炎癥相關(guān)因子表達(dá)的影響
吳萬(wàn)通1,崔兆娜2
(1天津市東麗區(qū)東麗醫(yī)院,天津300300;2天津市河西區(qū)陳塘莊街社區(qū)衛(wèi)生服務(wù)中心)
目的觀察白細(xì)胞介素37(IL-37)對(duì)人原代髓樣樹突狀細(xì)胞(mDC)表達(dá)炎癥相關(guān)因子TNF-α、IL-6、IL-12的影響。方法使用淋巴細(xì)胞分離液將全血細(xì)胞分離后提取單個(gè)核細(xì)胞,流式細(xì)胞分選方法分離純化CD11c+CD123lowHLA-DR+的mDC。將分選后的mDC分為3組:未處理組加入完全培養(yǎng)基;對(duì)照組加入完全培養(yǎng)基培養(yǎng)后,再加入100 ng/mL LPS;IL-37預(yù)處理組分別加入0.125、0.25、0.5、1 μg/mL IL-37后,再加入100 ng/mL LPS。采用實(shí)時(shí)熒光定量PCR方法檢測(cè)mDC中TNF-α、IL-6、IL-12 mRNA表達(dá),ELISA法檢測(cè)細(xì)胞上清液中TNF-α、IL-6、IL-12水平。結(jié)果與未處理組比較,對(duì)照組TNF-α、IL-6、IL-12 mRNA表達(dá)均升高(P均<0.01)。與對(duì)照組相比,IL-37預(yù)處理組加入0.25、0.5、1 μg/mL IL-37預(yù)處理后,TNF-α、IL-6 mRNA表達(dá)降低;加入0.5、1 μg/mL IL-37預(yù)處理后,IL-12 mRNA表達(dá)降低(P均<0.01)。與未處理組比較,對(duì)照組細(xì)胞上清液中TNF-α、IL-6、IL-12水平升高。各濃度IL-37預(yù)處理組與對(duì)照組相比,TNF-α水平均降低(P均<0.05);加入0.25 μg/mL IL-37預(yù)處理后,細(xì)胞上清液中IL-6、IL-12水平降低(P均<0.05)。結(jié)論IL-37能夠降低人原代mDC表達(dá)和分泌炎癥相關(guān)因子。
白細(xì)胞介素37;髓樣樹突狀細(xì)胞;流式細(xì)胞術(shù);腫瘤壞死因子α;白細(xì)胞介素6;白細(xì)胞介素12
髓樣樹突狀細(xì)胞(mDC)是一群專職的抗原提呈細(xì)胞,它能夠捕獲、加工并通過(guò)其表面受體提呈抗原給T細(xì)胞。mDC是適應(yīng)性免疫反應(yīng)和固有免疫反應(yīng)的橋梁[1]。白細(xì)胞介素37(IL-37)在人類體內(nèi)大多數(shù)類型的細(xì)胞中均有表達(dá),包括單核細(xì)胞、樹突狀細(xì)胞、內(nèi)皮細(xì)胞和上皮細(xì)胞,并能夠調(diào)節(jié)炎癥反應(yīng)。體外研究[2]表明,表達(dá)在巨噬細(xì)胞和上皮細(xì)胞的IL-37能抑制促炎性細(xì)胞因子IL-1α、IL-1β、TNF-α和巨噬細(xì)胞炎性蛋白2(MIP-2)的產(chǎn)生。體內(nèi)研究[3]表明,小鼠體內(nèi)IL-37表達(dá)能夠保護(hù)機(jī)體,抵抗化學(xué)誘導(dǎo)型結(jié)腸炎和代謝綜合征。此外,IL-37轉(zhuǎn)基因小鼠在內(nèi)毒素休克中能夠降低肺、腎、肝損傷[2]。盡管IL-37在多種疾病的發(fā)生發(fā)展中發(fā)揮重要功能,但其對(duì)人原代mDC的免疫學(xué)作用尚不清楚。2015年12月~2016年11月,我們觀察了IL-37對(duì)人原代mDC炎癥相關(guān)因子TNF-α、IL-6、IL-12表達(dá)的影響,為探討其在疾病發(fā)病中的作用提供理論依據(jù)。
1 材料與方法
1.1 材料 脂多糖購(gòu)自Sigma公司;淋巴細(xì)胞分離液購(gòu)自天津?yàn)?yáng)生物制品公司;IL-37購(gòu)自R&D公司;RPMI-1640培養(yǎng)基購(gòu)自美國(guó)HyClone公司;恒溫培養(yǎng)箱和cDNA逆轉(zhuǎn)錄試劑盒購(gòu)自美國(guó)Thermo公司,熒光標(biāo)記的抗人抗體(Lin-FITC、CD123-PE、HLA-DR-PerCP、CD11c-APC)購(gòu)自BD公司。BD FACSAriaⅢ流式細(xì)胞分選儀購(gòu)自BD公司;人IL-6、IL-12、TNF-α、GAPDH cDNA擴(kuò)增引物由上海生物工程有限公司負(fù)責(zé)合成,人IL-6、IL-12、TNF-α ELISA試劑盒購(gòu)自深圳欣博勝生物有限公司。
1.2 單個(gè)核細(xì)胞的提取 采集體檢正常產(chǎn)婦枸櫞酸鈉抗凝臍血約100 mL,與等量PBS充分混勻。在50 mL離心管中加入淋巴細(xì)胞分離液20 mL,用移液管吸取30 mL已稀釋的全血,沿離心管管壁緩慢加入,保持兩液面界面清晰。離心,吸取中上層單個(gè)核細(xì)胞,放入離心管中,加入2倍體積PBS,洗滌去除血小板及殘留的淋巴細(xì)胞分離液。將細(xì)胞稀釋成1×107/mL,待后續(xù)實(shí)驗(yàn)。
1.3 流式細(xì)胞術(shù)分選CD11c+CD123lowHLA-DR+的mDC 取單個(gè)核細(xì)胞,離心后加入200 μL 1% PBS,重懸后依次加入熒光標(biāo)記抗體Lin-FITC、CD123-PE、HLA-DR-PerCP、CD11c-APC,混勻細(xì)胞后冰浴避光反應(yīng)30~40 min。PBS洗滌,去除多余的游離抗體。離心重懸后上機(jī)分選。在配置的15 mL分選接收管內(nèi)加入3 mL 1% PBS及青霉素-鏈霉素溶液,收集目的細(xì)胞。離心,去上清后重懸。使用流式分選儀軟件分析細(xì)胞表型。基于外周血單個(gè)核細(xì)胞的自身特點(diǎn),通過(guò)FSC-A/SSC-A散點(diǎn)圖結(jié)果排除待測(cè)樣本中的死細(xì)胞和碎片即為總PBMC。基于Lin/CD123散點(diǎn)圖,在總PBMC中圈出Lin-CD123low的細(xì)胞。進(jìn)一步基于CD11c/HLA-DR散點(diǎn)圖,在Lin-CD123low細(xì)胞中,找到CD11c、HLA-DR雙陽(yáng)性細(xì)胞,圈出CD11c+/HLA-DR+細(xì)胞即為mDC(Lin-CD123lowHLA-DR+CD11c+),使用流式細(xì)胞分選儀進(jìn)行分選,收集mDC。
1.4 mDC體外刺激培養(yǎng) 將分選后的mDC按1×106/孔接種于12孔板中,分為3組:未處理組加入完全培養(yǎng)基培養(yǎng)48 h;對(duì)照組加入完全培養(yǎng)基培養(yǎng)24 h后,加入100 ng/mL LPS繼續(xù)培養(yǎng)24 h;IL-37預(yù)處理組分別加入0.125、0.25、0.5、1 μg/mL IL-37處理24 h后,再加入100 ng/mL LPS培養(yǎng)24 h。5% CO2條件下37 ℃培養(yǎng),收集mDC及培養(yǎng)基上清。
1.5 mDC中TNF-α、IL-6、IL-12 mRNA表達(dá)檢測(cè) 采用實(shí)時(shí)熒光定量PCR(qRT-PCR)方法。收集3組細(xì)胞,采用TRIzol總RNA提取試劑盒提取細(xì)胞總RNA。紫外分光光度計(jì)檢測(cè)其純度,按逆轉(zhuǎn)錄試劑盒進(jìn)行操作,將總RNA逆轉(zhuǎn)錄為cDNA。ABI7500儀器上進(jìn)行Real time PCR反應(yīng)。引物序列:GAPDH上游引物為5′-CATGAGAAGTATGACAACAGCCT-3′,下游引物為5′-AGTCCTTCCACGATACCAAAGT-3′; TNF-α上游引物為5′-CTCTTCTGCCTGCTGCACTTTG-3′,下游引物為5′-ATGGGCTACAGGCTTGTCACTC-3′;IL-6上游引物為5′-GCCCATGCTACATTTGCCGAAG-3′,下游引物為5′-CAGGAGCCCAGCTATGAACTC-3′;IL-12上游引物為5′-GACATTCTGCGTTCAGGTCCAG-3′,下游引物為5′-CATTTTTGCGGCAGATGACCGTG-3′。PCR體系為20 μL:Transgen 2×SYBR Green RT-PCR Master MIX 10 μL;Primers 2 μL;cDNA 1 μL;DEPC水7 μL。按以下條件進(jìn)行Real time PCR擴(kuò)增:95 ℃ 10 min;94 ℃ 15 s,60 ℃ 1 min,循環(huán)40次。儀器記錄熒光值,擴(kuò)增結(jié)束后繪制溶解曲線。目的基因的表達(dá)量采用2-ΔΔCt方法計(jì)算。
1.6 細(xì)胞上清液中TNF-α、IL-6、IL-12水平檢測(cè) 采用ELISA法。收集3組細(xì)胞的上清液,采用ELISA法測(cè)定細(xì)胞上清液中TNF-α、IL-6、IL-12水平,依據(jù)ELISA試劑盒說(shuō)明書進(jìn)行操作。
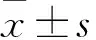
2 結(jié)果
2.1 各組mDC中TNF-α、IL-6、IL-12 mRNA表達(dá)比較 與未處理組相比,對(duì)照組TNF-α、IL-6、IL-12 mRNA表達(dá)均升高(P均<0.01)。與對(duì)照組相比,IL-37預(yù)處理組加入0.125 μg/mL IL-37預(yù)處理后,TNF-α、IL-6、IL-12 mRNA表達(dá)水平差異均無(wú)統(tǒng)計(jì)學(xué)意義(P均>0.05);當(dāng)加入0.25、0.5、1 μg/mL IL-37預(yù)處理后,TNF-α、IL-6 mRNA表達(dá)降低(P均<0.01);當(dāng)加入0.5、1 μg/mL IL-37預(yù)處理后,IL-12 mRNA表達(dá)降低(P均<0.01)。見(jiàn)表1。

表1 各組mDC中TNF-α、IL-6、IL-12 mRNA表達(dá)比較
注:與對(duì)照組比較,*P<0.01。
2.2 各組細(xì)胞上清液中TNF-α、IL-6、IL-12水平比較 與未處理組比較,對(duì)照組細(xì)胞上清液中TNF-α、IL-6、IL-12水平升高。各濃度IL-37預(yù)處理組與對(duì)照組相比,TNF-α水平均降低(P均<0.05);加入0.125 μg/mL IL-37預(yù)處理后,細(xì)胞上清液中IL-6、IL-12水平無(wú)明顯變化(P均>0.05);加入0.25、0.5、1 μg/mL IL-37預(yù)處理后,細(xì)胞上清液中IL-6、IL-12水平降低(P均<0.05)。見(jiàn)表2。

表2 各組細(xì)胞上清液中TNF-α、IL-6、IL-12表達(dá)比較
注:與對(duì)照組比較,*P<0.05。
3 討論
IL-37的抗炎作用已在多種不同種類的細(xì)胞中得到證明[2,4,5]。外源性IL-37通過(guò)與IL-18受體的α鏈結(jié)合,發(fā)揮抑制炎癥的作用[6]。此外,細(xì)胞內(nèi)IL-37可轉(zhuǎn)運(yùn)到細(xì)胞核,以下調(diào)促炎性細(xì)胞因子的表達(dá)[7]。IL-37能在體外和體內(nèi)廣泛抑制固有免疫反應(yīng)。重組IL-37已被證明能減少肝細(xì)胞損傷引起的缺血和再灌注損傷[8]。此外,重組IL-37能保護(hù)小鼠抵抗急性肺損傷和降低氣管內(nèi)滴注煙曲霉菌后的中性粒細(xì)胞浸潤(rùn)[9]。轉(zhuǎn)染IL-37的間充質(zhì)干細(xì)胞已被證明能通過(guò)增加髓源性抑制和調(diào)節(jié)性T細(xì)胞并降低CD4+細(xì)胞數(shù)量來(lái)保護(hù)小鼠抵抗結(jié)腸炎[10]。
雖然大量研究均顯示IL-37可能會(huì)降低炎癥因子的表達(dá),但多數(shù)研究均局限于通過(guò)IL-37轉(zhuǎn)染細(xì)胞實(shí)現(xiàn),而外源性IL-37作用的相關(guān)報(bào)道所研究的樹突狀細(xì)胞主要是通過(guò)IL-4和GM-CSF體外誘導(dǎo)小鼠骨髓細(xì)胞或人的外周血單個(gè)核細(xì)胞來(lái)實(shí)現(xiàn)的。外源性應(yīng)用IL-37對(duì)人類原代mDC的相關(guān)實(shí)驗(yàn)仍未見(jiàn)報(bào)道。mDC在許多臨床疾病中發(fā)揮關(guān)鍵作用,尤其是參與疾病的免疫學(xué)反應(yīng)。我們首先通過(guò)流式細(xì)胞術(shù)原理分離臍帶血中mDC(Lin-CD123lowHLA-DR+CD11c+細(xì)胞),分離比例與相關(guān)報(bào)道一致。核因子-κB(NF-κB)是介導(dǎo)細(xì)胞炎癥反應(yīng)的主要轉(zhuǎn)錄因子,包括趨化因子和細(xì)胞因子的表達(dá)[11]。LPS能激活細(xì)胞表面上的Toll樣受體4(TLR4),進(jìn)而與細(xì)胞內(nèi)的適配器作用激活NF-κB[12]。NF-κB然后可以轉(zhuǎn)位到細(xì)胞核內(nèi),調(diào)節(jié)促炎因子基因的表達(dá),包括TNF-α和IL-6[13]。許多研究表明,抑制NF-κB能降低炎癥細(xì)胞因子的產(chǎn)生,從而保護(hù)小鼠免受致命內(nèi)毒素血癥。我們最近的研究表明,IL-37能抑制小鼠樹突狀細(xì)胞磷酸化NF-κB的表達(dá)。本研究結(jié)果顯示,IL-37能抑制人mDC炎癥因子TNF-α、IL-6、IL-12的表達(dá)。由于mDC在免疫性疾病及炎癥性疾病的發(fā)生發(fā)展中起關(guān)鍵作用,而IL-37抑制mDC炎癥因子的產(chǎn)生能導(dǎo)致免疫反應(yīng)受到抑制,因此推測(cè),IL-37可能通過(guò)抑制人類原代mDC的NF-κB相關(guān)信號(hào)通路,從而抑制炎癥因子的表達(dá)。我們的前期研究表明,IL-37能夠通過(guò)NF-κB的相關(guān)通路作用于小鼠樹突狀細(xì)胞,從而進(jìn)一步影響T細(xì)胞功能[14]。本研究結(jié)果顯示,LPS能升高mDC中炎癥因子TNF-α、IL-6、IL-12的表達(dá),而經(jīng)IL-37處理的mDC表達(dá)TNF-α、IL-6、IL-12的水平明顯降低。表明IL-37可能通過(guò)降低NF-κB的激活抑制炎癥因子表達(dá)。已有研究[6]表明,IL-37抗炎活性的產(chǎn)生需要IL-18Rα受體和TIR-8(SIGIRR)。本研究結(jié)果表明,IL-37能夠明顯降低由LPS刺激導(dǎo)致的IL-6和TNF-α的產(chǎn)生。而且本研究中IL-37在較低濃度時(shí)可以降低炎癥因子的表達(dá),而高濃度時(shí)炎癥因子的抑制效應(yīng)并沒(méi)有明顯增加。我們推測(cè)這可能與mDC表面存在的相應(yīng)受體數(shù)量有關(guān),也有可能是因?yàn)樵诘蜐舛葧r(shí)IL-37結(jié)合IL-18Rα并募集IL-1R8,而高濃度的IL-37/IL-18Rα復(fù)合物可能會(huì)募集IL-18Rβ,從而激活了相應(yīng)的IL-18信號(hào)通路。
綜上所述,IL-37能夠降低人原代mDC相關(guān)炎癥因子的表達(dá)。這為進(jìn)一步研究IL-37和人原代mDC的生物學(xué)功能提供了新的途徑,為更好地研究IL-37在疾病中的作用機(jī)制奠定了良好的實(shí)驗(yàn)基礎(chǔ)。
[1] Rodriguez PC, Ochoa AC, Al-Khami AA. Arginine metabolism in myeloid cells shapes innate and adaptive immunity[J]. Front Immunol, 2017,8:93.
[2] Nold MF, Nold-Petry CA, Zepp JA, et al. IL-37 is a fundamental inhibitor of innate immunity[J]. Nat Immunol, 2010,11(11):1014-1022.
[3] McNamee EN, Masterson JC, Jedlicka P, et al. Interleukin 37 expression protects mice from colitis[J]. Proc Nati Acad Sci U S A, 2011,108(40):16711-16716.
[4] Bufler P, Azam T, Gamboni-Robertson F, et al. A complex of the IL-1 homologue IL-1f7b and IL-18-binding protein reduces il-18 activity[J]. Proc Nati Acad Sci U S A, 2002,99(21):13723-13728.
[5] Cavalli G, Koenders M, Kalabokis V, et al. Treating experimental arthritis with the innate immune inhibitor interleukin-37 reduces joint and systemic inflammation[J]. Rheumatology, 2016,55(12):2220-2229.
[6] Li S, Neff CP, Barber K, et al. Extracellular forms of IL-37 inhibit innate inflammation in vitro and in vivo but require the IL-1 family decoy receptor IL-1R8[J]. Proc Nati Acad Sci U S A, 2015,112(8):2497-2502.
[7] Sharma S, Kulk N, Nold MF, et al. The IL-1 family member 7b translocates to the nucleus and down-regulates proinflammatory cytokines[J]. J Immunol, 2008,180(8):5477-5482.
[8] Sakai N, Van Sweringen HL, Belizaire RM, et al. Interleukin-37 reduces liver inflammatory injury via effects on hepatocytes and non-parenchymal cells[J]. J Gastroenterol Hepatol, 2012,27(10):1609-1616.
[9] Moretti S, Bozza S, Oikonomou V, et al. IL-37 inhibits inflammasome activation and disease severity in murine aspergillosis[J]. PLoS pathog, 2014,10(11):e1004462.
[10] Wang WQ, Dong K, Zhou L, et al. IL-37b gene transfer enhances the therapeutic efficacy of mesenchumal stromal cells in dss-induced colitis mice[J]. Acta pharmacol Sin, 2015,36(11):1377-1387.
[11] Bonizzi G, Karin M. The two NF-kappaB activation pathways and their role in innate and adaptive immunity[J]. Trends Immunol, 2004,25(6):280-288.
[12] Boyd JH, Mathur S, Wang Y, et al. Toll-like receptor stimulation in cardiomyoctes decreases contractility and initiates an NF-kappaB dependent inflammatory response[J]. Cardiovasc Res, 2006,72(3):384-393.
[13] Ghosh S, Dass JF. Study of pathway cross-talk interactions with NB-kappaB leading to its activation via ubiquitination or phosphorylation: a brief review[J]. Gene, 2016,584(1):97-109.
[14] Wu W, Wang W, Wang Y, et al. IL-37b suppresses T cell priming by modulating dendritic cell maturation and cytokine production via dampening ERK/NF-kappaB/s6k signalings[J]. Acta Biochim Biophys Sin, 2015,47(8):597-603.
10.3969/j.issn.1002-266X.2017.42.011
R742
A
1002-266X(2017)42-0040-03
天津市東麗區(qū)科技發(fā)展計(jì)劃(2015DL10002)。
2017-05-26)

