重組人促紅細胞生成素對高氧腦損傷大鼠腦組織Caspase-3、Bcl-2表達的影響
許春花,王永雙,楊磊,胡婉婷,趙寒陽
(1延邊大學附屬醫院,吉林延吉133000;2湖北醫藥學院附屬襄陽市第一人民醫院)
重組人促紅細胞生成素對高氧腦損傷大鼠腦組織Caspase-3、Bcl-2表達的影響
許春花1,王永雙1,楊磊2,胡婉婷1,趙寒陽1
(1延邊大學附屬醫院,吉林延吉133000;2湖北醫藥學院附屬襄陽市第一人民醫院)
目的探討重組人促紅細胞生成素(rEPO)對新生大鼠高氧腦損傷的影響及其機制。方法將新生Wistar大鼠90只分成空氣組、高氧組、治療組各30只,高氧組和治療組置于高氧模型箱中,空氣組置于氧氣室外呼吸空氣。于實驗第3、7、14天每組處死10只,取大鼠海馬組織行HE染色進行病理檢查,采用TUNEL染色法檢測海馬神經細胞凋亡指數,采用Western blotting法檢測腦組織中Caspase-3和Bcl-2的相對表達量。結果病理檢查顯示,高氧組腦組織有不同程度的水腫、壞死和炎癥反應,隨著暴露于高濃度氧中時間的延長病理改變明顯加重,而治療組明顯抑制了高氧誘導的腦組織炎癥反應。TUNEL 染色結果表明,高氧組第3、7、14天海馬神經細胞凋亡指數均較對照組增高,而治療組凋亡指數較高氧組降低(P均<0.05)。高氧組第3、7、14天腦組織Caspase-3相對表達量均較空氣組升高(P均<0.05),治療組第7、14天較高氧組降低(P均<0.05),治療組與空氣組比較差異無統計學意義(P均>0.05)。高氧組第7、14天腦組織Bcl-2相對表達量較空氣組降低(P均<0.05),治療組第7、14天較高氧組升高(P均<0.05),治療組與空氣組比較差異無統計學意義(P均>0.05)。結論rEPO能減輕高氧所致的腦損傷,可能與其下調腦組織中Caspase-3及上調抗凋亡蛋白Bcl-2表達有關。
高氧腦損傷;重組人促紅細胞生成素;Caspase-3;Bcl-2;大鼠
高濃度氧療是呼吸窘迫早產兒最常用的治療方法之一。但高氧可增加腦細胞內致炎細胞因子、神經細胞、血管內皮細胞凋亡,導致細胞凋亡、壞死、炎癥反應,通過誘導促炎因子和抑制生長因子信號級聯反應來誘發廣泛的神經退行性病變[1],從而引起腦損傷。促紅細胞生成素(EPO)是一類肽類激素,是由166個氨基酸殘基構成的唾液酸糖蛋白。EPO通過抑制細胞凋亡、減輕炎癥反應、促進血管再生等途徑減輕高氧腦損傷。重組人促紅細胞生成素(rEPO)可通過抗神經細胞凋亡、抗氧化、抗炎性反應來維持腦血管正常結構和功能,保護腦組織。2016年7~12月,我們通過制備新生大鼠高氧腦損傷模型,觀察大鼠海馬組織病理學變化和海馬神經細胞凋亡情況,并檢測凋亡相關蛋白Caspase-3和Bcl-2的表達,探討rEPO治療高氧腦損傷的作用機制,為臨床治療提供理論依據。
1 材料與方法
1.1 材料 普通級Wistar新生大鼠90只,體質量10~15 g,雌雄不限。適應性喂養1周,自由飲水、進食。rEPO購自哈藥集團生物工程有限公司,Caspase-3抗體和Bcl-2抗體購自Santa Cruz公司。
1.2 動物分組與處理 將大鼠隨機分為空氣組、高氧組、治療組各30只。空氣組置于空氣中飼養,高氧組和治療組置于氧濃度80%±2%的高氧模型箱中,三組均保持溫度20~25 ℃、濕度70%左右。在新生鼠出生后第2天開始,對治療組腹腔內注射rEPO,3 000 U/kg,連續13 d,空氣組注射相同劑量的生理鹽水。于實驗第3、7、14天每組各處死10只新生鼠,取出大腦。
1.3 海馬組織病理學檢查 將新生鼠大腦放入4%中性甲醛中固定,經過脫水、石蠟包埋、5 μm厚切片。行HE染色,光鏡下觀察海馬組織病理學變化。
1.4 海馬神經細胞凋亡情況觀察 將腦組織包埋切片,運用核染色結合TUNEL染色技術,在熒光顯微鏡下觀察神經細胞凋亡情況。 每張切片記錄 500 個腦細胞,計算每 100 個細胞內陽性細胞數,以百分數表示神經細胞凋亡指數。
1.5 腦組織Caspase-3、Bcl-2蛋白檢測 采用Western blotting法。將腦組織充分剪碎、勻漿,加入細胞裂解液提取組織蛋白,BCA法測定蛋白濃度。凝膠電泳分離蛋白,濕轉法將蛋白轉移到硝酸纖維素膜,300 mA恒流40 min。封閉液封閉后PVDF膜過夜,TBS-T緩沖液中充分振蕩清洗,分別滴加一、二抗,一、二抗終濃度稀釋比例為1∶2 000,ECM顯色。X線曝光后顯影、定影、晾干。使用凝膠成像系統掃描,圖像分析軟件對吸光度進行分析,以目標蛋白與β-actin吸光度的比值表示目標蛋白的相對表達量。
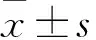
2 結果
2.1 三組海馬組織病理變化比較 空氣組海馬組織細胞形態正常,排列緊密整齊,形態完整,細胞核圓而大,核仁清晰,神經纖維密集,排列整齊。高氧組第3天海馬組織部分細胞出現水腫及破裂,部分細胞核溶解、固縮,炎癥細胞略增多,海馬組織結構破壞;第7天海馬組織水腫及破裂的細胞較第3天明顯增加,核溶解、固縮的細胞增加,炎癥細胞明顯增加;第14天以上變化較前加重,海馬結構紊亂。治療組第3、7、14天海馬組織的病理變化均較高氧組有所減輕。
2.2 三組海馬神經細胞凋亡指數比較 高氧組第 3 、7 、14 天與空氣組比較海馬神經細胞凋亡指數增高(P均<0.05);治療組第3、7、14天與高氧組比較細胞凋亡指數降低(P均<0.05)。治療組與空氣組比較差異無統計學意義(P均>0.05)。見表1。

表1 三組各時間點海馬神經細胞凋亡指數比較
注:與高氧組比較,*P<0.05。
2.3 三組腦組織Caspase-3相對表達量比較 高氧組第3、7、14天腦組織Caspase-3相對表達量均較空氣組升高(P均<0.05);治療組第7、14天較高氧組降低(P均<0.05),治療組與空氣組比較差異無統計學意義(P均>0.05)。見表2。
2.4 三組腦組織Bcl-2相對表達量比較 高氧組第7、14天腦組織Bcl-2相對表達量較空氣組降低(P均<0.05);治療組第7、14天較高氧組升高(P均<0.05),治療組與空氣組比較差異無統計學意義(P均>0.05)。見表3。

表2 三組各時間點腦組織Caspase-3相對表達量比較
注:與高氧組比較,*P<0.05。

表3 三組各時間點腦組織Bcl-2相對表達量比較
注:與高氧組比較,*P<0.05。
3 討論
氧療是重癥監護室最常用的治療方法之一,對呼吸窘迫的治療效果尤為突出。高壓氧治療能有效改善微循環及缺氧,減輕腦水腫,但易引起氧療并發癥,其中最易受損的器官為腦、肺和視器。隨著極低出生體重兒存活率的提高,高氧所致的腦損傷也隨之上升。細胞凋亡是神經細胞死亡的重要形式,其病理改變是選擇性神經細胞損傷,啟動細胞內凋亡相關基因,導致神經細胞凋亡。有研究[2]顯示,在高氧引起海馬氧化應激時,不論氧化途徑、內質網應激還是炎癥途徑,均可誘發廣泛的神經細胞凋亡,引起高氧腦損傷后發生細胞凋亡及其凋亡相關基因的表達。本研究顯示,腦組織暴露于高濃度氧時海馬神經細胞出現凋亡,隨著高氧時間延長,凋亡指數增高。
Bcl-2和Caspase是與細胞凋亡密切相關的基因,在細胞凋亡不同階段起不同的調控作用[3]。Caspase-3是Caspase家族中最重要的細胞凋亡效應蛋白,是凋亡的執行者[4]。細胞外的環境中尚存在其作用底物,可促進細胞凋亡,故認為抑制Caspase-3信號通路可能是治療腦損傷的途徑之一[5]。細胞凋亡胞內信號途徑是使細胞色素C從線粒體釋放到胞質引起凋亡,這一過程受Bcl-2蛋白調控。Bcl-2是抗凋亡基因,Bcl-2家族可控制激活或抑制凋亡[6,7],從而決定一個細胞生存或啟動細胞凋亡途徑來回應細胞內的破壞。缺氧缺血腦損傷后大鼠腦組織中Caspase-3的表達量與神經細胞凋亡數量均明顯增加[8],腦創傷后神經細胞會發生凋亡,而凋亡的發生與Caspase-3、Bcl-2等蛋白的調節有關[9]。本研究顯示,高氧組比空氣組Caspase-3表達量增加,Bcl-2表達量減少,與文獻報道一致。
對嚙齒類動物實驗模型的研究顯示,EPO顯著影響缺氧缺血、中毒的多個信號通路,EPO可通過抗神經細胞凋亡及活化、阻斷興奮性氨基酸神經毒性、阻止一氧化氮生成及減輕炎癥反應等,發揮對腦組織的神經保護效應[10,11]。EPO是神經生存的有效促進劑,它通過降低神經系統的新陳代謝、神經毒性以及興奮性毒性應激來抵抗神經細胞損傷[12]。保護神經免受谷氨酸毒性和自由基損傷,可能是EPO在高氧腦損傷治療中的兩種可能的治療機制[13]。EPO的深入研究發現,在高氧腦損傷中,通過外源性地增加EPO的濃度,也可以增加大腦中EPO的濃度,從而攜帶走氧氣,使大腦中的氧濃度降低到生理范圍之內,抑制氧化酶的激活,切斷ROS的原料供給,致使其濃度下降,從而抑制氧化應激反應的持續發生,減輕大腦損傷。rEPO是一種通過基因重組技術合成的糖蛋白,與天然EPO有著相同氨基酸序列,生物學活性也相似,rEPO已經被證實是預防早產兒貧血的一種有效藥物。楊曉等[14]報道,EPO能減少新生鼠壞死性小腸結腸炎(NEC)發生率,使NEC新生大鼠Bcl-2表達增加、Caspase-3表達減少,抑制細胞凋亡,對腸道起保護作用。rEPO在高氧誘導的腦損傷的神經保護效應與伴隨而來的各種急性蛋白質的改變這一過程有明顯關系[15]。本研究通過檢測Caspase-3以及抑制凋亡的主要抗凋亡因子Bcl-2蛋白表達水平來明確高氧腦損傷是否與細胞凋亡有關。結果顯示,rEPO治療能降低新生大鼠高氧腦組織Caspase-3表達,抑制Bcl-2降低。
綜上所述,rEPO具有保護腦組織免受高氧損傷的作用,其機制與下調Caspase-3、上調Bcl-2表達有關。
[1] Benderro GF, La Manna JC.Kidney EPO expression during chronic hypoxia in aged mice[J]. Adv Exp Med Biol, 2013,765:9-14.
[2] Ardalan MR, Estakhri R, Hajipour B, et al. Erythropoietin ameliorates oxidative stress and tissue injury following renal ischemia/reperfusion in rat kidney and lung[J]. Med Prine Pract, 2013,22(1):70-74.
[3] 王永霞,馬娜,鐘興明,等.Caspase-3、TNF-α、bcl-2、bax在人胎兒卵巢的表達[J].中國醫藥導報,2015,12(31):21-24.
[4] 曹朝暉,覃劍,董世訪,等.IFN-γ和TNF-α聯合對MIN6細胞Caspase-3活化的影響[J].免疫學雜志,2014,30(1):17-20.
[5] Nandra KK, Collino M, Rogazzo M, et al. Pharmacological preconditioning with erythropoietin attenuate the organ injury and dysfunction induced in a rat model of hemorrhagic shock[J]. Dis Model Mech, 2013,6(3):701-709.
[6] Watson AJ, Gao L, Sun L, et al. Enhanced preservation of the rat heart after prolonged hypothermic ischemia with erythropoietin-supplemented Celsior solution[J]. J Heart Lung Transplant, 2013,32(6):633-640.
[7] Roubille F, Micheau A, Combes SA, et al. Intracoronary administration of darbepoetin alpha at onset of reperfusion in acute myocardial infarction:results of the randomized Intra-Co-Epo MI trial[J]. Arch Cardiovasc Dis, 2013,982:265-302.
[8] 閆昆明,劉英,張芮,等.新生大鼠缺氧缺血性腦損傷Caspase-3 表達與自由基損傷機制的研究[J].中國免疫學雜志,2015,21(31):1094-1097.
[9] 顧奕,于明琨,呂立權,等.p53、BCL-2、Caspase-3等凋亡相關蛋白在大鼠腦損傷中的表達及意義[J].現代生物醫學雜志,2011,11(39):2030-2033.
[10] Jun JH, Shin EJ, Kim JH, et al. Erythropoietin prevents Hypoxia-Indu ced GATA-4 ubiquitination via phosphorylation of serine 105 of G ATA-4[J]. Biol Pharm Bull, 2013,36(7):1126-1133.
[11] 廖飛龍,楊仲璠,劉煜,等.促紅細胞生成素的研究進展[J].中國新藥雜志,2016,25(1):64-70.
[12] Mastromarino V, Musumeci MB, Conti E, et al. Erythropoietin in cardiac disease: effective or harmful[J]. J Cardiovasc Med (Hagerstown), 2013,14(12):870-878.
[13] Matejkova S, Scheuerle A, Wagner F, et al. Carbamylated erythropoieti n-FC fusion protein and recombinant human erythropoietin during porcine kidney ischemia/reperfusion injury[J]. Intensive Care Med, 2013,39(3):497-510.
[14] 楊曉,梁琨.促紅細胞生成素對壞死性小腸結腸炎新生大鼠腸道Bcl-2及Caspase-3蛋白表達的影響[J].臨床兒科雜志,2015,33(2):179-183.
[15] 李宜培,牛朝霞,勒力,等.促紅細胞生成素對阿爾茲海默病樣大鼠記憶能力及凋亡相關蛋白的影響[J].新鄉醫學院學報,2014,31(8):599-602.
10.3969/j.issn.1002-266X.2017.42.009
R742
A
1002-266X(2017)42-0034-03
吉林省教育廳“十二五”科學技術研究項目(吉教科合字(2015)第20號)。
2017-02-10)

