全反式維甲酸在成年小鼠神經(jīng)干細胞分化中的調控作用及機制
李先紅,胡鶴娟,唐曦瀛,吳堅,黃金忠,姚允怡,3
(1蘇州大學附屬常州第一人民醫(yī)院,江蘇常州213000;2蘇州衛(wèi)生職業(yè)技術學院;3徐州醫(yī)科大學)
全反式維甲酸在成年小鼠神經(jīng)干細胞分化中的調控作用及機制
李先紅1,胡鶴娟2,唐曦瀛2,吳堅1,黃金忠1,姚允怡2,3
(1蘇州大學附屬常州第一人民醫(yī)院,江蘇常州213000;2蘇州衛(wèi)生職業(yè)技術學院;3徐州醫(yī)科大學)
目的研究全反式維甲酸(ATRA)對成年小鼠神經(jīng)干細胞(NSCs)的調控、信號通路及對細胞色素P450(CYP450)家族的影響。方法分離并培養(yǎng)成年小鼠腦室下區(qū)NSCs,將細胞分為ATRA組和對照組,ATRA組加入10-6mol/L ATRA,對照組正常培養(yǎng)。采用流式細胞儀檢測兩組細胞表面標記物,計算神經(jīng)元、星形膠質細胞、少突膠質細胞和NSCs占總細胞數(shù)的百分比;Real-time PCR方法檢測CYP450家族相關基因表達情況,篩選出有統(tǒng)計學意義的基因;ELISA法測定細胞色素P450還原酶(CPR)的活性;Western blotting法檢測P38 MAPK通路相關蛋白P38、p-P38蛋白的相對表達量。結果ATRA組NSCs主要是向神經(jīng)元分化,也有一部分向星形膠質細胞分化,少突膠質細胞較少。與對照組比較,ATRA組P450家族基因中CYP26A1、CYP26B1、CYP26C1表達上調(P均<0.05)。ATRA組CPR活性以及p-P38蛋白表達量均較對照組升高(P均<0.05)。結論ATRA促進小鼠NSCs向神經(jīng)元分化,可能通過上調CYP450中的CYP26家族基因、增加CPR活性以及P38 MAPK通路發(fā)揮調控作用。
全反式維甲酸;神經(jīng)退行性疾病;神經(jīng)干細胞;細胞色素P450;細胞色素P450還原酶;P38 MAPK通路
神經(jīng)干細胞(NSCs)是具有分裂潛能和自我更新能力的神經(jīng)母細胞,主要存在于中樞神經(jīng)系統(tǒng)(CNS)中,可分化為神經(jīng)元、星形膠質細胞及少突膠質細胞[1]。以NSCs取代損傷和變性的腦組織有望成為治療阿爾茲海默病(AD)、帕金森病(PD)等神經(jīng)退行性疾病的新的治療方案。NSCs在應用研究領域需要解決的首要問題就是定向分化。已有研究證實,全反式維甲酸(ATRA)可以誘導包括腫瘤干細胞在內的干細胞[2]及乳腺癌細胞[3]在內的多種實體瘤腫瘤細胞分化和凋亡。但ATRA對于NSCs的作用目前尚不明確。P38絲裂原活化蛋白激酶(P38 MAPK)除參與多種腫瘤細胞的增殖、凋亡外,還參與多種干細胞的分化。細胞色素P450(CYP450)代謝酶系統(tǒng)與神經(jīng)退行性疾病代謝、進展關系密切,在抑制CYP450還原酶(CPR)基因表達的小鼠模型中,可提高星形膠質細胞的增殖活性[4]。2016年1月~2017年5月,我們觀察了ATRA對NSCs增殖、分化的影響,并觀察其調控通路以及對CYP450代謝酶系統(tǒng)的調節(jié)作用。現(xiàn)報告如下。
1 材料與方法
1.1 材料 雄性8周齡C57BL/6小鼠購自南京大學模式動物研究所。ATRA購自Sigma-Aldrich公司,堿性成纖維細胞生長因子(bFGF)、表皮生長因子(EGF)、神經(jīng)元特異性烯醇化酶(NSE)、膠質原纖維酸性蛋白(GFAP)、髓磷脂堿性蛋白(MBP)和巢蛋白(nestin)購自Peprotech公司,B27/DMEM培養(yǎng)基和多聚左旋賴氨酸Poly-L-lysine hydrobromide購自GIBCO公司,代謝酶相關基因檢測試劑盒購自QIAGEN公司,Western blotting檢測相關試劑、小鼠CPR活性檢測ELISA試劑盒購自中國碧云天公司。
1.2 NSCs的分離及培養(yǎng) 將小鼠用二氧化碳吸入法處死,顯微鏡下切下兩側腦室下區(qū)外側壁。加入木瓜蛋白酶消化分離細胞30 min,加入無血清培養(yǎng)基終止消化,4 ℃離心10 min,棄上清液,PBS洗脫,計數(shù)細胞數(shù)量。加NSCs完全培養(yǎng)基(成分為B27/DMEM,含20 ng/mL bFGF、20 ng/mL EGF和1%體積分數(shù)的青霉素-鏈霉素),置于37 ℃、5%CO2、飽和濕度條件下培養(yǎng)。7 d后傳代,取生長良好的第3代NSCs備用。
1.3 ATRA最佳濃度篩選 將NSCs按1×104/孔接種于6孔板中,加入完全培養(yǎng)基,每2天更換1次培養(yǎng)基。分別加入0、10-8、10-7、10-6mol/L ATRA,培養(yǎng)7 d后通過倒置顯微鏡計算神經(jīng)球數(shù)量,以加入ATRA各濃度后神經(jīng)球數(shù)量與未加入ATRA時的神經(jīng)球數(shù)量比值表示細胞增殖能力,以細胞增殖能力最低的10-6mol/L作為ATRA最佳濃度,進行后續(xù)實驗。
1.4 細胞定向分化情況檢測 取第3代NSCs接種于6孔板中,加入含1%體積分數(shù)的青霉素-鏈霉素的B27/DMEM培養(yǎng)基,將細胞分為ATRA組和對照組,ATRA組加入10-6mol/L ATRA,對照組不加藥物。培養(yǎng)96 h后,采用流式細胞儀檢測細胞表面標記物,分別以NSE陽性標記為神經(jīng)元、GFAP陽性標記為星形膠質細胞、MBP陽性標記為少突膠質細胞、nestin陽性標記為NSCs。細胞百分數(shù)=鑒定的細胞數(shù)/總細胞數(shù)×100%。
1.5 CYP450家族基因檢測 取第3代NSCs接種于6孔板中,加入含1%體積分數(shù)的青霉素-鏈霉素的B27/DMEM培養(yǎng)基,將細胞分為ATRA組和對照組,ATRA組加入10-6mol/L ATRA,對照組不加藥物,分別處理6、12、24 h后提取RNA,反轉錄合成cDNA后用作模板,然后將cDNA與 RT2 SYBR Green MasterMix混合,再將混合物準確加入 RT2 Profiler PCR Array 的每一孔中,在Real-time PCR儀(ABI7500)上檢測藥物Ⅰ相代謝酶相關基因。本實驗僅觀察CYP450家族基因,篩選出兩組有統(tǒng)計學差異的基因,其他基因暫不研究。
1.6 CPR活性測定 取第3代NSCs,培養(yǎng)于含B27/DMEM、1%體積分數(shù)的青霉素-鏈霉素的6孔板中。將細胞分為ATRA組和對照組,ATRA組加入10-6mol/L ATRA,對照組不加藥物。培養(yǎng)48 h后,采用超速離心方式收集微粒體,采用ELISA試劑盒檢測CPR活性。用酶標儀在450 nm波長處測OD值,計算CPR活性。
1.7 P38 MAPK通路相關蛋白檢測 采用Western blotting法檢測P38 MAPK通路相關蛋白p-P38、P38表達。取第3代NSCs,培養(yǎng)在含B27/DMEM、1%體積分數(shù)的青霉素-鏈霉素的6孔板中。將細胞分為ATRA組和對照組,ATRA組加入10-6mol/L ATRA,對照組不加藥物。培養(yǎng)48 h后收集細胞蛋白,BCA法測定蛋白濃度。取適量蛋白提取液進行SDS-PAGE電泳,電轉移至硝酸纖維素膜上,5%脫脂奶粉室溫封閉后,分別加入一抗、P38(1∶800)、p-P38(1∶800)孵育過夜,以GAPDH為內參。ECL化學發(fā)光試劑顯色,Image J圖像分析系統(tǒng)測定各條帶灰度值,以目的條帶與內參條帶灰度值的比值作為目的蛋白的相對表達量。
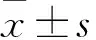
2 結果
2.1 兩組NSCs分化情況比較 對照組nestin陽性細胞占53.11%±6.60%,GFAP陽性細胞占29.89%±5.39%,NSE陽性細胞占11.75%±3.96%,MBP陽性細胞占5.24%±0.85%。ATRA組nestin陽性細胞占34.68%±6.61%,GFAP陽性細胞占35.08%±4.86%,NSE陽性細胞占23.65%±3.16%,MBP陽性細胞占6.59%±0.79%。ATRA組神經(jīng)元比例高于對照組,NSCs比例低于對照組(P均<0.05)。
2.2 兩組CYP450家族基因表達比較 與對照組比較,ATRA組P450家族基因中CYP26A1、CYP26B1、CYP26C1的表達上調(P均<0.05)。見表1。

表1 兩組CYP450家族基因表達情況比較
注:與對照組比較,*P<0.05。
2.3 兩組CPR活性比較 ATRA組CPR活性的OD值為29.85±3.94,對照組為20.88±3.21,ATRA組CPR活性較對照組升高(P<0.05)。
2.4 兩組p-P38、P38蛋白表達比較 ATRA組P38表達與對照組比較無統(tǒng)計學差異,p-P38表達高于對照組(P<0.05)。見表2。

表2 兩組P38、p-P38蛋白的相對表達量比較
注:與對照組比較,*P<0.05。
3 討論
20世紀90年代,Reynodls等[5]首先提出了NSCs的概念。其在成年小鼠腦紋狀體中分離出具有向多元化分化,在體外無限制分裂增殖的細胞群,具有這些特征的細胞被稱為NSCs。NSCs定向分化是目前干細胞應用的研究熱點。NSCs定向分化既受到干細胞自身基因的調控,也受外來信號和外部微環(huán)境的調控。ATRA是常見的誘導分化的化合物,可以與維甲酸受體RARα、RARβ(前腦、中腦、后腦和脊神經(jīng)節(jié))及RARγ(腦垂體和紋狀體)結合形成復合物并調控相關基因的表達,從而維持神經(jīng)細胞生長分化[6, 7]。維甲酸受體在神經(jīng)細胞中分布廣泛,為ATRA參與NSCs分化提供解剖基礎,使其有望成為神經(jīng)元損傷及包括AD、PD等退行性病變治療的有效藥物。但目前ATRA的神經(jīng)誘導分化作用尚不清楚。
神經(jīng)元是所有神經(jīng)系統(tǒng)疾病的功能細胞,參與所有信息的感知、傳遞、整合和神經(jīng)沖動的執(zhí)行,是臨床應用于神經(jīng)退行性疾病治療的新的熱點[8]。神經(jīng)元壞死或病變是很多神經(jīng)退行性疾病的病理基礎。近年研究發(fā)現(xiàn),提高大腦內神經(jīng)元數(shù)量是改善、緩解甚至治療AD和PD的方法之一,移植NSCs并促使其向神經(jīng)元分化,是AD、PD的潛在治療方案。在PD中,NSCs移植治療已經(jīng)取得了部分成功[9,10]。星形膠質細胞是哺乳動物腦內分布最廣泛的一類細胞,其功能包括支持屏障作用、營養(yǎng)性作用、修復和再生作用、維持神經(jīng)元周圍的K+平衡[11]。星形膠質細胞對神經(jīng)系統(tǒng)嚴重損傷、腦缺血預后及生存率有明顯的保護作用,可能會成為阿爾茲海默病潛在的治療方案[12]。本研究發(fā)現(xiàn),對照組NSCs占53.11%±6.60%,星形膠質細胞占29.89%±5.39%,神經(jīng)元占11.75%±3.96%;而ATRA組NSCs占34.68%±6.61%,星形膠質細胞占35.08%±4.86%,神經(jīng)元占23.65%±3.16%。ATRA組神經(jīng)元比例高于對照組,表明在正常情況下,NSCs主要向星形膠質細胞分化,而加入10-6mol/L ATRA可以誘導NSCs向神經(jīng)元分化,為未來NSCs的移植提供了可能。
CYP450為一類亞鐵血紅素-硫醇鹽蛋白的超家族,它參與體內絕大多數(shù)內源性、外源性物質(藥物、環(huán)境化合物)的代謝。在真核細胞中,CYP450主要分布在內質網(wǎng)和線粒體內膜上,是藥物代謝過程中的關鍵酶。NADPH-CPR是一種微粒體黃素蛋白,它特異性地參與了所有微粒體中CYP450的氧化還原反應,負責將電子從NADPH傳遞到P450,因此CPR參與調控類固醇合成的CYP450,影響藥物代謝。CYP26家族由CYP26A1、CYP26B1、CYP26C1三種酶組成,是ATRA代謝酶之一,當ATRA達到一定閾值濃度,能夠影響生殖細胞的分化方向(形成精原細胞或卵原細胞)[13]。Gocek等[14]研究證實,急性髓性白血病細胞系可通過ATRA影響粒細胞樣細胞分化,CPR還可增強ATRA誘導急性髓性白血病細胞中的mRNA和蛋白表達水平。本研究表明,在ATRA作用于成年小鼠NSCs的藥物代謝中,相比其他P450家族基因,CYP26A1、CYP26B1和CYP26C1的表達顯著上調,與CYP26家族基因表達變化一致的是CPR活性顯著增強,提示CYP26家族、CPR可通過參與ATRA代謝,可促進NSCs向神經(jīng)元方向分化,也為我們提供了一種通過影響CPR活性從而改變NSCs分化方向的可能。
P38是MAPK家族控制炎癥反應最重要的成員,在不同的刺激下激活,如外源性的脂多糖、紫外線以及不同的應激反應,從而在炎癥、細胞應激、凋亡、細胞周期和細胞生長等過程中起重要作用[15]。除此之外,P38 MAPK還參與了干細胞分化過程。P38 MAPK通路激活可促進成骨細胞分化[16]、牙髓干細胞向成牙本質細胞方向分化[17]、促進MSC分化為表皮細胞[18]。本研究通過Western blotting方法觀察ATRA對NSCs的作用,發(fā)現(xiàn)P38表達未見顯著差異,而p-P38表達則顯著增強,提示ATRA可能通過P38 MAPK通路參與NSCs的分化。
綜上所述,ATRA能夠抑制成年小鼠NSCs增殖,促進其向神經(jīng)元和星形膠質細胞分化。在此調控過程中,細胞色素P450 CYP26家族和CPR發(fā)揮重要的代謝作用,其調控可能通過P38 MAPK通路進行。
[1] Mckay R. Stem cells in the central nervous system[J]. Science, 1997,276(5309):66-71.
[2] Haque A, Banik NL, Ray SK. Emerging role of combination of all-trans retinoic acid and interferon-gamma as chemoimmunotherapy in the management of human glioblastoma[J]. Neurochem Res, 2007,32(12):2203-2209.
[3] Mangiarotti R, Danova M, Alberici R, et al. All-trans retinoic acid (ATRA)-induced apoptosis is preceded by G1 arrest in human MCF-7 breast cancer cells[J]. Br J Cancer, 1998,77(2):186-191.
[4] Yao Y, Liu S, Wang Y, et al. Suppression of cytochrome P450 reductase expression promotes astrocytosis in subventricular zone of adult mice[J]. Neurosci Lett, 2013,548:84-89.
[5] Reynolds BA, Weiss S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system[J]. Science, 1992,255(5052):1707-1710.
[6] Wagner E, Luo T, Drager UC. Retinoic acid synthesis in the postnatal mouse brain marks distinct developmental stages and functional systems[J]. Cereb Cortex, 2002,12(12):1244-1253.
[7] Jacobs S, Lie DC, Decicco KL, et al. Retinoic acid is required early during adult neurogenesis in the dentate gyrus[J]. Proc Nati Acad Sci U S A, 2006,103(10):3902-3907.
[8] Pastukhov YF, Plaksina DV, Lapshina KV, et al. Exogenous protein HSP70 blocks neurodegeneration in the rat model of the clinical stage of Parkinson's disease [J]. Dokl Biol Sciences, 2014,457(1):225-227.
[9] Kefalopoulou Z, Politiis M, Piccini P, et al. Long-term clinical outcome of fetal cell transplantation for Parkinson disease: two case reports[J]. JAMA Neurol, 2014,71(1):83-87.
[10] Yoon HH, Min J, Shin N, et al. Are human dental papilla-derived stem cell and human brain-derived neural stem cell transplantations suitable for treatment of Parkinson′s disease[J]. Neural Regen Res, 2013,8(13):1190-1200.
[11] 劉慧,王小軍,胡榮,等.星形膠質細胞[J].生理科學進展,2004,35(1):86-91.
[12] Lee IS, Jung K, Kim IS, et al. Human neural stem cells alleviate Alzheimer-like pathology in a mouse model[J]. Mol Neurodegener, 2015,10:38.
[13] 韓飛,劉智皓,吳風瑞,等.維甲酸和Cyp26基因家族與生殖細胞分化[J].細胞生物學雜志,2009,31(03):355-360.
[14] Gocek E, Marchwicka A, Bujko K, et al. NADPH-cytochrome P450 reductase is regulated by all-trans retinoic acid and by 1,25-dihydroxyvitamin D3 in human acute myeloid leukemia cells[J]. PLoS One, 2014,9(3):e91752.
[15] Ono K, Han J. The p38 signal transduction pathway: activation and function[J]. Cell Signal, 2000,12(1):1-13.
[16] Rey A, Manen D, Rizzoli R, et al. Evidences for a role of p38 MAP kinase in the stimulation of alkaline phosphatase and matrix mineralization induced by parathyroid hormone in osteoblastic cells[J]. Bone, 2007,41(1):59-67.
[17] Qin W, Lin ZM, Deng R, et al. p38a MAPK is involved in BMP-2-induced odontoblastic differentiation of human dental pulp cells[J]. Int endod J, 2012,45(3):224-233.
[18] 朱國俊,白曉東,付小兵,等.大鼠骨髓間充質干細胞誘導分化為表皮細胞的實驗觀察[J].感染、炎癥、修復,2004,5(4):140-142.
Regulationofall-trans-retinoicacidondifferentiationofneuralstemcellsinadultmice
LI Xianhong1, HU Hejuan, TANG Xiying, WU Jian, HUANG Jinzhong, YAO Yunyi
(1 The First People's Hospital of Changzhou Affiliated to Soochow University, Changzhou 213000, China)
ObjectiveTo investigate the effects of all-trans-retinoic acid (ATRA) on signaling pathway and regulations of neural stem cells (NSCs) in adult mice and the effects on the family of cytochrome P450 (CYP450).MethodsNSCs were isolated from the sub-ventricular zone (SVZ) of brain in adult mice and then were cultured. The cells were divided into the ATRA group and blank control group. The ATRA group was added with 10-6mol/L ATRA. Flow cytometry (FCM) was used to detect the cell surface markers in the two groups, and we calculated the percentage of neurons, astrocytes, oligodendrocytes and the percentage of NSCs accounting for total cells. The real-time PCR was used to detect the related gene expression of CYP450 family, and we screened statistically significant gene. ELISA was applied to detect the activity of cytochrome P450 reductase (CPR). The expression levels of P38 and p-P38 were detected by using Western blotting.ResultsIn the ATRA group, NSCs mainly differentiated into neurons, and some differentiated into astrocytes, with less differentiation of oligodendrocytes. Compared with the blank control group, the expression of CYP26A1, CYP26B1 and CYP26C1 in the P450 family genes of the ATRA group was up-regulated (allP<0.05). The activity of CPR and the expression of p-P38 protein in the ATRA group were higher than those in the blank control group (bothP<0.05).ConclusionATRA promotes the differentiation of mouse NSCs into neurons, and it may play a regulatory role by up-regulating the CYP26 family genes in CYP450 and increasing CPR activity and the P38 MAPK pathway.
all-trans-retinoic acid; neurodegeneration; neural stem cells; cytochrome P450; cytochrome P450 reductase; P38 MAPK pathway
10.3969/j.issn.1002-266X.2017.42.003
R741
A
1002-266X(2017)42-0009-04
江蘇省自然科學基金資助項目(BK20130219);江蘇高校“青藍工程”科研資助項目。
李先紅(1990-),女,碩士在讀,主要研究方向為神經(jīng)變性性疾病。E-mail: tiancheng503@126.com
黃金忠(1973-),男,博士,碩導,主要研究方向為神經(jīng)變性性疾病。E-mail: jshjz@163.com;
姚允怡(1981-),男,博士,主要研究方向為神經(jīng)生物學和藥物代謝調控。E-mail: yaoyunyiyyy@126.com
2017-06-25)

